三种香茅精油的化学成分及体外抗氧化和抗炎活性评价
2021-11-23石小翠曹冬花鲁建美宋兴震罗明楚肖春芬许又凯
石小翠,曹冬花,李 佳,鲁建美,宋兴震,罗明楚,肖春芬,许又凯,*
(1.中国科学院大学生命科学学院,北京 100049;2.中国科学院西双版纳热带植物园,云南勐腊 666303;3.南华大学附属长沙中心医院,湖南长沙 410004;4.普洱学院生物与化学学院,云南普洱 665000)
香茅属(Cymbopogon)植物是禾本科植物的一大重要类群,主要分布于非洲、亚洲和美洲的热带和亚热带地区[1−2],我国主产于广东、台湾、海南、福建、广西、四川、贵州和云南等省,在其生长地区,广泛用作食品和药品。在泰国、新加坡、越南等东南亚国家,人们用香茅草(又名柠檬草,C.citratus)白色根茎做菜,或将香茅草切丝放于做好的米粉、蔬菜或肉类上, 或作为芳香调料与肉类一起烹饪[3]。在印度,柠檬草和曲序香茅(C. flexuosus)用于治疗发烧和消化系统疾病[1]。同时由于香茅属植物精油具有杀虫[4−7]、抗肿瘤[8−9]、治疗HIV 阳性并发症鹅口疮[10]、抗炎[11−13]、抗氧化[14−15]和杀菌[16−19]等多种生物活性,广泛应用于食品、药品、化妆品等行业[1]。
精油又称挥发油,是多种挥发性物质的混合物,成分复杂多样。受地理位置、环境、气候和采收季节等多种因素的影响,不同香茅属植物精油的主成分及含量具有较大差异[20]。例如PADALIA[21]等对印度地区种植的芸香草精油成分分析时,发现精油中主成分为顺-1-甲基-4-异丙基-2-环己烯-1-醇(26.7%),而CHAUHAN 等[22]研究种植于喜马拉雅山底部的芸香草时,发现其主成分为反式柠檬醛(25.9%)。尽管如此,大多数的研究表明香茅属植物含顺式柠檬醛和反式柠檬醛的比例较高,精油中主要成分多为烯萜、酚、醇[20]。已有研究表明香茅属植物精油具有良好的抗氧化活性,应用于营养食品、功能食品配方中,可以延缓食品中的脂质氧化[14,20]。民族药理学报道了香茅属植物在消炎镇痛方面具有悠久的使用历史[1,20],现代科学研究对一些香茅属植物精油进行体外抗炎活性测定时,也发现其具有良好的抗炎生物活性[23],但是香茅属植物中除柠檬草以外,其他植物精油的抗氧化活性和抗炎活性研究较为缺乏。
本研究以中国科学院西双版纳热带植物园内资源丰富的爪哇香茅(C. winteranus)、柠檬草(C.citratus)和芸香草(C. distans)为研究材料,测定了这三种植物精油的化学成分、体外抗氧化和抗炎活性,以便提高我们对于香茅属植物精油的认知,为香茅属植物资源开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
柠檬草、爪哇香茅和芸香草 均于2018 年8 月采自中国科学院西双版纳热带植物园(以下简称版纳植物园),由版纳植物园肖春芬高级实验师鉴定无误后,标本于干燥密封的条件下保存在版纳植物园标本馆内,凭证标本号分别为SXC001、SXC0002 和SXC0003;小鼠单核巨噬细胞白血病细胞株RAW 264.7 购于中国科学院昆明动物研究所动物种质资源库;胎牛血清、磷酸盐缓冲液(PBS)、青/链霉素、DMEM 高糖培养基 以色列Biological Industries公司;抗坏血酸(维生素C,VC)、地塞米松(Dexamethasone,Dex) 上海阿拉丁生化科技公司;1,1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl,DPPH)、二甲基亚砜(DMSO) 北京索莱宝科技公司;细菌脂多糖(LPS) 美国Sigma 公司;Griess 试剂盒、 MTS( 3-( 4,5-Dimethylthiazole-2-yl) -5-[3-( carboxymethoxy) phenyl]-2-( 4-sulfonatophenyl) -2H-tetrazole-3-ium)试剂盒 美国Promega 公司;乙醇(分析纯,AR) 天津大茂化学试剂厂。
安捷伦7890/5975C 型气相色谱-质谱联用仪美国安捷伦公司;NIB-100 倒置生物显微镜 宁波永新光学公司;QP-80 型CO2培养箱、TGL-16M 高速冷冻离心机、BSC-1100IIB2-X-X 生物安全柜 浙江鑫贝西生物技术公司;振荡器 上海迈瑞尔化学技术公司;MK3 酶标仪 美国Thermo scientific 公司;旋转蒸发仪 德国Heidolph 公司;电加热套 天津泰斯特仪器公司;HH-1 型水浴锅 江苏常州市鸿泽仪器公司;实验中所用玻璃仪器 均为国产。
1.2 实验方法
1.2.1 植物精油提取及成分鉴定
1.2.1.1 植物精油的提取 采集新鲜材料,去除干枯及腐烂部分,切碎。取约500 g 的样品放于球形烧瓶中加入3000 mL 去离子水,采用同步蒸馏溶剂萃取法提取,水溶液一侧150 ℃下加热,有机溶剂乙醚侧45 ℃水浴加热,3 h 后收集精油的乙醚溶液,通过减压蒸馏(−0.06 MPa,30 ℃)去除乙醚即得精油样品,称重后置于冰箱(4±2)℃保存备用。植物精油得率由下式得出:

1.2.1.2 精油成分鉴定 精油挥发性成分采用气相色谱-质谱联用法(GC-MS)进行鉴定,样品使用正己烷稀释至5 μg/mL,设置相应参数,采用自动进样进行检测。
GC 条件:色谱柱:Agilent HP-5MS 石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:40 ℃保持1 min,以3 ℃/min 升至150 ℃,然后以10 ℃/min 升至250 ℃,保持10 min;载气(He)流速6 mL/min,进样口压力90 kPa,进样量1 μL;分流比30:1。
MS 条件:质谱条件:电子轰击离子源,电子能量70 eV,离子源温度230 ℃,四级杆温度150 ℃,扫描范围m/z 50~550。
成分鉴定:通过NIST08 数据库对质谱图进行比对获得初步鉴定结果,运用公式转换物质保留时间为保留指数,与相关文献中气相色谱的保留指数[24]比对,从而对精油的化学成分定性。色谱峰用相对面积归一化法定量,计算各组分的相对含量。保留指数由一系列直链烷烃(C8~C28)作为参考,计算公式为:
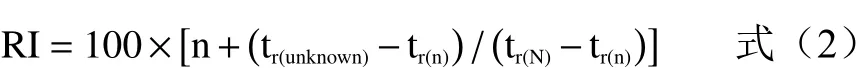
式中,n 为未知化合物流出前的正构烷烃所含的碳原子数,tr(n)和tr(N)分别为未知化合物流出前后正构烷烃的保留时间,tr(unknown)为未知化合物的保留时间。
1.2.2 体外抗氧化活性测定方法(DPPH 法) 无水乙醇配制100 μmol/L 的DPPH 溶液,4 ℃避光保存,备用。预试验时发现待测样品的IC50值浓度范围差异较大,因而从最高浓度起2 倍稀释将样品用无水乙醇配制为不同浓度范围的待测液,柠檬草精油溶液的浓度范围为0.8~0.05 mg/mL,爪哇香茅精油溶液的浓度范围为10~0.63 mg/mL,芸香草精油溶液的浓度范围为4~0.25 mg/mL,以常用抗氧化剂抗坏血酸(Vc,浓度范围为20~1.25 μg/mL)为阳性对照。取100 μL 待测液与100 μL DPPH 溶液混匀,在室温下避光反应30 min 后,517 nm 波长下测吸光度值,每个样品平行测定3 次取平均值,清除率按下式计算[25]:

式中,OD1为待测液+DPPH 的吸光度;OD2为待测液+无水乙醇的吸光度;OD3为DPPH 溶液+无水乙醇的吸光度。
1.2.3 体外抗炎活性测定方法
1.2.3.1 细胞培养 RAW 264.7 细胞使用完全培养基(DMEM 高糖培养基中加入10%(V/V)胎牛血清、100 U/mL 青霉素、100 μg/mL 链霉素),置于37 ℃、5% CO2条件下培养箱培养,每2 d 传代一次。
1.2.3.2 细胞活力测定 MTS 测定细胞活性的原理与MTT 类似,代谢活跃的巨噬细胞在脱氢酶产生的NADPH 和NADH 作用下可将MTS 还原为一种可溶于培养基的甲臜产物,生成甲臜量与活细胞数目呈正相关,测定吸光度可计算出相对细胞活力[25]。将处于对数生长期的RAW 264.7 细胞调整至细胞密度1×106个/mL,以100 μL/孔接种于96 孔板中。培养18 h 后,除去原有培养基,加入100 μL 含有不同浓度精油的培养基(8、4、2、1 和0.5 μg/L),空白组只加入培养基,每组设3 个平行。置培养箱中培养24 h后,采用MTS 试剂盒检测精油对RAW 264.7 细胞活力的影响[26],酶标仪492 nm 下测定OD 值,计算细胞存活率。

1.2.3.3 一氧化氮(NO)生成量测定方法 将处于对数生长期的 RAW 264.7 细胞调整至细胞密度1×106个/mL,以100 μL/孔接种至96 孔板,用1 μg/mL LPS进行诱导刺激,同时加入待测精油(浓度从8 μg/mL开始2 倍稀释)处理,设置不含药物组、地塞米松(Dex)阳性药物组和空白培养基组做对照。培养24 h 后收集上清液,按Griess 试剂盒说明书检测上清液中的NO 含量[27],并计算NO 生成抑制率,从而计算半数抑制浓度(IC50值)。

1.3 数据处理
采用Excel 2010(美国Microsoft 公司)、SPSS Statistics 25(美国IBM 公司)进行分析,Origin 2017(美国OriginLab 公司)进行图处理,所有结果以平均值±SD(标准偏差)表示。组间比对采用单因素方差分析,P 值小于0.05 具有统计学意义,采用回归分析计算IC50值。
2 结果与分析
2.1 三种香茅属植物精油的化学成分分析
三种香茅属植物柠檬草、爪哇香茅和芸香草的精油得率分别为0.22%、0.9%、0.37%(Wt%,鲜重)。三种植物精油共鉴定出54 种成分,其中柠檬草22 种(占精油总含量的79.10%)、爪哇香茅25 种(占精油总含量的91.40%)、芸香草26 种(占精油总含量的96.48%),具体如表1 所示。三种植物精油的成分差异较大,柠檬草的主要成分为反式柠檬醛(36.12%)、顺式柠檬醛(26.60%)、月桂烯(8.83%),与LI 等[28]的研究结果基本一致;爪哇香茅主要成分为(+)-香茅醛(37.85%)、香叶醇(15.48%)、香茅醇(7.52%),与CHAGONDA 等[29]报道的主成分相同,但含量有所差异;芸香草的主要成分为香叶醇(34.76 %)、乙酸香叶酯(18.95%)、胡椒酮(7.09%)、甲基丁香酚(6.72%),而PADALIA 等[21]研究芸香草精油时发现香叶醛为含量最高的物质,与本研究结果有差异。这三种植物的精油的主成分及含量与前人的研究相比,含量或成份有所差异,这可能是由于采收季节、气候、提取方法、分析仪器及植物生长小环境差异等原因引起的。
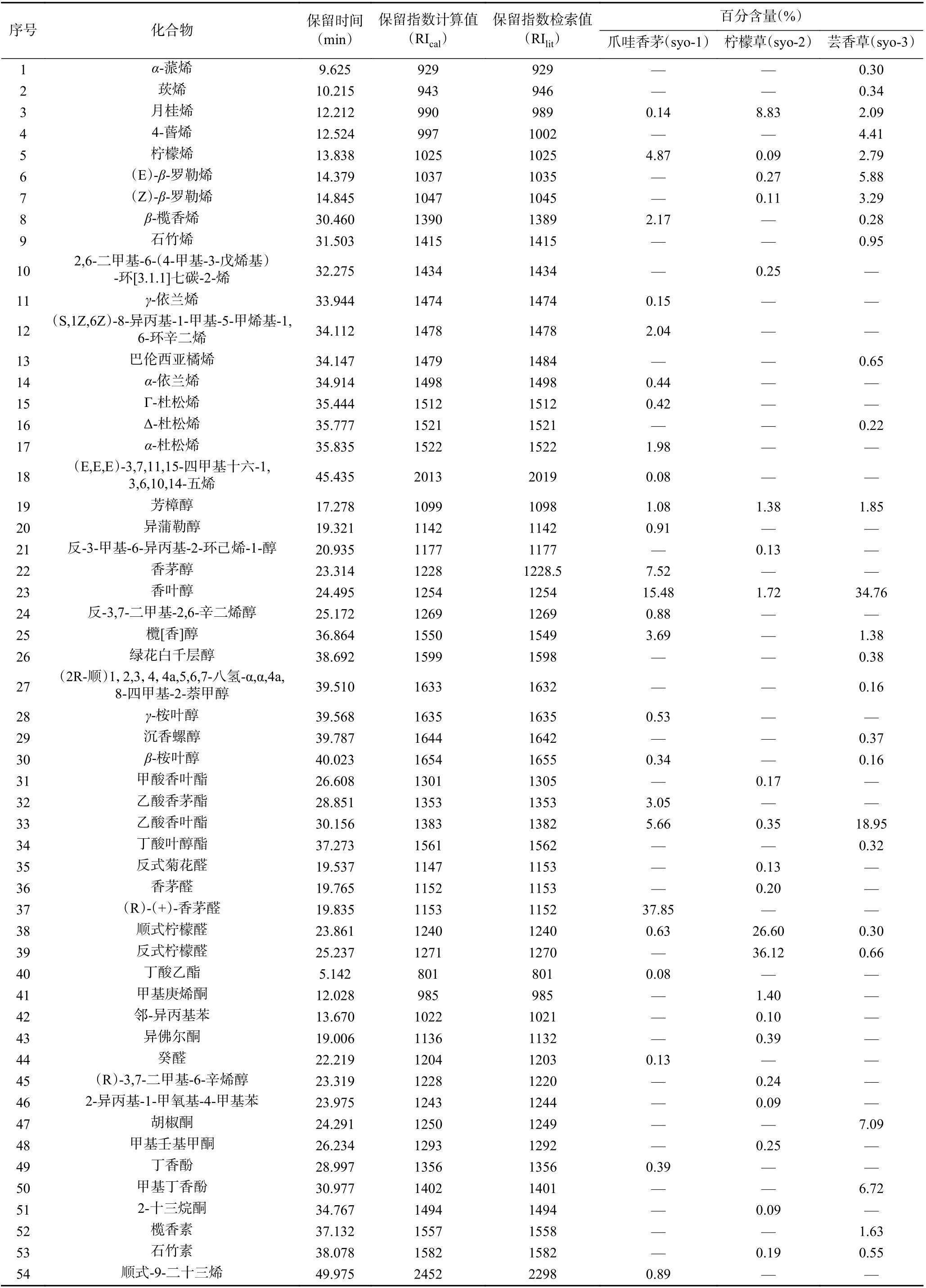
表1 香茅属三种植物精油化学成分Table 1 Chemical compositions of the essential oils from three Cymbopogon plants
从表2 中可看出,三种香茅属植物精油的各类化合物中的萜烯类、萜醇类、萜酯、萜醛类等萜类物质占比较大,爪哇香茅、柠檬草和芸香草精油中的萜类物质总含量分别为 89.91%、 76.35%以及80.49%。虽然这三种植物精油的主要成分都为萜类,但各精油中萜类物质的主要化合物类型不同,柠檬草精油的萜类化合物主要类型为萜醛类化合物(63.05%),爪哇香茅精油中萜类化合物主要类型为萜醇类化合物(30.43%)和萜醛类(38.48%),芸香草精油的萜类化合物主要类型为萜醇类化合物(39.06%)。

表2 香茅属三种植物精油化合物类型汇总表Table 2 Compound types of essential oils from three Cymbopogon plants
2.2 三种香茅属植物精油的抗氧化活性评价
DPPH 自由基的清除程度可反映物质的抗氧化活性[25]。为了了解三种香茅属植物精油的抗氧化活性,实验测定了在不同浓度下精油对DPPH 自由基的清除率,结果如图1 所示。爪哇香茅浓度由0.05 mg/mL 上升到0.80 mg/mL 时,DPPH 自由基的清除率由22.93%上升到58.56%;柠檬草浓度由0.63 mg/mL 上升到10.00 mg/mL 时,DPPH 自由基的清除率由25.83%上升到67.54%;芸香草实验浓度由0.25 mg/mL 上升到4.00 mg/mL 时,DPPH自由基的清除率由26.66%上升到56.35%;抗坏血酸浓度由1.25 μg/mL 上升到20.00 μg/mL 的时,DPPH 自由基的清除率明显上升,由18.20%上升到89.81%。因此,三种香茅属植物精油及阳性对照药物抗坏血酸对DPPH 自由基的清除率与样品浓度相关,DPPH 自由基的清除能力随着样品浓度的增大而增强,呈一定的剂量依赖性。三种香茅属植物精油的IC50值分别为(0.417±0.119)mg/mL(爪哇香茅)、(3.481±0.842)mg/mL(柠檬草)和(2.528±0.96)mg/mL(芸香草),抗氧化活性高低依次为爪哇香茅、芸香草、柠檬草。爪哇香茅(主含香茅醛)的抗氧化活性高于芸香草(主含香叶醇),与杨欣等[30]报道的爪哇香茅精油的高沸点提取段(主含香叶醇)抗氧化活性高于低沸点提取段(主含香茅醛)有差异,表明芸香草与爪哇香茅的抗氧化活性差异可能不是由主成分差异引起的,它们的抗氧化活性差异可能是精油的各个组分协同效应引起的。此外,三种植物精油的萜类物质总含量高低与抗氧化活性大小排序相同,表明香茅属植物精油的抗氧化活性可能与萜类物质的总含量有关。然而,三种植物精油的IC50值均高于阳性对照品抗坏血酸的IC50值(0.005±0.002)mg/mL,说明三种植物精油的抗氧化活性均弱于抗坏血酸。

图1 各物质对DPPH 自由基清除率的影响Fig.1 DPPH radical scavenger activity
2.3 三种香茅属植物精油对RAW 264.7 细胞活力的影响
在相对细胞活力明显下降的剂量下,精油对于细胞的损伤过强,对LPS 炎症诱导模型的NO 生成量有一定的影响。为确定待测样品的适宜实验浓度,本实验测定了不同浓度下三种香茅属植物精油处理RAW 264.7 细胞时的细胞活力。如图2 所示,与空白对照相比较,三种香茅属植物精油仅在实验浓度8 μg/mL 下对RAW 264.7 细胞活力具有极显著(P<0.01)的抑制作用;在低剂量0.5~4 μg/mL 浓度下,RAW 264.7 细胞活力有逐渐增强的趋势,并且爪哇香茅精油在4 μg/mL 浓度下和柠檬草精油在4、2 μg/mL 的浓度下对RAW 264.7 细胞的活力具有明显(P<0.05)的促进作用。该结果表明三种香茅属植物精油在一定的浓度范围内对RAW 264.7 细胞活力具有一定促进作用,但过高浓度的精油会对RAW 264.7 细胞造成损伤,细胞活力被显著抑制,因此三种香茅属植物精油的使用浓度宜在4 μg/mL 以下。

图2 三种香茅属植物精油对RAW 264.7 细胞活力的影响Fig.2 Effect of the essential oils of three Cymbopogon plants on RAW 264.7 cells viability
2.4 三种香茅属植物精油对LPS 诱导RAW 264.7 细胞生成NO 的影响
NO 是一种高活性的氮自由基,由诱导型一氧化氮合酶(iNOS)产生,一氧化氮参与多种生物过程,是宿主先天免疫和多种病原体炎症反应的重要介质[31]。LPS 可刺激多种细胞如平滑肌细胞、巨噬细胞和肝细胞等,诱导iNOS 生成NO[32−33],检测LPS 致炎模型的NO 生成量可表示炎症损伤程度。如图3 所示,三种香茅属植物爪哇香茅、柠檬草和芸香草精油在不同的试验浓度下,NO 的生成量均显著(P<0.05)低于LPS 处理组,随着精油浓度的增加NO 生成量总体呈下降的趋势,表明在试验浓度下,三种香茅属植物精油均对LPS 诱导RAW 264.7 细胞炎症状态具有缓解作用,呈一定的剂量依赖性。三种植物精油在高于2 μg/mL 的浓度时,三种香茅属植物精油的NO 产生量与阳性药物组地塞米松的NO 生成量无显著差异(P>0.05),表明三种植物精油在2~4 μg/mL的浓度下具有良好的抗炎效果,并且不损伤RAW 264.7 细胞,作为抗炎药物、抗炎功能产品开发具有较大的潜力。

图3 三种香茅属植物精油对LPS 诱导RAW 264.7 细胞生成NO 的影响Fig.3 Effect of the essential oils of three Cymbopogon plants on NO production in LPS-induced RAW 264.7 cells
GBENOU 等[34]认为精油抗炎的物质基础可能是大量的醛分子。本研究中柠檬草精油含有63.05%的萜醛类物质,爪哇香茅中含有萜醛类物质37.85%,而芸香草中几乎不含萜醛类物质,并且三种香茅精油的NO 生成抑制强度顺序为柠檬草(IC50值为(0.472±0.121)μg/mL)>爪哇香茅(IC50值为(0.632±0.147)μg/mL)>芸香草(IC50值为(0.669±0.131)μg/mL),柠檬草的抗炎活性最好,爪哇香茅次之,芸香草的抗炎活性较差,抗炎活性与醛类物质含量呈一定的相关性,表明香茅属植物精油的抗炎活性高低可能与所含大量萜醛类物质有关,与GBENOU 等[34]的观点相符。但香茅属植物精油的抗氧化活性与所含萜类物质总含量的关系,以及香茅属植物精油的抗炎活性与萜醛类物质含量的相关性,还有待进行更为深入的实验研究而探讨。
3 结论
本研究测定分析出了三种香茅属植物精油的54 种化合物,成分主要为萜类物质,在研究三种香茅属植物精油的体外抗氧化活性时发现精油的抗氧化活性与所含萜类物质总量有一定的相关性。三种香茅属植物精油具有一定的体外抗氧化活性,但弱于与常用强抗氧化剂抗坏血酸。三种香茅属植物精油具有良好的体外抗炎能力,特别是在2~4 μg/mL 的浓度下,与阳性对照地塞米松对照(10 μmol/L)活性相当,其抗炎活性可能与香茅属植物精油中萜醛类物质含量有关。
