microRNA在人皮肤基底细胞癌中的研究进展
2021-11-22崔晨阳肖志波
崔晨阳 肖志波
[摘要]基底细胞癌是一种来源于基底细胞或皮肤附属器组织的低度恶性肿瘤,其发病率逐年增加,且发病人群具有年轻化的趋势。其转移率较低,但常与恶性结局相关,早期发现并完全切除通常会取得很好疗效。临床困扰的主要难题在于局部晚期侵袭性肿瘤以及复发的肿瘤,目前经典的治疗方法仍是常规手术切除和莫氏显微外科手术切除,其他方法有局部理化治疗以及新兴的靶向治疗如拮抗SMO受体等,但由于副作用及耐药性等原因,有必要寻找更为合适的分子靶点。越来越多的研究证据表明miRNAs在基底细胞癌发生发展过程中起到关键的调控作用。本文就miRNAs在基底细胞癌中的差异表达、作用及其潜在的临床应用价值进行综述,为后续的科学研究或基底细胞癌的预防、早期诊断和预后判断提供参考。
[关键词]microRNA;基底细胞癌;表达差异;作用机制
[中图分类号]R739.5 [文献标志码]A [文章编号]1008-6455(2021)06-0177-04
Research Progress of microRNA in Human Skin Basal Cell Carcinoma
CUI Chen-yang,XIAO Zhi-bo
(Department of Plastic Surgery, the Second Affiliated Hospital of Harbin Medical University, Harbin 150081,Heilongjiang,China)
Abstract: Basal cell carcinoma (BCC) is a kind of low-grade malignant tumor originated from basal cells or skin adnexal tissues. Its incidence rate increases year by year, and the incidence population tends to be younger. The rate of metastasis is low, but it is often associated with malignant outcomes, and early detection and excision completey usually yield good results. The main challenge of clinical problems lies in locally advanced invasive tumors and recurrence tumors. The classic treatment is still a routine surgical resection and Mohs microsurgery, local physical and chemical treatment and other emerging methods such as antagonizing SMO receptor therapy also have applicationed, however, due to side effects and drug resistance, it is necessary to look for more suitable molecular targets. More and more research evidence indicates that miRNAs play a key regulatory role in the development of basal cell carcinoma. In this review, the differential expression and the role of miRNAs in BCC and its potential clinical application values are reviewed, so as to provide reference for the subsequent scientific research or prevention, early diagnosis and prognostic judgment of BCC.
Key words: microRNA; basal cell carcinoma; expression difference; pathogenesis
基底细胞癌(Basal cell carcinoma,BCC)最常见的诱因是紫外线照射,其次是砷接触和免疫抑制状态等,它们会引起肿瘤基因功能的改变及相关通路活性的改变,导致肿瘤的发生[1]。近年来,对基因表达调控机制的研究表明,miRNAs在多维度参与调控BCC的发生和发展[2]。通过分析miRNAs在正常皮肤组织和BCC组织中的表达差异,预测其相应的靶基因和(或)靶蛋白,上调或下调相应的信号分子,能够实现在基因水平上对BCC的发生和发展进行调控,为其治疗提供崭新的平台和思路。
miRNAs是一类广泛存在于生物体内的长18~22个核苷酸的内源性非编码小分子RNA。它的结构高度保守,在进化中的意义越来越受到研究者们的重视[3]。成熟的miRNA可以在转录后调控等阶段完全或部分结合其靶mRNA,造成其直接降解或达到抑制其转录的效果,最终影响细胞增殖、凋亡、侵袭和转移等生物学过程。
1 BCC中miRNAs的异常表达
当疾病发生,受累器官及组织中的各种miRNA表达谱会重新分布,呈现出某种疾病特殊的表达。对影响肿瘤发生发展的miRNAs的寻找主要是通过生物芯片或测序手段发现其表达差异并通过RT-qPCR验证,进一步结合生物信息数据库来对其可能的上下游靶分子寻找[4],然而这些方法只是基于组织水平表达含量差异和碱基互补配对原则的预测,目标miRNA的作用还需要一系列细胞、分子及动物水平的功能性验证。这一小节列举了一些学者采用芯片及高通量测序等手段根据患者和对照人群组织或血清特异性表达谱、BCC发病诱因、不同亚型的生物学行为差異所筛选出的差异表达miRNAs,需要注意的是,由于这些研究未进行功能学实验验证,数据会存在假阳性。
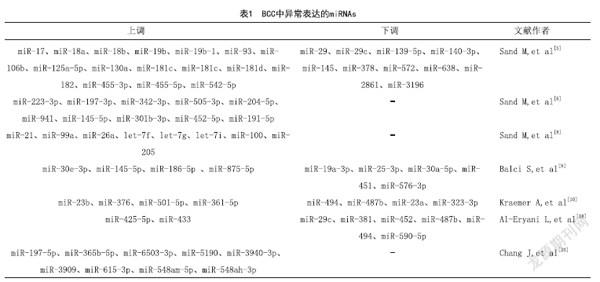
1.1 筛查患者和健康个体组织及血清的miRNAs:Sand M等[5]在基于miRBase 16的芯片分析研究中,描述了BCC中16个显著上调和10个显著下调的miRNAs(数据见表1)[5],在基于miRBase 21的超高通量测序研究中,他们分析了vismodegib处理后的BCC中miRNAs表达变化,报告了13个显著上调的miRNAs(数据见表1)[6]。之后通过RT-qPCR对BCC与正常皮肤中对miR-17-92簇和miR-143-145簇进行差异表达检测,发现miR-145-5p在BCC中的表达显著降低[7]。最新的研究[8]使用高通量测序对BCC中有差异表达的miRNAs进行分析,展示了8个显著上调的miRNAs。见表1。
体液循环中的miRNAs主要来自以下途径:损伤的组织或破裂的细胞释放,外泌体的微泡(MV)分泌或RNA結合蛋白(RBP)分泌。给人体传输养分、代谢废物的体液中miRNAs的表达谱在不同健康问题情况下存在差异,按照这一原理,它可用于疾病诊断,疗效评价和疾病预后判别。Balci S等通过高通量RT-qPCR比较了非黑素瘤皮肤癌患者和正常对照组的血清miRNAs表达谱,发现了4个显着上调和5个显着下调的miRNAs。见表1[9]。
1.2 紫外线对角质形成细胞中miRNAs表达的影响:Anne Kraemer等[10]首先通过TaqMan低密度阵列(TLDA)比较紫外线照射后角质形成细胞中的miRNAs变化,UVA及UVB照射的细胞与未辐照细胞相比,TLDA分别检测到27个(13个上调,14个下调)以及28个(9个上调,19个下调)有表达差异的miRNAs,其中上调最高的在UVA及UVB中分别为miR-23b、miR-376以及miR-501-5p和miR-361-5p,降低最多的分别为miR-494、miR-487b以及miR-23a、miR-323-3p。在UVA和UVB照射后,miR-98,miR-323-3p,miR-330-3p,miR-376a,miR-494,miR-598均下调,而miR-191,miR-376c和miR-501-5p全部上调。接着,通过RT-qPCR证实了miR-23b,miR-361-5p,miR-191和miR-376c的上调以及miR-10a和miR-532-5p的下调。其中,miR-23b被认为是人类角质形成细胞分化的标志物[11]和肿瘤转移的多向调节因子,它在表皮干细胞的命运和皮肤癌变中起着重要作用。与高侵袭性恶性皮肤肿瘤相关的Ras相关蛋白2基因(RRAS2)是miR-23b的一个直接靶标点[12]。
1.3 砷暴露对皮肤肿瘤miRNAs表达的影响:除了阳光中紫外线照射外,导致BCC的第二大原因是长期暴露于砷中,而对于饮用水和食物中砷含量超标的人群来讲,砷是导致BCC发生的主要原因[13]。然而砷导致BCC的具体机制并不清楚,有证据表明突变并非主要驱动因素,已有假设包括DNA修复抑制、细胞周期途径失调和包括组蛋白乙酰化、甲基化、磷酸化等的表观遗传修饰以及miRNAs差异表达[14-16]。与非暴露个体相比,慢性砷暴露下miR-21的表达增加,为了研究其在砷引起的皮肤损伤中的作用,Banerjee 等[17]对比暴露于砷情况下的患者和无症状者,miR-21在患者中表达明显更高,体外实验结果与其一致,生存蛋白pAKT和PI3K的表达水平也随之升高,miR-21的下游靶点PTEN和PDCD4的表达与其表达水平呈负相关。Laila Al-Eryani等[18]通过TaqMan? Array分析了暴露于高浓度砷的饮用水中的皮肤癌及癌前病变的miRNAs表达谱,与良性角化过度和鳞状细胞癌相比,BCC中有6个miRNAs (miR-29c、miR-381、miR-452、miR-487b、miR-494和miR-590-5p)表达下调,而miR-425-5p及miR-433在BCC及SCC中均上调,被认为与肿瘤的恶性程度相关。这些miRNAs可能是砷诱发的BCC的潜在生物标志物或治疗靶点。
1.4 不同亚型BCC的miRNAs表达差异:Heffelfinger等[19]在一项测序研究中比较了结节型和浸润型BCC的miRNAs表达,他们发现了20个具有显著差异表达的miRNAs。miR-183在几种恶性肿瘤中抑制侵袭和转移,其表达水平在浸润型始终低于结节型肿瘤,这可能是侵袭能力差异的一个潜在因素。
2 miRNAs在BCC中的生物学作用及机制
2.1 与细胞生长(增殖,细胞周期)相关的miRNAs
2.1.1 miR-145、miR-302:Mir-145抑制能促进人胚胎干细胞分化的OCT4基因,该基因在自我更新和维持多能性中发挥重要作用[21]。Chinnathambi S等[22]发现抗癌药地西他滨可引起皮肤角质形成细胞的DNA去甲基化,刺激内源性OCT4蛋白的表达,并出现与其他OCT4+细胞相似的增殖作用,作为其抑制因子,mir-145的表达也增加了。还发现能够恢复皮肤肿瘤细胞胚胎干细胞样特征的mir-302[23]的表达在克西他滨治疗后也增加了。另一种抗癌药物阿霉素的治疗仅诱导已经表达OCT4的细胞中mir-145的表达,这可能表明地西他滨和阿霉素的组合对患者的正常组织有益。
2.1.2 miR-203:Sonkoly等[24]发现miR-203在BCC中的表达显着下调。MiR-203是在皮肤中表达最丰富的miRNA,且在角质形成细胞中特异性表达。通过抑制干细胞以促进表皮分化,miR-203抑制了角质形成细胞的增殖和c-JUN基因的表达。在生理条件下,miR-203与它的靶基因形成增殖与分化之间平衡的调控回路。在BCC的发病机制中,刺猬通路(Hedgehog,HH)和表皮生长因子受体(EGFR)/MEK/ERK/c-JUN信号通路的激活可以抑制miR-203的表达,影响细胞增殖和细胞周期调控,导致恶性肿瘤的发生,因此miR-203可能是BCC的潜在治疗靶点。后来,Wei T等[25]发现IL-8是miR-203在人角质形成细胞研究中的调控靶点。
2.1.3 miR-451a:Sun等[26]在人BCC组织和小鼠BCC模型(k5tTA/TREGLI1)中发现miR-451a显著减少。一系列的体外研究表明,mir-451a抑制细胞增殖,阻断细胞周期并抑制集落形成,进一步的研究表明,它直接与转录因子TBX1(602054)基因的3'-UTR结合并抑制其表达。在BCC的发展过程中,miR-451a含量的降低使TBX1受到的抑制作用下降,导致细胞恶性增殖。
2.1.4 miR-1231:环状RNA(Circular RNAs, circRNAs)是一组内源性非编码RNA,其共价闭合环由mRNA转录前的5'端和3'端形成。最近的研究表明circRNAs具有多种功能,例如调节转录、与RNA结合蛋白相互作用及充当miRNAs的海绵,在某些情况下,circRNAs还具有作为蛋白质翻译模板的能力[27]。Yating Li等[2]发现CircRNA-0005795在BCC患者组织中表达上调,进一步研究发现其作为竞争性RNA,像“海绵”一样靶向miR-1231,在转录后水平上使miRNA-1231的调控功能失活,进而促进BCC生长。
2.2 与细胞死亡(凋亡,自噬)相关的miRNAs
2.2.1 miR-26a:miR-26a不仅可以靶向PTEN[28]抑制角质形成细胞的增殖和迁移,还可以在UVB照射后表达升高,并通过抑制组蛋白甲基转移酶EZH2促进角质形成细胞凋亡。MYC基因是miR-26a的上游基因,Zhang T等[29]认为MYC基因过表达导致UVB辐射损伤后的细胞通过阻断miR-26a逃避凋亡。因为其抑制可导致UVB照射后细胞凋亡的增加,EZH2可能是预防和治疗皮肤癌的潜在靶点。
2.2.2 miR-383:STAT3可下调miR-383启动子的转录,通过抑制UV诱导的DNA损伤来减少皮肤肿瘤细胞的凋亡。在A431细胞中,microRNA-383通过靶向ATR的3UTR抑制ATR的表达,而STAT3可以促进ATR的激活。STAT3可能通过STAT3/miR-383/ATR轴发挥其保护作用[30]。
2.2.3 miR-34a:与野生型细胞相比,p53突变型角质形成细胞中miR-34a的下调介导了IRT1表达的增加,并增强了它们的凋亡抗性[31]。此外,BCC患者血清中miR-34a的表达明显低于健康个体。在BCC患者中,低表达组患者的中位无进展生存期短于高表达组,其表达水平与肿瘤大小、组织学类型和淋巴结转移相关[32]。综上所述,miR-34a在BCC的发生中具有调节作用且与不良结局有关,有望成为预后指标。
2.2.4 miR-18a:Mi X等[33]通过微阵列技术筛选BCC和健康志愿者组织中差异表达的miRs,发现miR-18a上调。体外实验表明,miR-18a的上调可促进细胞增殖,而抑制miR-18a则可导致细胞增殖停滞在G0/G1期,抑制细胞迁移并通过Akt/mTOR/LC3信号通路激活自噬。
2.3 与侵袭与转移相关的miRNAs
2.3.1 miR-148a:Mir-148a基因位点甲基化影响其转录,导致对TGIF2基因的抑制减弱。在体外实验,mir-148a下调促进皮肤肿瘤转移。生存分析表明其甲基化与患者预后相关,并可作为皮肤癌的潜在独立预后指标[34]。
2.3.2 miR-197-5p:Chang J等[20]通过高通量测序检测转移性BCC和非转移性BCC患者血清外泌体中的miRNAs表达,报道了9个显着上调的miRNA(见表1)。对miR-197-5p的功能研究表明,抑制miR-197-5p可以降低成纤维细胞的活力和迁移能力,但对其增殖和侵袭能力没有明显影响。miR-197-5p的过表达或抑制对角质形成细胞的生物学行为均无影响。
2.4 与代谢相关的miRNAs: 与代谢相关的miRNAs为miR-21,3型甲状腺激素(Thyroid hormone,TH)失活酶碘甲状腺素脱碘酶(D3)是一种癌胚蛋白,已被证明在肿瘤的增殖过程中异常激活。D3终止TH在肿瘤微环境中的作用,从而增强癌细胞的增殖。除了在转录水平上受到TH的负调控外,miR-21还通过介导肿瘤抑制基因GRHL3介导D3水平的升高而减弱TH信号,这对于角质形成细胞的分化至关重要。在BCC小鼠模型中,角质形成细胞特异性D3耗竭显著抑制了肿瘤的生长。总之,研究结果确定了一个miR21/GRHL3/D3轴,该轴可降低肿瘤微环境中的TH,并具有靶向治疗BCC的潜力[35]。
3 总结与展望
如何將miRNA的实验结果安全、快速、有效地应用于临床实践,并将其转化为基底细胞癌的筛选、诊断、治疗和预后判断的手段,也是一个需要解决的问题。随着对miRNA作用机制的深入研究,了解miRNA复杂的基因调控网络将为人类疾病的诊断和治疗提供新的窗口。与其他疾病相比,miRNAs在BCC中的研究还只是冰山一角。每个miRNA都有大量的靶基因,每个基因的mRNA可能受多个miRNA调控,这种复杂调控机制的研究还依赖于更全面的检测技术,更准确的筛选方法和更可靠的验证方法。如何将miRNA的实验结果安全、快速、有效地应用于临床,并将其转化为BCC的筛查、诊断、治疗和预后判断的手段也是一个亟待解决的问题。随着对miRNA作用机制的进一步研究,将利用最新的miRNA芯片等高通量技术来研究miRNA与疾病的关系,将使人们对高等真核生物基因表达调控的认识提高到一个新的水平。
[参考文献]
[1]Leiter U, Keim U, Garbe C. Epidemiology of skin cancer: update 2019[M]. Cham:Springer international publishing,2020:123-139.
[2]Li Y,Li Y,Li L.Circular RNA hsa_Circ_0005795 mediates cell proliferation of cutaneous basal cell carcinoma via sponging miR-1231[J]. Arch Dermatol Res,2021,(prepublish).
[3]Li L,Chang W, Hsiao M. Aberrant expression of microrna clusters in head And neck cancer development and progression: current and future translational impacts[J].Pharmaceuticals,2021,14(3):194.
[4]Nazarov PV,Kreis S.Integrative approaches for analysis of mRNA and microRNA high-throughput data[J].Comput Struct Biotec,2021,19: 1154-1162.
[5]Sand M,Skrygan M,Sand D,et al.Expression of microRNAs in basal cell carcinoma[J].Br J Dermatol,2012,167(4):847-855.
[6]Sand M,Bechara FG,Gambichler T,et al. Next-generation sequencing of the basal cell carcinoma miRNome and a description of novel microRNA candidates under neoadjuvant vismodegib therapy:an integrative molecular and surgical case study[J].Ann Oncol,2016,27(2):332-338.
[7]Sand M,Hessam S,Amur S,et al.Expression of oncogenic miR-17-92 and tumor suppressive miR-143-145 clusters in basal cell carcinoma and cutaneous squamous cell carcinoma[J].J Dermatol Sci,2017,86(2):142-148.
[8]Sand M,Bromba A,Sand D,et al.Dicer sequencing,whole genome methylation profiling, mrna and smallrna sequencing analysis in basal cell carcinoma[J].Cell Physiol Biochem,2019,53(5):760-773.
[9]Balci S,Ayaz L,Gorur A,et al. microRNA profiling for early detection of nonmelanoma skin cancer[J].Clin Exp Dermatol,2016,41(4):346-351.
[10]Kraemer A,Chen I,Henning S,et al.UVA and UVB irradiation differentially regulate microRNA expression in human primary keratinocytes[J].PLOs One,2013,8(12):e83392.
[11]Hildebrand J,Rutze M,Walz N,et al.A comprehensive analysis of microRNA expression during human keratinocyte differentiation in vitro and in vivo[J].J Invest Dermatol,2011,131(1):20-29.
[12]Zhang H,Hao Y,Yang J,et al.Genome-wide functional screening of miR-23b as a pleiotropic modulator suppressing cancer metastasis[J]. Nat Commun,2011,2:554.
[13]Srinivas N,Rachakonda S,Hielscher T,et al.Telomere length, arsenic exposure and risk of basal cell carcinoma of skin[J]. Carcinogenesis,2019, 40(6):715-723.
[14]Ren X,McHale CM,Skibola CF,et al.An emerging role for epigenetic dysregulation in arsenic toxicity and carcinogenesis[J].Environ Health Perspect,2011,119(1):11-19.
[15]Reichard JF, Puga A. Effects of arsenic exposure on DNA methylation and epigenetic gene regulation[J].Epigenomics,2010,2(1):87-104.
[16]Al-Eryani L,Waigel S,Jala V,et al. Cell cycle pathway dysregulation in human keratinocytes during chronic exposure to low arsenite[J]. Toxicol Appl Pharmacol,2017,331:130-134.
[17]Banerjee N, Bandyopadhyay AK, Dutta S, et al. Increased microRNA 21 expression contributes to arsenic induced skin lesions, skin cancers and respiratory distress in chronically exposed individuals[J].Toxicology, 2017,378:10-16.
[18]Al-Eryani L,Jenkins SF,States VA,et al. miRNA expression profiles of premalignant and malignant arsenic-induced skin lesions[J].PLoS One,2018,13(8): e202579.
[19]Heffelfinger C,Ouyang Z,Engberg A,et al.Correlation of global microrna expression with basal cell carcinoma subtype[J].G3 (Bethesda), 2012,2(2):279-286.
[20]Chang J,Tran DC,Zhu GA,et al.Initial in vitro functional characterization of serum exosomal microRNAs from patients with metastatic basal cell carcinoma[J].Br J Dermatol,2017,177(5): e187-e190.
[21]Xu N,Papagiannakopoulos T, Pan G, et al. MicroRNA-145 regulates OCT4, SOX2, and KLF4 and represses pluripotency in human embryonic stem cells[J]. Cell,2009,137(4):647-658.
[22] Chinnathambi S, Wiechert S, Tomanek-chalkley A, et al. Treatment with the cancer drugs decitabine and doxorubicin induces human skin keratinocytes to express OCT4 and the OCT4 regulator mir-145[J]. J Dermatol,2012,39(7):617-624.
[23]Lin SL,Chang DC,Chang-Lin S,et al. Mir-302 reprograms human skin cancer cells into a pluripotent ES-cell-like state[J].Rna,2008,14(10): 2115-2124.
[24]Sonkoly E,Lovén J,Xu N,et al.MicroRNA-203 functions as a tumor suppressor in basal cell carcinoma[J].Oncogenesis,2012,1(3):e3.
[25]Wei T,Xu N,Meisgen F,et al.Interleukin-8 is regulated by miR-203 at the posttranscriptional level in primary human keratinocytes[J].Eur J Dermatol,2013,23(3):66-71.
[26]Sun H,Jiang P.MicroRNA-451a acts as tumor suppressor in cutaneous basal cell carcinoma[J].Mol Genet Genom Med,2018,6(6):1001-1009.
[27]Gu Y,Wu F,Wang H,et al.Circular RNA circARPP21 acts as a sponge of miR-543 to suppress hepatocellular carcinoma by
regulating LIFR[J]. OncoTargets and Therapy,2021,14:879-890.
[28]Yu N,Yang Y,Li X,et al. MiR-26a inhibits proliferation and migration of HaCaT keratinocytes through regulating PTEN expression[J]. Gene,2016,594(1):117-124.
[29]Zhang T,Qian H,Hu C,et al.MiR-26a mediates ultraviolet b-induced apoptosis by targeting histone methyltransferase EZH2 depending on myc expression[J].Cell Physiol Biochem,2017,43(3):1188-1197.
[30]Liao X,Zheng L,He H,et al.STAT3 regulated ATR via microRNA-383 to control DNA damage to affect apoptosis in A431 cells[J].Cell Signal, 2015,27(11):2285-2295.
[31]Herbert KJ,Cook AL,Snow ET.SIRT1 inhibition restores apoptotic sensitivity in p53-mutated human keratinocytes[J].Toxicol Appl Pharm, 2014,277(3):288-297.
[32]Hu P,Ma L,Wu Z,et al.Expression of miR-34a in basal cell carcinoma patients and its relationship with prognosis[J].J BUON,2019,24(3):1283-1288.
[33]Mim X,Lai K,Yan L,et al. miR-18a expression in basal cell carcinoma and regulatory mechanism on autophagy through mTOR pathway[J].Clin Exp Dermatol,2020,45(8):1027-1034.
[34]Tian Y,Wei W,Li L,et al.Down-regulation of mir-148a promotes metastasis by dna methylation and is associated with prognosis of skin cancer by targeting tgif2[J].Med Sci Monitor,2015,21:3798-3805.
[35]Di Girolamo D,Ambrosio R,De Stefano MA,et al. Reciprocal interplay between thyroid hormone and microRNA-21 regulates hedgehog pathway–driven skin tumorigenesis[J].J Clin Invest,2016,126(6): 2308-2320.
[收稿日期]2021-02-05
本文引用格式:崔晨陽,肖志波.microRNA在人皮肤基底细胞癌中的研究进展[J].中国美容医学,2021,30(6):177-181.
