超声波辅助冷冻与低温速冻对海鲈鱼冰晶形态及冻藏期间鱼肉肌原纤维蛋白结构的影响
2021-11-22李秀霞刘孝芳刘宏影励建荣
李秀霞,刘孝芳,刘宏影,励建荣*,谢 晶,沈 琳
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州1 21013 2 上海海洋大学食品学院 上海201306 3 大连东霖食品股份有限公司 辽宁大连 116100)
海鲈鱼(Lateolabrax japonicus),隶属硬骨鱼纲,鲈形目,鲈科,主要分布于我国渤海、黄海等沿海地区。海鲈鱼肉嫩味鲜,不仅富含蛋白质,还含有矿物质、维生素、必需氨基酸等多种营养物质,营养价值高[1-3]。据《2019 中国渔业统计年鉴》数据统计[4],2018年海水养殖鱼类中鲈鱼产量为16.66万t,位居海水鱼产量第一位。由于营养丰富,含水量和酶活性高,因此鱼类容易变质。为了延长鱼类的保质期,有很多方法应用于食品的储存和运输,其中冷冻和冻藏保鲜在保持极易腐败水产品的质量上是最有效和应用最广泛的方法[5]。如今国内外对水产品冻藏保鲜的研究主要以感官品质、汁液流失、质构、菌落总数、TVB-N 值、TBA 值、pH 值等指标来探索冻藏期间下水产品品质的改变[6]。冷冻食品的质量在很大程度上受冰晶大小及其在肉中的位置影响[7],表现在食品理化性质、蛋白质特性、微观结构以及水分分布等的变化,冷冻速度对冰晶大小和均匀度也有很大影响。
目前,鼓风冻结技术是我国使用的主要食品速冻技术。其原理是以空气作为冷冻介质,高速低温循环气流,让低温气流与食品之间进行快速强制对流交换热量,将食品中热量带走,提升对流换热系数,从而提高冷冻速度,缩短了冻结时间,最终使食品快速冷却。鼓风冻结所使用的空气资源丰富,没有任何毒副作用,然而,空气的导热性能差,冻结时间比较长。程伟伟等[8]研究经鼓风冷冻和浸渍冷冻处理的调理猪肉贮藏期间的品质变化,发现采用浸渍于-18 ℃的冷冻液的冻结方式能够更好、更长时间贮藏调理猪肉。超声波辅助冻结技术是在食品冻结过程中利用超声波加速冰晶形成的一种新型冻结技术,具有对细胞损伤小,冻结速度快的优点。超声波作用过程中产生热效应、机械效应、空化效应,这3 个因素对缩短冻结时间有重要影响,其中空化效应为主要因素。Cheng 等[9]研究发现,特定的超声功率水平能明显缩短冷冻时间,这可能是由于超声辅助冷冻产生许多空化气泡,一旦气泡达到临界原子核的尺寸,它们就可用作晶核。Hu 等[10]研究发现,空化气泡的运动会产生微流,这会增强热量的传递并引起冰的成核作用。此外,Zhang 等[11]研究发现,超声波在液体介质中移动并引起强烈的湍流,从而引起冰核化并提高传热效率[12]。采用超声波辅助冻结不仅可以达到良好的冻结效果,而且超声波技术本身对肉品的品质具有多方面的改良作用[13]。
本试验中以海鲈鱼为原料,分析不同冷冻方式对海鲈鱼冻结速率和冻结曲线的影响,并系统研究不同冷冻方式处理后冻藏期间鱼肉溶解度、总巯基含量及DSC 的变化。观察冰晶形态和肌原纤维蛋白结构,预测海鲈鱼鱼肉品质变化,为超声波技术在冷冻水产品工业的应用提供技术依据。
1 材料与方法
1.1 材料与设备
海鲈鱼,平均体长(35±5)cm,体重(1±0.1)kg,辽宁锦州水产批发市场。30 min 内保持鲜活运至实验室。尿素、十二烷基磺酸钠(SDS)、盐酸、Tris、氯化钠、5,5'-二硫代双 (2-硝基苯甲酸)(DTNB)、乙二胺四乙酸(EDTA)、磷酸二氢钠、磷酸氢二钠、无水硫酸铜、四水合酒石酸钾钠、氢氧化钠、牛血清蛋白(BSA)等均为分析纯级,国药集团化学试剂有限公司。
低温速冻试验箱(ZT-CYH-80S 型),东莞市正台测试仪器有限公司;超声波辅助速冻冰柜(XO-120L-II 型),南京先欧仪器制造有限公司;冰冻切片机(CM-1850 型),德国莱卡公司;场发射扫描电子显微镜(S-4800 型),日本日立公司;正置显微镜(Nikon80i 型),日本尼康公司;差示量热扫描仪(Netzsch 204 F1 型),德国耐驰公司。
1.2 样品处理
取鲜活海鲈鱼冰浴下敲击头部致死,流水洗净,沥干水分,然后去皮、剖片装入聚乙烯自封袋中。将其随机分为4 组,分别采用-20,-40 ℃超声波辅助冷冻(320 W)及-20,-40 ℃低温速冻处理,待鱼肉中心温度达-18 ℃时停止冻结,取出,迅速转移至(-18±2)℃环境中贮藏,待用。
1.3 主要指标测定方法
1.3.1 冻结速率和冻结曲线的测定 在每组样品中随机抽选3 个样品,将温度记录仪传感探头插入海鲈鱼鱼片的中心位置,以1 min 为间隔记录1次温度,以海鲈鱼鱼片放入超声波辅助速冻冰柜和低温速冻试验箱中为起始冻结时间点,待样品中心温度达到-18 ℃时冻结完成。记录海鲈鱼鱼片中心温度随冻结时间的变化情况。以温度为纵坐标,冻结时间为横坐标绘制不同冻结方式冻结海鲈鱼片的温度变化曲线图。
国际制冷协会提出的冻结速率(V)计算方法:
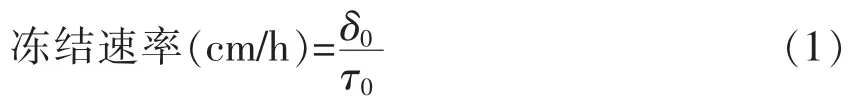
式中,δ0——食品表面与中心温度点间的最短距离(cm);τ0——食品表面达到0 ℃时食品中心温度降到比初始冻结点低10 ℃所需时间(h)。
1.3.2 冰晶形态观察 冷冻切片制备参照宋敏[14]的方法。微观图片参考向迎春等[15]的方法,于100倍显微镜观察获得。应用图像分析软件Image pro plus 6.0 分析横截面面积A、当量直径D、圆度R 和拉伸度。
1.3.3 蛋白质提取与分析
1.3.3.1 肌原纤维蛋白的提取 参照Cao 等[16]方法提取肌原纤维蛋白。
1.3.3.2 蛋白含量的测定 选择牛血清蛋白为标准品制作标准曲线,使用双缩脲法测定蛋白含量。移取1 mL 肌原纤维蛋白溶液加入4 mL 双缩脲试剂,混匀,置室温避光反应20 min,在波长540 nm处测定吸光度,根据标准曲线计算蛋白质含量。每个试验组重复3 次,数据取平均值。
1.3.3.3 溶解度的测定 把所得肌原纤维蛋白溶液稀释到质量浓度5 mg/mL,取5 mL 稀释液,4℃,10 000 r/min 离心10 min,取1 mL 上清液,加入4 mL 双缩脲试剂混合,均匀,室温避光放置30 min,在波长540 nm 处测定吸光度,重复3 次。1 mL 去离子水和4 mL 双缩脲试剂的混匀液为空白对照。溶解度计算公式:

1.3.3.4 总巯基的测定 使用DTNB 法测定蛋白质的总巯基含量[17]。4 组样品的MFP 用PBS (20 mmol/L,pH 6.7,含0.6 mol/L NaCI)稀释至质量浓度为4 mg/mL。分别取1 mL 4 mg/mL MFP 溶于9 mL 缓冲液【3 mmol/L EDTA,1%SDS,8 mol/L 尿素和0.2 mol/L Tris-HCl (pH 8.0)】中,充分混匀后取4 mL 置0.5 mL 缓冲液 【10 mmol/L DTNB,0.2 mol/L Tris-HCl (pH 8.0)】中,将反应后的混合液40 ℃保温25 min,在波长412 nm 处测定吸光度。样品中肌原纤维蛋白总巯基含量采用公式(3)计算:
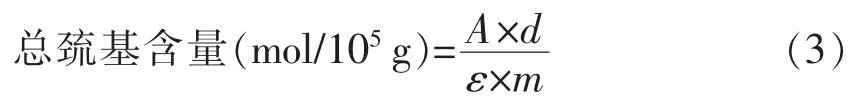
式中,A——吸光度;D——稀释倍数;ε——分子吸光系数,13 600 L/(mol·cm);m——肌原纤维蛋白质量(g)。
1.3.3.5 DSC 扫描分析 应用差式扫描量热仪(DSC)检测。称取5~8 mg 解冻后的海鲈鱼样品,将其密封在标准DSC 铝盘中,把空盘当作对照。在样品炉中的热电偶上按对应的位置放入样品盘和对照盘,以5 ℃/min 的加热速率将温度从20 ℃加热到90 ℃,记录并计算吸热曲线上蛋白变性的起始温度、峰值温度和终止温度。
1.4 统计分析
2 结果与分析
2.1 不同冷冻方式的海鲈鱼冰晶形态变化
2.1.1 冻结曲线和冻结速率的变化 图1反映4种冻结方式处理的海鲈鱼鱼片中心温度随冻结时间由8 ℃到-18 ℃的温度变化曲线。将不同冷冻方式处理的海鲈鱼冷冻曲线标记为3 个阶段:预冷阶段(4~-1 ℃)、相变阶段(-1~-5 ℃)、冻结降温阶段(-5~-18 ℃)。可以看出,不同冻结方式处理的样品冻结曲线存在明显的差异,其中-20 ℃低温速冻的冻结曲线呈下降、平缓、下降,趋于平缓的趋势,通过最大冰晶生成带的时间和冻结时间最长。而-20 ℃超声辅助冷冻、-40 ℃低温速冻和-40 ℃超声辅助冷冻的速率相对较快,冻结曲线呈下降、平缓、下降的走势。其中-40 ℃超声辅助冷冻通过最大冰晶生成带的时间和冻结时间明显短于其它3 个冻结组,说明-40 ℃超声辅助冷冻冻结速率最快,可大大缩短冻结时间。超声辅助冷冻相比于低温速冻具有更快的冻结速率。这是因为超声波的空化效应和机械效应加速介质的流动,提升传热传质的效率,缩短冻结时间,从而极大地提高了海鲈鱼鱼片的冻结速率。

图1 不同冻结方式冷冻的海鲈鱼鱼片中心温度的变化Fig.1 Changes in center temperature in Lateolabrax japonicus fillets with different freezing methods
冻结速率指食品物料内某点温度下降的速率[18]。表1反映4 种冻结方式处理的海鲈鱼鱼片冻结速率。4 个处理组冻结速率排序为:-40 ℃超声辅助冷冻>-20 ℃超声辅助冷冻>-40 ℃低温速冻>-20 ℃低温速冻,各组间差异显著(P<0.05)。对比图1可以看出,当样品冻结速率越大时,通过最大冰晶生成带的时间越短。-20 ℃低温速冻属于慢速冻结(冻结速率<1 cm/h,通过最大冰晶生成带的时间大于30 min);-40 ℃超声辅助冷冻、-20℃超声辅助冷冻及-40 ℃低温速冻属于快速冻结(通过最大冰晶生成带的时间少于30 min)[19]。

表1 不同冻结方式冷冻的海鲈鱼鱼片的冻结速率(n=3)Table 1 Freezing rates under different freezing methods of Lateolabrax japonicus fillets (n=3)
2.1.2 冰晶图像观测 图2为不同冻结方式处理的海鲈鱼鱼片中冰结晶的显微镜图片。可以看出,4 种冻结方式处理的海鲈鱼鱼片冰晶大小和形状都存在明显的差异。-40 ℃超声辅助冷冻海鲈鱼鱼片冰晶最小,均匀分布且规则,肌纤维相对较完整且细胞间隙最小;-20 ℃超声辅助冷冻的海鲈鱼鱼片冰晶较小,分布相对均匀;-40 ℃低温速冻的海鲈鱼鱼片肌纤维较为完整,形状规则,而冰晶较大;-20 ℃低温速冻方式处理的海鲈鱼鱼片生成许多大且不规则的胞外冰晶,对肌肉组织造成损伤,这样会影响长期冷冻贮藏的鱼的品质。在超声辅助冷冻样品中观察到比低温速冻样品更小且均匀冰晶,这可用超声波产生的空化效应来解释,空化效应可用作诱导冰晶成核,空化气泡破裂将预先存在的冰晶破碎成较小的尺寸,再次充当初级核。此外,空化气泡运动产生的微流增强了热量和质量的传递。所有这些都可能加快了冻结速率,并促进了小而均匀的冰晶形成[20]。

图2 新鲜和冷冻海鲈鱼鱼片组织的显微图片(放大100x)Fig.2 Micrographs of unfrozen and frozen Lateolabrax japonicus fillets tissues (magnification is 100x)
2.1.3 冰晶形态分析 如表2所示,-20 ℃低温速冻处理组的冰结晶的直径和横截面积最大,冰晶不规则连接在一起。-20 ℃低温速冻属于慢速冻结,在慢速冻结过程中冰晶的数量增加较慢,使很少活跃的晶核形成大的胞外冰晶。这会导致细胞膜受到破坏以及细胞组织超微结构紊乱,提高了冻藏和解冻后氧化速率及酶的活性[15],使食品结构发生不可逆转的损害。对于-20 ℃超声辅助冷冻和-40 ℃低温速冻的样品,产生的胞内冰晶和胞外冰晶相对-20 ℃低温速冻处理组更小,其直径和截面积也比-20 ℃低温速冻处理组小。这是因为冷冻速率提高,成核速率提高,生成更多的细小冰晶;同时也存在较大的胞外冰晶,使肌肉组织出现明显间隙,也会破坏食品结构。而-40 ℃超声辅助冷冻产生大量的胞内冰晶,细小且分布均匀,组织之间空隙更小,其冰晶直径和横截面积最小,同时它的圆度和拉伸度皆最小,说明-40 ℃超声辅助冷冻产生的冰晶是最圆、最规则的。在冻结过程中超声波可以降低初次成核的过冷度,促进二次成核和抑制冰晶的生长[21],更快的冻结速率使细胞内剩余的水分在扩散出细胞前就冻结成冰,以及初期开始时冰晶的数量增加较快,成核的频率提高,活跃的成核位点增加,使细小冰晶增多[22]。

表2 海鲈鱼鱼片冰晶的显微分析Table 2 Microscopic analysis of the ice crystals in different frozen Lateolabrax japonicus fillets
2.2 不同处理方式的海鲈鱼蛋白质理化性质和结构的变化
2.2.1 冻藏过程中海鲈鱼蛋白质溶解度的变化蛋白质溶解度是蛋白质变性及肌肉品质改变的一项重要指标。由图3可看出,每个处理组的溶解度随贮藏时间的延长而下降。其中,-20 ℃低温速冻处理组样品的溶解度最低,可能是由于蛋白质的空间结构在冷冻和解冻过程中发生改变,使分子内部的疏水基团结构松散而大量暴露,蛋白质与水分子间的作用力减轻,最终降低了蛋白质的溶解度。除此之外,肌原纤维蛋白可与脂肪的氧化产物如丙二酸等相互作用使蛋白质变性,形成复合物,降低蛋白溶解性[23]。-20 ℃超声辅助冷冻处理也表现出较低的溶解度,可能是因为超声辅助冷冻过程中受超声波较长时间的机械和空化效应的作用,蛋白质变性,溶解性降低[24]。与其它3 组相比,-40 ℃超声辅助冷冻的样品溶解度最高,可能是因减少了由冰晶引起的蛋白质变性和肌肉细胞器、细胞膜的机械损伤,有效降低了海鲈鱼肌原纤维蛋白的氧化程度。

图3 冻藏期间海鲈鱼肌原纤维蛋白溶解度的变化Fig.3 Changes of the solubility of myofibrillar protein during frozen storage
2.2.2 冻藏过程中海鲈鱼总巯基的变化 大量研究发现,总巯基含量的变化能够反映蛋白质变性的程度,这是因为冻藏过程中蛋白质的部分巯基易被氧化形成二硫键,不仅使总巯基含量下降,而且改变了蛋白质的空间结构[25]。由图4可知,海鲈鱼肌原纤维蛋白样品的总巯基随冻藏时间的延长含量明显降低,且呈先快后慢的下降趋势。同时,相对于其它3 组样品-40 ℃超声辅助冷冻的样品总巯基含量一直保持最高,说明-40 ℃超声辅助冷冻可以减少蛋白质在冷冻过程中的氧化程度。海鲈鱼的总巯基含量在前4 周有较快的下降速率。这种现象是由于肌原纤维蛋白中的一些暴露在蛋白质表面的巯基,在冻藏初期蛋白质结构没有发生显著变化时就被氧化成二硫键[26]。在冻藏过程中检测到的巯基数量减少也可能因蛋白质的聚集[27]。

图4 冻藏期间海鲈鱼肌原纤维蛋白总巯基含量的变化Fig.4 Changes of total sulfhydryl content of myofibrillar protein during frozen storage
2.2.3 不同处理方式冷冻鱼样品的DSC 扫描分析 冷冻鱼样品的DSC 结果如图5和表3所示。在温度45.25~54.45 ℃(Tmax1)、56.93~59.73 ℃(Tmax2)和68.24~76.07 ℃(Tmax3)范围有3 个特征峰,分别代表肌球蛋白头部引起的热流变化,肌球蛋白尾部和肌浆蛋白引起的热流变化以及肌动蛋白引起的热流峰。鱼肉的最高转变温度(Tmax)随冷冻储存时间的延长而降到更低的温度。新鲜的鱼肉样品Tmax1在0 d 时为54.76 ℃,Tmax2为59.62 ℃,Tmax3为76.53 ℃。第12 周时4 组处理组样品的Tmax1、Tmax2及Tmax3均下降。-40 ℃超声辅助冷冻样品的Tmax1、Tmax2及Tmax3显著高于其它3 组样品,而-20 ℃低温速冻样品在冷冻储存中具有最低的Tmax1和Tmax3(P<0.05)。这说明从Tmax开始,整个冷冻存储期间,-40 ℃超声辅助冷冻样品具有比其它3 组样品更高的热稳定性。蛋白质变性包括分子内键(主要的非共价键和少数共价键)的解离,这是一个吸热过程,会产生吸热峰。转变温度显著下降表明,冻藏过程中,肌肉蛋白的热稳定性降低了,这可能是肌动蛋白变性和肌球蛋白中的亚基解离所致[28]。同样,冻藏过程中,肌球蛋白的变性焓值△H及肌动蛋白变性也显著降低(P<0.05)。-40 ℃超声辅助冷冻样品的△H1和△H3均高于另3 组样品,而-20 ℃低温速冻样品的△H1和△H3均显著低于其它3 组(P<0.05)。这说明-40℃超声辅助冷冻样品的变性程度较低,而-20 ℃低温速冻样品的变性程度最高。通常,△H的减少可能与蛋白质变性引起的蛋白质聚集增加和氢键减弱有关。冷冻和冷冻储存过程中冰晶的形成和尺寸增加会导致蛋白质变性和细胞破裂。在冷冻储存过程中-40 ℃超声辅助冷冻产生小而均匀的冰晶,破坏蛋白质结构,蛋白质变性程度下降。
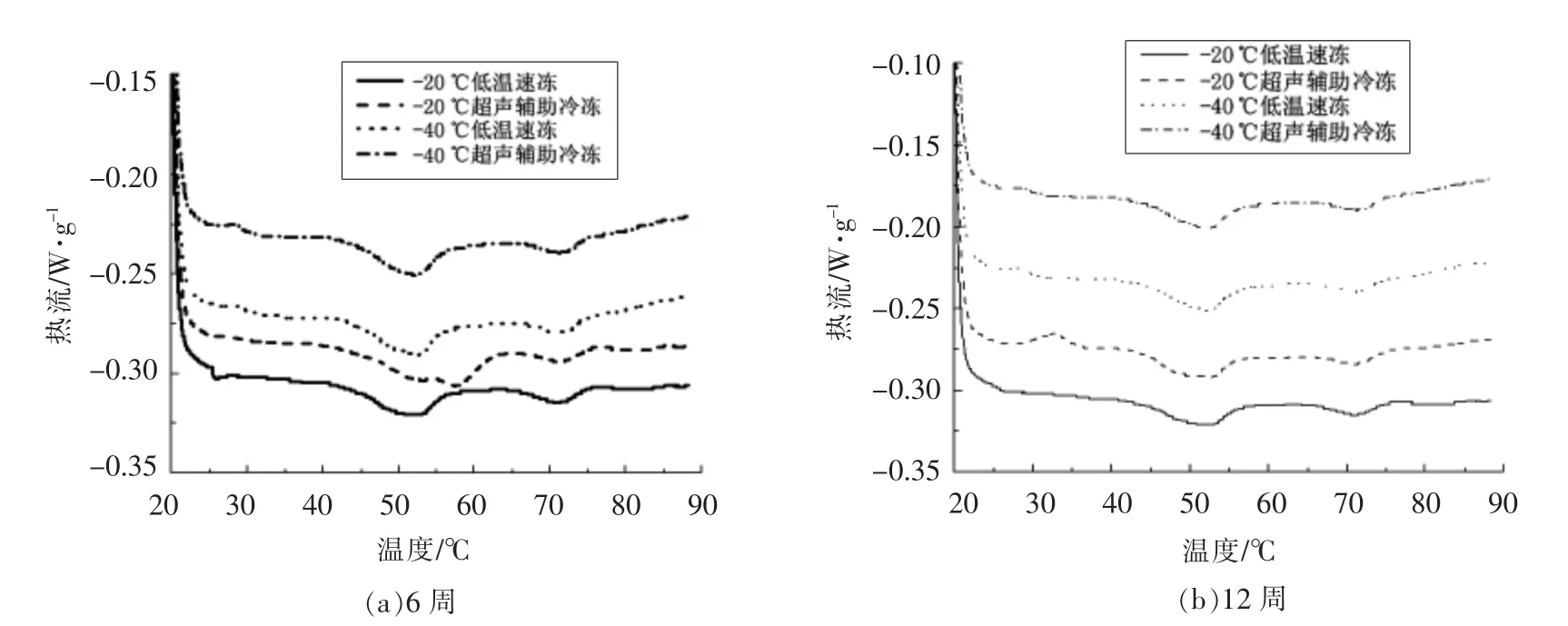
图5 冻藏期间海鲈鱼鱼肉DSC 扫描曲线的变化Fig.5 Changes of on DSC scanning curve of Lateolabrax japonicus muscle during frozen storage

表3 冻藏期间海鲈鱼肉相变温度(Tm)和热焓值的变化Table 3 Changes of enthalpy value and transition temperature (Tm) of Lateolabrax japonicus muscle during frozen storage
3 结论
以海鲈鱼为对象,研究了-20,-40 ℃超声波辅助冷冻与-20,-40 ℃低温速冻对海鲈鱼冰晶生成情况,鱼肉肌原纤维蛋白理化特性及结构的影响。结果表明,两个超声波辅助冷冻处理组有较高的冻结速率,通过冰晶最大生成带的速度更快,冻结时间相对较短;-40 ℃超声辅助冷冻与其它3 种冻结方式相比,冻结速率快,胞内冰晶更小、更规则。-40 ℃超声辅助冷冻的样品与其它3 组相比,溶解度、总巯基含量最高,能够有效降低肌原纤维蛋白的氧化程度。DSC 结果表示,-40 ℃超声辅助冷冻方法可提高鱼肉蛋白质的热稳定性,减少蛋白质在冷冻过程中的氧化程度,蛋白质变性和结构的破坏程度最低,对鱼肉品质保藏有较好的效果。
