分子对接结合荧光光谱法探究单宁酸与血清蛋白结合的pH依赖性
2021-11-22范金波周素珍吕长鑫励建荣
范金波,周素珍,闫 泳,吕长鑫,励建荣
(渤海大学食品科学与工程学院 辽宁省食品安全重点实验室生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013)
酚类化合物作为次生代谢物存在于大多数植物中,它们具有抗氧化、抗凋亡、抗衰老、抗癌、抗炎、心脏血管保护、内皮功能增强活性、抑制血管再生和细胞增殖活性等多种生化特性[1-2]。酚类化合物一般具有较差的稳定性,显著降低了其功效,因此其蛋白基载体的保护和递送成为研究的热点[3]。
人血清白蛋白(Human serum albumin,HSA)是血浆蛋白中常见的载体蛋白,在血浆中以结合形式携带药物。在许多条件下,结合会导致药物和蛋白质构象的变化[4]。HSA 由585 个氨基酸多肽链、3 个结构域组成,包含2 个常见的结合位点,分别位于亚结构域IIA 和IIIA[5]。牛血清白蛋白(Bovibe serum albumin,BSA) 是牛血清中的一种球蛋白,由583 个氨基酸残基组成,是HSA 的同源蛋白。BSA 有2 个色氨酸残基(Trp 134 和Trp 213),其中Trp 213 是位点Sudlow's site I 的主荧光残基,而Trp 134 位于分子表面,HSA 只有1 个色氨酸残基(Trp 214) 位于亚结构域IIA。BSA/HSA 能够结合多种内源性和外源性活性物质,并在其递送、分布和代谢中起重要作用。
单宁是一类酚类化合物,存在于各种各样的食物和饮料中[6]。单宁酸(Tannic acid,TA)属于一种水溶性单宁,常见的果蔬中都含有丰富的TA。TA 因富含羟基和羧基,可与许多分子,如蛋白质、多糖和生物碱形成复合物[7],故常被用作交联剂或稳定剂[8]。层层组装制备蛋白-TA 多层膜,能够使活性成分免于胃消化,而在肠道中正常消化吸收,从而提高活性成分功效[9]。有研究报道蛋白-TA 复合物可作为有效的抗氧化乳化剂[10-11]。Kaspchak等[6]研究了热处理和离子强度对于BSA 与TA 结合的影响以及结合作用对体外蛋白质消化率的影响,结果表明,高离子强度促进了两者的结合,同时降低了体外蛋白质消化率;热处理导致蛋白质变性,不利于两者结合,同时促进蛋白质的水解。
相互作用取决于多种因素,如单宁和蛋白质的结构、pH 值、离子强度、温度和溶液中蛋白质的浓度[12]。目前,很少有用荧光光谱结合分子模拟研究pH 值对TA 与BSA/HSA 分子相互作用的影响。本文以BSA/HSA 为模型蛋白,以TA 为配体分子,通过荧光光谱结合分子模拟技术研究pH 值对BSA/HSA-TA 相互作用的影响。
1 材料与方法
1.1 材料与试剂
牛血清白蛋白(99%)、人血清白蛋白(99%),北京百灵威科技有限公司;TA (98%)、布洛芬(Ibuprofen,IBUP 98% )、华法林(Warfarin,WARF 98%),生工生物工程(上海)有限公司;无水乙醇、磷酸氢二钠、柠檬酸等均为分析纯级;试验用水为超纯水。
1.2 仪器与设备
F-7000 荧光分光光度计,日本日立高新技术公司;FE20 实验室pH 计,梅特勒-托利多仪器(上海)有限公司;UV-2700 紫外-可见光分光光度计,日 本SHIMADZU 公司;Milli-Q Reference 型 超纯水机,德国默克密理博有限公司。
1.3 试验方法
1.3.1 储备液的配制 配制0.2 mol/L 磷酸缓冲液 (pH 7.4,5.0,4.0),并配制1.2×10-4mol/L 的BSA 储备液,以及浓度为3.6×10-4mol/L 的TA、WARF、IBUP 储备液。
1.3.2 TA 与血清白蛋白相互作用的荧光光谱测定 荧光发射光谱:取8 支离心管,移液枪准确移取1.2×10-4mol/L BSA 30 μL,再分别移取一定体积3.6×10-4mol/L TA,用不同pH 值缓冲溶液定容至3 mL,使得BSA 浓度为1.2 μmol/L、TA 浓度为0~4.2 μmol/L,充分反应30 min。设置激发波长为280 nm,激发和发射狭缝的宽度分别设定为2.5 nm 和5 nm,扫描速度为700 nm/min,测定290~450 nm 波长范围内的荧光发射光谱并记录。
同步荧光光谱:室温下,固定激发波长和发射波长之间的间隔分别为Δλ=60 nm 和Δλ=15 nm,分别测定样品的色氨酸残基在波长200~380 nm和酪氨酸残基在波长235~380 nm 的同步荧光光谱。
1.3.3 TA 与血清白蛋白的结合位点分析 参照1.3.2 节方法,加入TA 前,先加入WARF/IBUP 充分摇匀反应20 min,使其浓度为6.0 μmol/L,后续操作与1.3.2 节相同。
1.3.4 分子对接 采用AutoDock vina 4.0 软件研究单宁酸与血清蛋白分子对接。BSA(ID:4OR0)、HSA (ID:1HA2)来源于RCSB PDB 数据库,去除b 链和水,TA(PubChem CID:16129778)3D 结构来源于PubChem,通过默认设置与Gasteiger 电荷计算准备,BSA/HSA/TA 结构都加入了氢原子[13]。设置网格框 (BSA,x=82、y=45 和z=67,间距为1.0 Å) 和 (HSA,x=87、y=35 和z=77,间距为1.0 Å),以覆盖所有位点。BSA/HSA 选择刚性对接,而TA 选择柔性对接,使用LGA 遗传算法,参数都使用默认值。以最低能量确定最佳对接构象,由Discovery Studio v17.2.0 软件分析相互作用力,并由Pymol 软件呈现分子对接3D 图[13-14]。
1.4 统计分析
2 结果与分析
2.1 TA 对血清白蛋白荧光的影响
2.1.1 TA 对BSA 荧光的影响 图1所示,不同pH 值条件下,TA 对BSA 均产生荧光猝灭现象,随着TA 浓度(0~4.2 μmol/L)改变呈现规律性的变化,具有量效关系。当pH 7.4 时,BSA 的荧光强度峰值降低了95%;而在pH 5.0 和pH 4.0 时,BSA的荧光强度峰值分别降低了82%和77%。不同pH值条件下,最大发射波长(λmax)变化趋势不同,pH 7.4 时发生蓝移(338~332 nm),而pH 5.0(331~338 nm)和pH 4.0(331~337 nm)时发生红移,可能是由于pH 和TA 对于BSA 共同作用改变了荧光基团的微环境。由图1d 所示,随着TA 浓度的增大猝灭率逐渐增大,其中pH 7.4 时,显著高于pH 5.0 和pH 4.0(P<0.05),而pH 5.0 和pH 4.0 差异不显著(P>0.05)。这些结果表明,不同pH 值条件下TA 均与BSA 发生结合作用,从而产生了内源性荧光猝灭作用。
2.1.2 TA 对HSA 荧光的影响 由图2a、2b 可知,随着TA(0~4.2 μmol/L)的加入,HSA 荧光光谱均产生了规律的猝灭作用,峰形无显著变化,而图2c 峰形产生明显变化,在310 nm 波长处出现新峰且总体峰强显著降低。据文献[15]报道,该峰为“酪氨酸荧光肩”,是酪氨酸残基特征峰,由于280 nm激发波长下酪氨酸的荧光量子产率低于色氨酸,所以峰强显著降低,这些结果说明pH 4.0 时HSA荧光基团显著变化,酪氨酸残基贡献显著增加,与BSA 相比(图1c),pH 4.0 对于HSA 的影响更大。pH 值变化影响λmax,pH 7.4,5.0,4.0 时,λmax分别为335,337,324 nm,随着TA 浓度的增加λmax分别蓝移5 nm(335~330 nm)、红移4 nm(337~341 nm)和蓝移14 nm(324~310 nm),这些都说明TA与HSA 发生了结合反应,加之pH 值的影响改变了HSA 的结构。由图2d 可知,pH 7.4 时猝灭率最高,而pH 5.0 时最低,说明pH 值影响了TA 与HSA 的结合反应。Sekowski 等[16]研究了3 种单宁与HSA 的相互作用,荧光发射光谱表明随着单宁浓度的增加(0.0~10.0 μmol/L)均出现荧光猝灭现象。
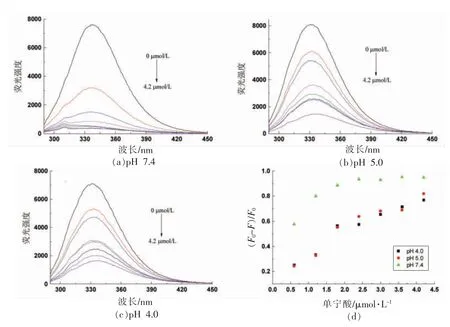
图1 pH 值对TA 与BSA 结合荧光光谱的影响Fig.1 Effect of TA on fluorescence spectra of BSA at different pH value
2.2 荧光猝灭机理
Stern-Volmer 方程(1)常用来分析小分子与蛋白的结合作用和荧光猝灭机理,一般荧光猝灭主要分为静态猝灭和动态猝灭[4,17]。

式中,F0——未加TA 时荧光强度;F——加入TA 时荧光强度;[Q]——TA 的浓度,mol/L;Kq——双分子猝灭速率常数,L/(mol·s);τ0——荧光分子平均寿命,其值为10-8s;Ksv——Stern-Volmer 猝灭常数,L/mol。
根据方程(1),可计算不同条件下TA 与血清白蛋白结合的Ksv和Kq,具体结果见1 和表2。由表1可知,生理条件下(pH 7.4),随着温度的升高,Ksv由4.770×106降至3.160×106,且Kq均大于2×1010(生物分子的最大散射碰撞猝灭常数),说明TA 对BSA 猝灭是通过静态猝灭作用,生成了TA-BSA 复合物[18]。同理,由表2可知,TA 对BSA猝灭作用也是通过静态猝灭实现的,最后生成了TA-HSA 复合物。相同温度条件下(298 K)pH 值变化影响了Ksv,在pH 7.4 时无论是BSA 还是HSAKsv最大,Ksv随着pH 值的降低而呈减小趋势,该结果验证了图1、图2的结果。

图2 pH 值对TA 与HSA 结合荧光光谱的影响Fig.2 Effect of TA on fluorescence spectra of HSA at different pH value
2.3 结合常数计算
蛋白荧光猝灭数据(存在和不存在猝灭剂)可以用来计算结合常数,由于本试验最大TA 浓度是BSA/HSA 浓度的3.5 倍,最适合应用方程(2)计算TA 与BSA/HSA 结合常数[15,19]。

式中,F——不同TA 浓度下测定的荧光强度;F0——未加TA 时荧光强度;Fc——完全络合蛋白的荧光;Kd=1/Ka解离常数;[P]t,[L]a——BSA/HSA 和TA 的分析浓度,mol/L。
基于方程(2)采用Origin 进行非线性拟合,不同条件下BSA/HSA 与TA 的结合常数见表1和表2。结果发现:不同条件下TA 与血清白蛋白的结合常数Ka都在105-107L/mol 数量级,说明结合能力很强,pH 值变化显著影响结合常数,生理条件下(pH 7.4)结合常数最大。研究发现3 种大戟单宁与HSA 结合常数(pH 7.4,298 K)在2.8×105~5.7×105L/mol 范围内,与本文结果一致[16]。Kaspchak 等[6]通过等温滴定量热法测得BSA 与TA 结合常数(pH 3.0,298 K)为2.9×104L/mol,与本文的差别可能是由于pH 值降低的影响,进一步说明了pH 值显著影响了BSA 与TA 的结合反应。

表1 TA 与BSA 相互作用荧光猝灭常数Table 1 Fluorescence quenching constants of BSA by TA

表2 TA 与HSA 相互作用荧光猝灭常数Table 2 Fluorescence quenching constants of HSA by TA
2.4 热力学性质和作用力类型
非共价蛋白-多酚复合物的形成主要通过氢键、范德华力、疏水相互作用和静电相互作用4 种作用力[20]。当温差较小时,ΔH可被认为不变,两温度下通过Van’t Hoff 方程(3)和(4)计算热力学参数[21]。

式中,K1,K2,Ka——T1(298 K),T2(310 K)和T时,TA 与血清白蛋白的结合常数;热力学参数ΔG,ΔH,ΔS——结合反应的吉布斯自由能、焓变和熵变。
由表3可知,ΔH<0 且ΔS<0 时,说明BSATA 复合物的形成是一个放热过程,焓驱动的过程,主要作用力为氢键[22],结论与文献[6]报道一致;而对于HSA ΔH<0 且ΔS>0 时,HSA-TA 复合物的形成也是一个放热过程,属于焓和熵共同驱动,主要作用力为氢键和疏水相互作用。BSA/HSA 吉布斯自由能降低(ΔG<0),表明复合物的形成均是自发进行的。

表3 TA 与血清白蛋白相互作用的热力学参数Table 3 Thermodynamic constants for the interaction of TA with serum albumin
2.5 同步荧光光谱测定
由于蛋白质中芳香氨基酸的固有荧光对微环境敏感[23],所以同步荧光光谱常用来评价活性小分子结合作用引起的蛋白质微环境的变化,本文通过同步荧光光谱测定TA 诱导的BSA/HSA 构象的变化。当△λ=15 nm 和△λ=60 nm 时,同步荧光光谱分别反映酪氨酸残基和色氨酸残基的微环境的变化[24]。TA 对BSA/HSA 同步荧光光谱的影响结果如图3所示。随着TA 浓度的增加,酪氨酸残基和色氨酸残基内源荧光强度均逐渐降低,在此过程中酪氨酸(BSA 3 nm/HSA 2 nm)和色氨酸(BSA 2 nm/HSA 1 nm)均出现了微弱的蓝移,说明酪氨酸的极性微减,疏水作用略有增强,说明蛋白质分子发生了一定变化,空间趋于折叠[25]。以上,可以推测酪氨酸残基和色氨酸残基的微环境发生了微弱的变化,说明TA 的结合改变了BSA/HSA 的构象。
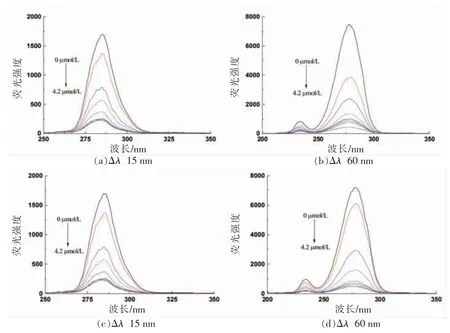
图3 TA 对BSA(a、b)和HSA(c、d)的同步荧光光谱的影响Fig.3 Effect of tannic acid on synchronous fluorescence spectra of BSA /HSA
2.6 TA 与血清白蛋白结合位点分析
为确定TA 在血清白蛋白的实际结合位点,进行竞争性结合试验。通过利用华法林与血清白蛋白的亚结构域ⅡA(Sudlow's site I)及布洛芬与血清白蛋白的亚结构域ⅢA(Sudlow's site II)的特异性结合,比较猝灭率的变化来判断TA 与血清白蛋白结合位点的位置。
2.6.1 TA 与BSA 结合位点分析 如图4a 和图4b 所示,在pH 7.4 条件下,IBUP 的存在没有显著影响TA 对BSA 的荧光猝灭作用,说明TA 与BSA 结合位点与IBUP 不同,不在亚结构域ⅢA 附近;而华法林的存在显著降低了TA 与BSA 的结合,说明TA 与BSA 的结合位点与WARF 相似,在亚结构域ⅡA 附近,即Sudlow's site I 附近。
由如图4c 和图4d 可知,在pH 5.0 条件下,IBUP 和WARF 的存在没有显著影响TA 与BSA的结合,说明TA 与BSA 的结合位点既不在亚结构域ⅢA 附近,也不在亚结构域ⅡA 附近。因此,pH 值影响了TA 与BSA 的结合,不同pH 值的结合位点也不同。
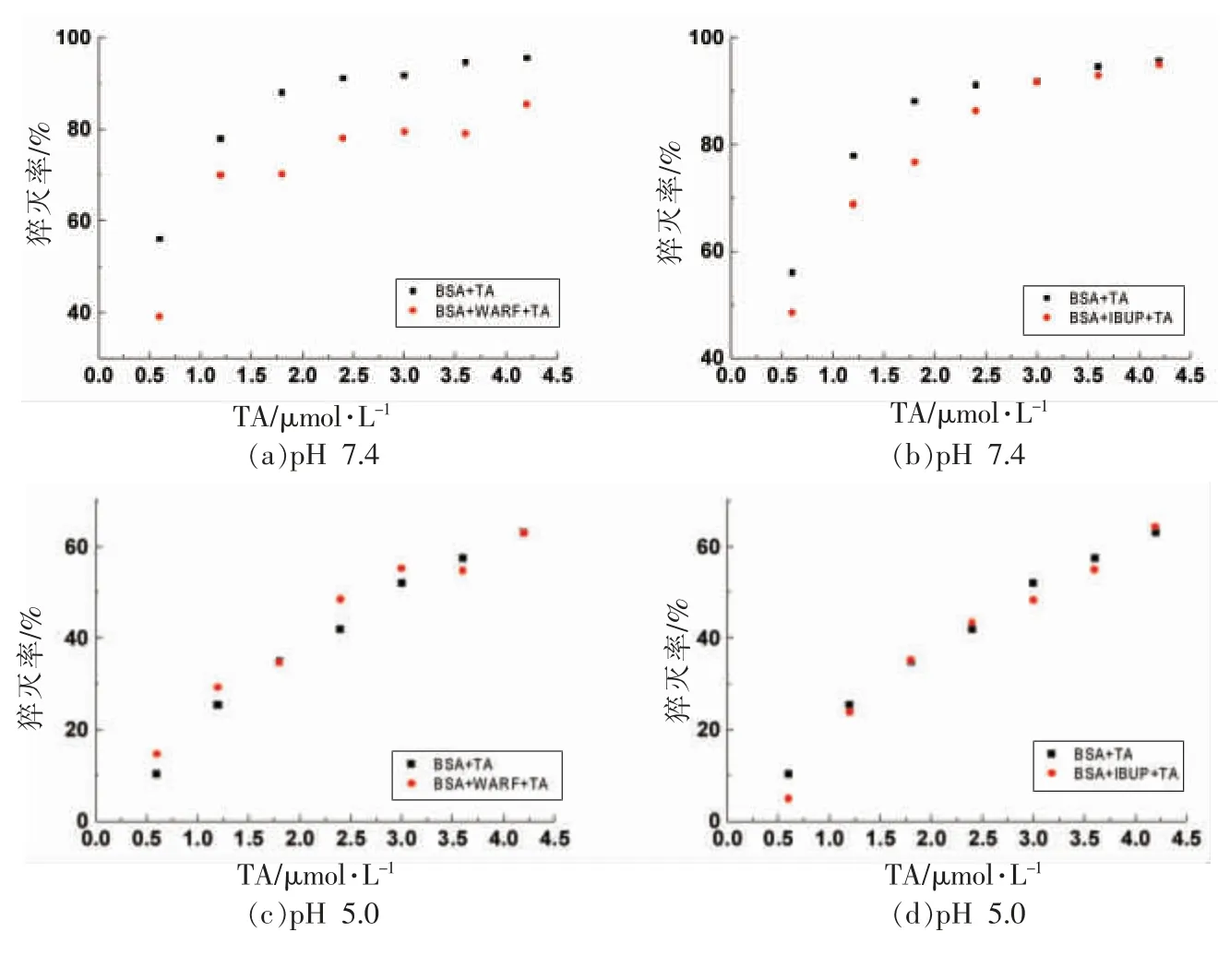
由如图4e 和图4f 可知,在pH 4.0 条件下,IBUP 和WARF 的存在显著降低了TA 与BSA 的结合,说明TA 与BSA 的结合位点位于亚结构域ⅢA 和亚结构域ⅡA 之间。2.6.2 TA 与HSA 结合位点分析 如图5a 和图5b 所示,在pH 7.4 条件下,IBUP 的存在显著增加TA 对HSA 的荧光猝灭作用,说明TA 与HSA 结合位点与IBUP 不同;而华法林的存在显著降低了TA 与HSA 的结合,说明TA 与HSA 的结合位点与WARF 相似,在亚结构域ⅡA 附近。Sekowski等[16]研究证实3 种单宁以不同结合力均结合到HSA疏水腔Sudlow's site I 上,与本文结论相同。

图4 WARF 和IBUP 对TA 与BSA 结合的影响Fig.4 Influence of WARF and IBUP on the binding between TA and BSA
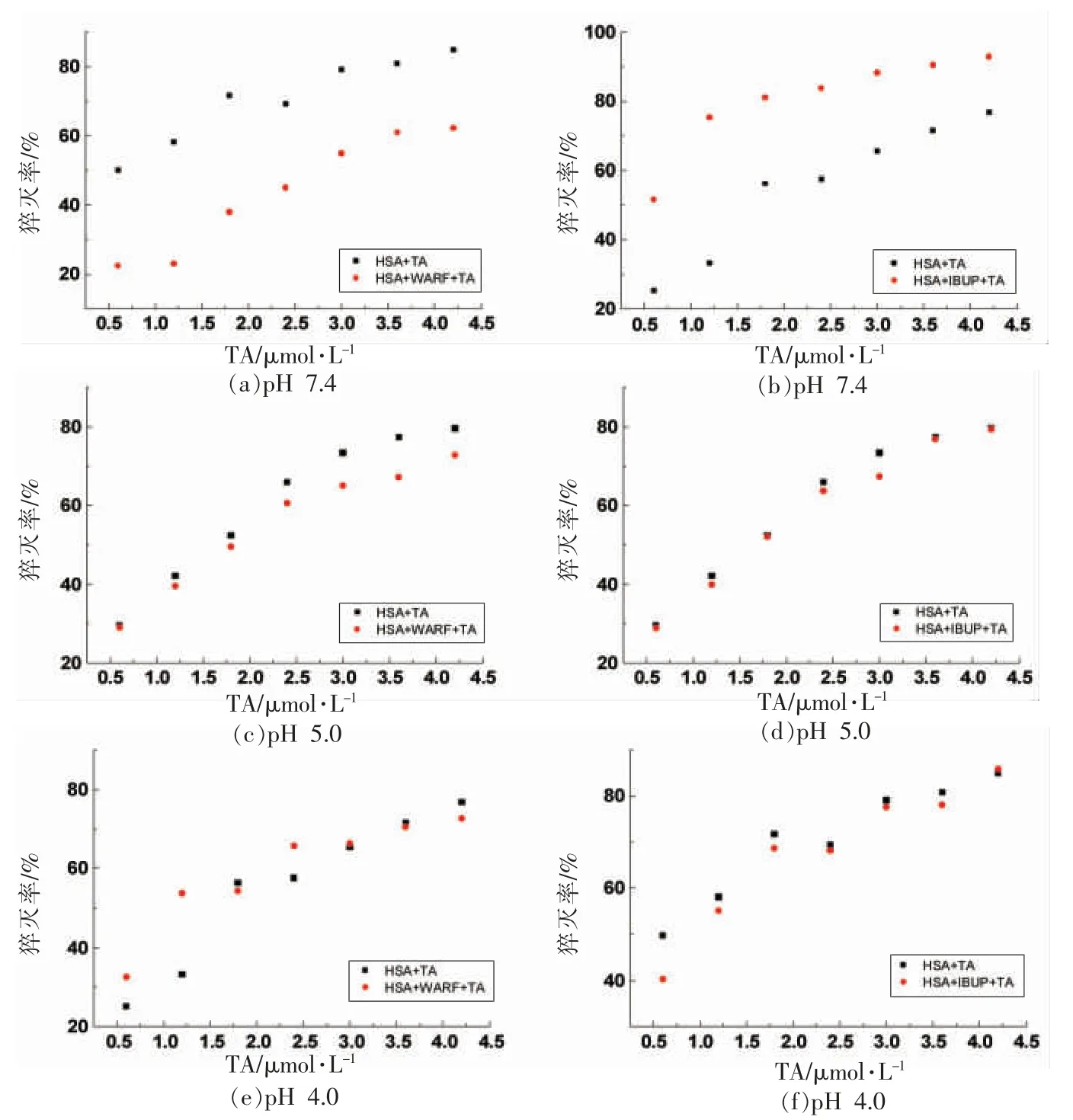
图5 WARF 和IBUP 对TA 与HSA 结合的影响Fig.5 Influence of WARF and IBUP on the binding interaction between TA and HSA
由如图5c~5f 可知,在pH 5.0 和pH 4.0 条件下,IBUP 和WARF 存在没有显著影响TA 与HSA 的结合,说明TA 与HSA 的结合位点既不在亚结构域ⅢA 附近,也不在亚结构域ⅡA 附近。因此,pH 值影响TA 与HSA 的结合,其结合位点随着pH 值发生变化,可能与不同pH 值下蛋白溶解度、伸展程度有关。
2.7 分子对接
分子对接是研究小分子在蛋白质上最佳结合位点的有效且准确的方法[26]。本文通过Autodock vina 软件研究TA 与BSA/HSA 的分子对接,最佳构象ΔG分别为-40.61 kJ·mol-1和-45.64 kJ·mol-1,与荧光结果一致。由图6可知,无论是BSA 还是HSA 都结合到亚结构域ⅡA 与亚结构域ⅢA 之间,其它构象同样结合到该位置附近,可能与TA的空间构象大(约5 000 Å3)有关,其它位点不能容纳TA。由图6A 可知,TA 与BSA 结合位点位于Sudlow's siteⅠ外侧,主要通过TYR451、ARG256和ARG435 等残基形成氢键 (表4),这与位点Marker 试验结果一致,同时与ALA290、LYS187、ARG435 和LEU237 残基形成疏水键,与LYS221、GLU443 残基形成离子键,这些化学键对于TABSA 复合物的形成提供了有力支撑。同样,由图6B 和表4可知,TA 与HSA 结合位点位于Sudlow's site Ⅰ,主要作用力为疏水相互作用(ALA191、ALA291 等),同时氢键(ARG222、LYS436、LYS195 等) 和离子相互作用(ARG218、LYS436)也有利于结合反应,这些与位点Marker试验和热力学参数分析结果一致。

表4 TA-BSA/HSA 结合能,K,结合位点氨基酸残基及作用力结合自由能Table 4 Binding free energy,K,amino acid residues in binding site and interaction forces of TA-BSA/HSA

图6 TA 与BSA(A)和HSA(B)的预测结合位点、位点氨基酸残基和作用力Fig.6 Predicted binding sites,the binding sites amino acids and interaction forces of between BSA (A) and HSA (B) with TA
3 结论
论文采用荧光光谱法研究了TA 与BSA/HSA在pH 7.4/pH 5.0/pH 4.0 条件下的结合作用,通过Stern-volumer 方程、非线性方程和Van't Hoff方程解析猝灭常数、结合常数和作用力类型,通过同步荧光考察TA 对BSA/HSA 构象的影响,最后位点Marker 实验结合分子对接确定结合位点、关键氨基酸和作用力。结果表明,3 种pH 值条件下,TA 对BSA/HSA 均产生了荧光猝灭现象,Ksv呈pH依赖性,pH 7.4 时猝灭作用最强,说明生理pH 条件下TA 与BSA/HSA 更容易结合,结合常数Ka结果与Ksv结果相似,同样受pH 值的影响;热力学参数结合分子对接表明TA 与BSA/HSA 主要依赖氢键和疏水相互作用结合,反应自发进行;位点Marker 试验与分子对接试验证实,pH 7.4 条件下TA 与BSA/HSA 的结合位点均位于Sudlow's site I 附近,而且pH 值影响TA 与BSA/HSA 的结合位点。结果表明,TA 与BSA/HSA 的结合存在pH 值依赖性,这对于设计开发蛋白基-TA 载体提供了理论参考且具有重要意义。
