乳铁蛋白-EGCG-多糖乳液的构建及其递送姜黄素的功能特性
2021-11-22马翠翠孟焕娜李雪琪刘夫国
马翠翠,庞 潇,孟焕娜,李雪琪,刘夫国
(西北农林科技大学食品科学与工程学院 陕西杨凌 712100)
姜黄素是一种食品着色剂,也是食品中安全、天然的抗菌剂和抗氧化剂,可以替代许多化学合成的工业产物。然而,姜黄素的一些特性限制了其在食品中的应用。首先,姜黄素的疏水性导致其在食品系统中显示出低水溶性和不充分的分散性。其次,姜黄素的稳定性差,在贮存和食品加工过程中遇到较为恶劣的环境时,姜黄素分解,进而降低其营养价值和生物活性。此外,由于姜黄素本身的苦味,若在食品中直接使用就会导致对感官属性产生负面影响,甚至与食品成分发生不愉快的相互作用[1]。目前有效的解决方法之一是构建食品递送系统。常见的递送系统包括乳液、纳米颗粒、脂质体等。而乳液作为包裹脂溶性姜黄素的一种优良载体,在不显著改变食品质量和感官特性的情况下,可为活性物质提供良好的稳定性和缓释性。通过增强其在水介质中的溶解性,提高其功能性和生物活性[2]。
大量研究表明多层乳液和纳米乳液在递送活性成分方面具有很强的优势。多层乳液是一种具有独特的封装和释放特性的新型递送系统。一般而言,多层聚合物的添加能提高乳液在各种工艺条件(不同pH 值、离子强度和温度)下的稳定性,改善封装成分的化学稳定性,并提高对封装成分释放速率的控制水平[3-4]。Li 等[5]通过界面静电沉积方法,在脂质液滴周围形成多层生物聚合物涂层,来控制包埋在乳液中的亲脂性活性物质的消化和释放。这些涂层由球状蛋白(β-乳球蛋白)构成内层,阳离子多糖(壳聚糖)构成中间层,阴离子多糖(果胶或藻酸盐)构成外层。研究发现在存在外层的情况下,液滴在pH 4~7 范围内具有良好的聚集稳定性。Taherian 等[4]评估了双层鱼油乳液的理化稳定性,结果表明,双层包埋可以提高空间位阻效应,进而提高乳液的稳定性,有利于将鱼油添加到食品和饮料中。纳米乳液是粒径小于200 nm 的热力学稳定、各向同性的乳液。研究表明,由乳清分离蛋白制备的纳米乳液,在各种离子强度、热处理和贮存条件下,均具有良好的稳定性[5]。当使用较高的蛋白质浓度作为乳化剂来稳定纳米乳液时,可能不需要使用多糖作为制备纳米乳液的第2层。以纳米乳液为基础的包埋技术,是一种很有前景的包埋天然活性成分的技术,具有以下优点:(1)改善活性成分的物理化学稳定性;(2)防止其在食品加工过程中变质;(3)增加其在各种食品中的适用性。
本研究的目的是通过制备多酚-蛋白质-多糖复合物,以光谱法探究乳铁蛋白、表没食子儿茶素没食子酸酯(EGCG)、多糖间的相互作用方式。以乳铁蛋白、EGCG 和多糖 (海藻酸钠和阿拉伯胶)为壁材组分,通过层层自组装法构建姜黄素纳米乳液,分析姜黄素乳液的粒径、ζ-电位、流体行为、光照稳定性和生物可及性,旨在探究不同界面组成的共价复合物对乳液物理性质、稳定性,以及包埋活性成分(姜黄素)的化学稳定性的影响,以期为开发新型功能因子递送体系提供理论参考。
1 材料和方法
1.1 材料与仪器
乳铁蛋白(Lactoferrin,LF),上海普洛钦国际贸易有限公司;阿拉伯胶(Gum Arabic from acacia tree,GA)、海藻酸钠 (Alginic acid sodium,SA)、2,2-联苯基-1-苦基肼基 (DPPH,纯度95%),Sigma-Aldrich 公司(美国圣路易斯);姜黄素(Curcumin,纯度≥95%)、表没食子儿茶素没食子酸酯(EGCG,纯度≥98%),北京北实纵横科技发展有限公司;无水乙醇,天津市致远化学试剂有限公司;黏蛋白、胃蛋白酶、胰酶、胆盐,上海西格玛奥德里奇贸易有限公司。其它化学试机均为分析纯级。
AUW120D 电子天平,岛津公司;DZKW-4 电子恒温水浴锅,北京市中兴伟业仪器有限公司;KO-500DE 数控超声波清洗器,昆山市超声仪器有限公司;AH-BASIC 高压均质机,上海ATS 工业系统有限公司;84-1A 磁力搅拌器、pH 计,奥豪斯仪器有限公司;HC-3018R 高速冷冻离心机,安徽中科中佳科学仪器有限公司;XH-C 漩涡混合器,金坛市白塔新宝仪器厂;ZEN3600 激光纳米粒度仪,英国马尔文仪器有限公司;UV-1240 紫外可见分光光度计,日立公司;DW-HL668 超低温冷冻储存箱,中科美菱低温科技股份有限公司;DHR-1旋转流变仪,Waters 公司;LGJ-25C 真空冷冻干燥器,北京四环仪器厂;荧光分光光度计,美国PE 公司;Vetex70-傅里叶变换红外光谱,德国布鲁克公司;RS-232C 可程式氙灯老化试验机老化箱,东莞市精域环境测试设备有限公司。
1.2 试验方法
1.2.1 乳铁蛋白-EGCG 二元共价复合物的制备采用碱处理诱导法[6],将一定的LF 和EGCG 分别溶解于50 mL 去离子水中,将蛋白溶液的浓度控制在质量分数0.5%,EGCG 的浓度控制在质量分数0.1%,使用0.2 mol/L 的NaOH 将2 种溶液的pH 值调至9.0,过夜保证其充分水合。将两种处理好的溶液在连续搅拌条件下以1∶1 的体积比混合。将该混合物暴露于空气中24 h 后,采用去离子水透析48 h,为保证未参与反应的游离EGCG可以透析完全,每隔6 h 换1 次水。将样品置于冷冻干燥装置2~3 d 保证产物完全冻干,得到冻干LF-EGCG 样品。
乳铁蛋白对照组的处理方法同上,不加入EGCG。
1.2.2 加热及pH 值对LF-EGCG 二元共价复合物颗粒性质的影响 将制备好的LF-EGCG 溶液倒入20 mL 试管中,调节至已知的pH 值,然后将其置于90 ℃水浴处理20 min,得到加热的样品H(LF-EGCG)。样品在热处理过程中不搅拌,通常容器的中心温度在加热2 min 后才能到达40 ℃,即初始加热速率为20 ℃/min。因此,样品要比球状蛋白质的热变性温度高至少10 ℃,这足以使蛋白质解折叠并发生聚集[7]。热处理后,将溶液从水浴中移出并在室温(25 ℃) 下冷却,在分析前静置18~24 h,将所得悬浮液调节至不同pH 值,测定不同pH 值下的ζ-电势。
1.2.3 乳铁蛋白-EGCG-多糖三元复合物的制备参照Peinado 等[8]的方法,采用热处理协同静电自组装法制备乳铁蛋白-EGCG-多糖复合胶体颗粒。将一定量的乳铁蛋白-EGCG 二元共价复合物溶解在双蒸水中(质量分数1%),阿拉伯胶和海藻酸钠溶解在20 mL 去离子水中(质量分数0.2%),搅拌过夜使其充分水合。待完全溶解后,用0.2 mol/L的HCl 和NaOH 将复合物溶液的pH 值调节到8.0。静置后移入具塞试管,90 ℃水浴加热20 min。室温冷却后,将溶液pH 值调至4.0。与等体积的不同浓度多糖(阿拉伯胶和海藻酸钠)溶液混合后静置1 h,形成以多糖为壳的胶体颗粒H (LFEGCG)-GA 和H(LF-EGCG)-SA。对形成复合胶体颗粒的条件进行优化,确定最优条件。
1.2.4 粒径和表面电荷测定 采用激光纳米粒度仪测量复合物的粒径和电位,每次测量12 次,结果以平均直径(Z-Average)、ζ-电位和多分散指数(PdI)表示。溶液在测量分析前用双蒸水稀释100倍,以避免多次散射的影响。所有试验均重复3次。
1.2.5 FTIR 分析 使用Spectrum 100 Fourier 变换分光光度计在500~4 000 cm-1范围内测量,分辨率为4 cm-1。将10 mg 乳铁蛋白、未经加热的二元复合物、加热的二元和三元复合物样品与100 mg KBr 粉末混合后压制成小球,将混合物压入光盘进行光谱记录。以KBr 作为参考,所有试验均重复3 次。
1.2.6 荧光光谱 蛋白质发射荧光主要来源于3个氨基酸残基的影响:苯丙氨酸 (Phe)、酪氨酸(Tyr)和色氨酸(Trp)。Trp 荧光因其对环境极性的高灵敏度被广泛用于研究蛋白质与其它大分子之间的相互作用[9]。
通过荧光分光光度计在25 ℃下对所有样品进行荧光测量。在0.2 mg/mL 的恒定质量浓度下测量蛋白质的固有荧光。设置激发波长为292 nm,发射波长记录范围为300~450 nm。激发和发射狭缝宽度为10 nm,扫描速度为240 nm/min。所有数据都在25 ℃下收集,单个发射光谱是3 次测量值的平均值。
1.2.7 姜黄素乳液的制备 单层乳状液的制备:将对照LF 和LF-EGCG 共价复合物 (质量分数1%)分别溶解于双蒸水中,取一部分LF-EGCG 溶液水浴加热(90 ℃,20 min),热处理后,将溶液从水浴中移出并在室温下冷却,得到H(LF-EGCG)溶液。所有溶液溶胀过夜,形成水相(体积分数90%)。将MCT 加热至60 ℃,加入姜黄素(质量分数0.1%)并磁力搅拌10 min,得到油相(体积分数10%)。采用高速乳化剪切机进行剪切处理,速度设定为10 000 r/min,在剪切过程中用一次性注射器将油相缓慢加入至水相,每个样品处理3 min,每次处理间隔3 min,得到粗乳液。将粗乳状液加入至高速均质机进一步均质,得到姜黄素纳米乳液。均质压力保证在60 MPa 左右,共均质3 次。
双层乳状液的制备:取一定体积的H (LFEGCG)单层乳状液,一边加入多糖溶液(质量分数0.2%)一边剪切,剪切速度为10 000 r/min,每个样品处理3 min,每次间隔3 min。得到粗乳状液后,使用高压均质机对粗乳状液进一步均质。均质压力保证在60 MPa 左右,均质3 次后得到H (LFEGCG)-GA 和H(LF-EGCG)-SA 姜黄素乳液。所有乳液均贮藏于4 ℃环境下。
1.2.8 乳液粒径及电位分析 采用激光纳米粒度仪测量乳液的粒径(Z-average size)和ζ-电位,每次测量3 次后取平均值。为减小乳液浓度过高导致多重光散射对测量造成的误差,所有样品在分析测试前均用双蒸水(pH 6.0)稀释至油相质量分数为0.005%。每个样品重复3 次分析。
1.2.9 流变学特性分析 采用AR1500 型流变仪测定乳液的流变性质。夹具采用Φ40 mm 不锈钢平行板,取约1 mL 乳液于测量板上,选择稳态剪切模式,测定溶液的表观黏度随剪切速率的变化;同样取约1 mL 乳液于测量板上,选择小幅振荡模式,固定振荡应力为1 Pa,测定溶液储能模量G'和损耗模量G″随振荡频率的变化。
1.2.10 乳液的稳定性测定 参考Davidov-Pardo等[10]的方法分析乳液中负载的姜黄素对UV 光的稳定性。
首先配制不同浓度的姜黄素乙醇溶液,使用紫外可见分光光度计分别测量其在425 nm 波长处的吸光度,绘制出姜黄素的吸光度标准曲线。根据标准曲线分析样品中姜黄素的含量:将5 mL 新鲜制备的乳液放进设定好的老化箱进行光照处理,光照条件为0.68 w/m2,25 ℃光照120 min,每隔30 min 取样并测定不同乳液中姜黄素的吸光度值,根据标准曲线计算出不同乳液处理后姜黄素的剩余浓度,比较不同样品光照下的稳定性差异。
1.2.11 生物可及性测定 根据Meng 等[11]的方法进行体外模拟消化,测量姜黄素的生物可及性。
初始体系:取20 mL 新鲜制备的乳液置于37℃恒温磁力搅拌器中进行搅拌处理 (100 r/min)。所有组均用锡箔纸包裹避光。
模拟口腔:包含0.03%粘蛋白的模拟唾液20 mL 于37 ℃预热后与初始样品混合,将pH 值调节至6.8,37 ℃,100 r/min 恒温磁力搅拌10 min。
模拟胃消化:取20 mL 口相样品转移到100 mL 烧杯中,与20 mL 包含0.0032%胃蛋白酶的模拟液混合,将pH 值调节至2.5,37 ℃,100 r/min 恒温磁力搅拌2 h。
模拟肠道消化:取30 mL 胃相样品转移到100 mL 烧杯中,并用1 mol/L NaOH 将pH 值调节至6.95~6.99 后,加入1.5 mL 盐储备液、预先制备的胆汁盐溶液(0.1875 g 胆盐加入3.5 mL、pH 7.0的磷酸盐缓冲液)及胰蛋白酶溶液(0.06 g 脂肪酶加入2.5 mL、pH 7.0 的磷酸盐缓冲液)。用0.25 mol/L NaOH 滴定以保持样品的pH 值为7.00,在37 ℃条件下恒温磁力搅拌2 h。
姜黄素的生物可及性分析:将小肠消化液在4 ℃,4 000×g条件下离心40 min,收集上清液,代表消化过程中形成的“胶束”部分。用乙醇提取胶束中的姜黄素,涡旋振荡后在4 000×g条件下继续离心20 min,取上清液在425 nm 波长处测定吸光值。采用公式 (1) 计算姜黄素的生物可及性(Bioaccessibility,BA)。

1.2.12 数据统计分析与处理 所有试验重复3次,处理后的数值以“平均值±标准偏差”表示。使用软件SPSS 18.0 进行单因素方差分析,基于Duncan 的多重比较检验,确定数值之间的差异。
2 结果与分析
在食品加工过程中,食品工艺条件,尤其是温度和pH 值对食品中蛋白质的理化性质有重要影响。因此,本研究首先采用理化分析方法表征了加热处理、pH 值、多糖浓度对不同样品粒径和ζ-电位的影响,以筛选出最适pH 值和多糖浓度制备姜黄素乳液。通过将质量分数0.25%乳铁蛋白-EGCG 溶液与GA、SA 溶液(质量分数0.2%)在不同pH 值(2~10)条件下混合,确定形成蛋白-多酚-多糖三元复合物的最佳pH 值和多糖浓度。
2.1 不同pH 值条件下二元共价复合物及加热颗粒的电位和粒径
蛋白质可以带正电荷或带负电荷,具体取决于pH 值。当蛋白质被多酚共价修饰时,会导致其等电点的改变[6]。由前人研究可知,LF 是一种较高等电点(pH 8.5)的碱性蛋白,相对较高的等电点可以通过乳铁蛋白N 末端的独特碱性区域来解释,该碱性区域可以结合酸性分子[12]。
由图1a 可知,随着pH 值的增加,LF 水溶液的ζ-电位值先升高后降低,在pH 9 时由带正电转为带负电。这意味着LF 的等电点在8~9 之间,该结论与Liu 等[13]研究结果一致。LF-EGCG 复合纳米粒子的等电点处于4~5 之间,说明EGCG 与LF 的共价结合导致蛋白质的电荷性质发生了变化,经过多酚修饰后,LF 的等电点出现较大幅度的降低。
由图1b 可知,LF 粒子的粒径随pH 值的增加呈现先降低后升高又降低的趋势,在等电点附近达到最小值,pH 8 时达到最大值。LF-EGCG 的粒径变化随pH 值的变化不大,始终小于0.25 μm。与EGCG 结合后的二元复合纳米粒子的粒径与LF相比,明显下降。这说明EGCG 在LF 碱处理后与LF 生成的共价键使得LF 的结构更加致密,表现为每个pH 值对应的粒径至少降低0.30 μm。经加热处理后,不同复合物样品的粒径和电位变化不大,而加热会导致蛋白质疏水基团的暴露,形成更为稳定的纳米颗粒。因此选择加热的LF-EGCG进行后续试验。

图1 不同pH 值条件下不同样品的ζ-电位(a)和粒径(b)Fig.1 ζ-Potential (a) and size (b) of different samples at different pH value
2.2 不同pH 值条件下三元复合物的电位和粒径
羧酸多糖在高于其pKa 的pH 值范围内带负电荷。在一定的pH 值条件下,多糖链主链上的基团会与蛋白质分子产生静电相互作用,最终会影响蛋白质-多糖混合体系的稳定性[14]。由图2a~2c可知,作为阴离子多糖,SA 和GA 的水溶液电位值随着pH 值的变化始终为负值,且带电量在零电荷点之后整体上随着pH 值的升高而增大。在与H(LF-EGCG)结合后,可以发现两种多糖的加入使得复合纳米粒子的带电情况发生了明显变化。LF-EGCG-多糖混合体系中的净ζ-电位介于单个蛋白质和多糖值之间,零电荷点<pH 4。三元复合物的ζ-电位变化趋势与多糖、LF-EGCG 相似,而等电点的出现明显低于二元复合物,当pH值高于等电点后,在一定范围内所带电荷量也随着pH 值的升高而增大,略有不同的是H (LFEGCG)-SA 在pH 6 时达到最大值,此后电荷量略有降低。SA 和GA 溶液中多糖分子的ζ-电位均为负值,这可以归因于两者都属于含有羧基官能团(pKa≈3.5)的阴离子生物聚合物。
静电相互作用、氢键和疏水相互作用在蛋白质-多糖聚集体的粒径和稳定性中起重要作用[15]。由图2d 可知,随着SA 和GA 的加入,三元复合粒子的粒径明显升高,H(LF-EGCG)与GA 结合后,在pH 6 处粒径达到最大值,而后粒径急剧减小。H(LF-EGCG)-SA 的粒径随着pH 值的增加呈先增大后减小的趋势,粒径在pH 3 处达到最大值,在pH 4 之后变化幅度趋于平缓。通过比较两种三元复合物,可以发现,H(LF-EGCG)-SA 的粒径始终小于H(LF-EGCG)-GA,这说明由于静电排斥作用的存在,SA 与H(LF-EGCG)结合更紧密。
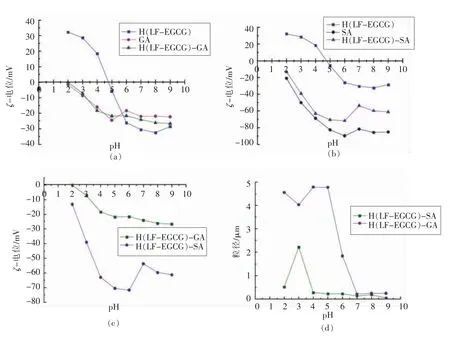
图2 不同pH 值条件下不同样品的ζ-电位(a~c)和粒径(d)Fig.2 ζ-Potential (a-c) and size (d) of different samples at different pH values
2.3 不同复合物的内源荧光分析
LF 分子中有13 个色氨酸残基[16]。通常可以通过蛋白质在340 nm 附近的荧光反映色氨酸残基的信息,而发射强度的差异反映色氨酸残基周围环境的变化[17]。同时最大发射强度(λmax)的位置偏移可反映发色团分子和蛋白质疏水腔周围的极性变化[18]。在色氨酸残基的吲哚基团被掩埋在天然蛋白质结构中时,会发生λmax的蓝移,在蛋白质结构展开时发生红移[19]。由图3可知,LF-EGCG、H(LF-EGCG)等复合物均发生了猝灭,说明碱处理使得EGCG 与LF 发生了结合。研究证明,芳香族氨基酸与EGCG 结构中的苯环作用会引发其荧光强度的淬灭[20]。此外,EGCG 的加入使得λmax发生了蓝移,说明色氨酸的微环境发生了改变,这可能是由于EGCG 表面的多羟基改变了LF 的亲水性。加热处理后的二元复合物淬灭幅度略大于未处理组,说明加热处理有利于增强淬灭水平[21]。此外,加入多糖后可明显观察到荧光强度增加,说明猝灭能力降低,这些结果可能归因于多糖的加入诱导了LF 分子展开以及色氨酸残基的暴露。

图3 LF、LF-EGCG 共价复合物、加热后的LF-EGCG、H(LF-EGCG)-SA/GA 三元复合物的荧光光谱Fig.3 Fluorescence spectra of LF,LF-EGCG conjugate,H(LF-EGCG) conjugate and LF-EGCGSA/GA ternary complexes
2.4 不同复合物的FTIR 分析
FTIR 可用于探究蛋白质、多糖和多酚之间的相互作用。在酰胺A 带,LF、LF-EGCG 和H(LFEGCG) 分别在3 306,3 310,3 310 cm-1附近的吸收峰代表C-N 伸缩和氢键。在酰胺I 带,LF、LFEGCG、H (LF-EGCG) 分别在1 658,1 664,1 666 cm-1处的吸收峰为C=O 伸缩振动;在酰胺II 带,LF、LF-EGCG、H(LF-EGCG)分别在1 543,1 537,1 537 cm-1处的吸收峰为C=O 拉伸振动和C-N 伸缩振动结合。而其中C=O 键和C-N 键都与蛋白质二级结构不同元素之间的氢键形成有关[22-23]。SA和GA 在3 402,3 401 cm-1附近存在的吸收峰是由O-H 键的拉伸振动所引起,在2 937,2 939 cm-1处的吸收峰是由于CH2基团的C-H 键拉伸振动导致,而在1 636,1 638 cm-1附近的吸收峰是由于羧基的C-H 键拉伸振动所引起[24]。
由图4可知,当LF 与EGCG 碱处理发生共价结合后,蛋白质酰胺I 带的光谱出现了明显位移,LF-EGCG 和H (LF-EGCG) 的特征峰均在3 309 cm-1处,与对照组的特征峰相比移动了4~5 nm,说明蛋白质的-NH2基团参与了反应。此外,可以发现酰胺Ⅱ带中二元复合物相比于LF,吸收峰的位置都发生了一定程度的移动,这主要归因于C=C双键振动和C-N 振动,推测是由于在共价反应过程中EGCG 氧化为醌,与蛋白质结合后形成了复杂的二聚结构所引起。
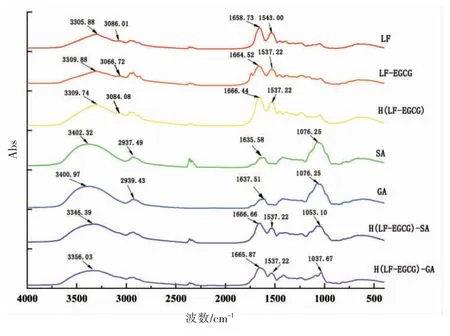
图4 LF、SA、GA、LF-EGCG 共价复合物、加热后的LF-EGCG 共价复合物、H(LF-EGCG)-SA/GA三元复合物的傅里叶红外光谱Fig.4 FTIR spectra of LF,SA,GA,LF-EGCG conjugate,H(LF-EGCG) conjugate and H(LF-EGCG)-SA/GA ternary complexes
H(LF-EGCG)-GA、H(LF-EGCG)-SA 两种复合物与GA、SA 及H(LF-EGCG)相比,酰胺I 带发生了较大位移(3 346.39 cm-1及3 356.03 cm-1),说明蛋白质与多糖之间有氢键形成,两组复合物酰胺Ⅰ带、酰胺Ⅱ带对应峰位置的改变表明蛋白与多糖之间形成了新的引力,这极有可能是H(LFEGCG)与多糖之间发生了静电相互作用。另外,由于没有新峰出现,说明所有复合物中蛋白质与多糖之间通过物理相互作用结合,并未生成化学键。
2.5 姜黄素乳液的粒径和ζ-电位
单层乳液和双层乳液在pH 4 的液滴粒径、PdI 以及ζ-电位结果如图5所示。对于单层乳液,通过二元共价复合物包埋的姜黄素乳液液滴的平均粒径要小于LF 制备的乳液,该结果表明LF 与EGCG 的共价结合改善了其乳化性质。另外,H(LF-EGCG)较LF-EGCG 更小一些,说明加热能起到增强LF-EGCG 复合物乳化能力的作用。研究结果表明,蛋白质与多酚发生共价结合后,会导致蛋白质分子所携带净电荷的变化,进一步影响蛋白质的理化性质,如两亲性和表面乳化性,最后改善复合物的亲水性[6]。这是由于LF 的构象发生了变化,致使多酚更容易结合疏水色氨酸,导致蛋白质的亲水性提高。这种效果也可能是因为多酚与LF 的结合增加了界面层的厚度和电荷,而加热又增强了这一作用,从而通过增加它们之间的空间位阻和静电排斥来改善它们的絮凝稳定性。同时,这3 种乳化剂形成的乳液PdI 都很小(<0.2),说明形成的乳液液滴大小均匀,乳液稳定性较好。
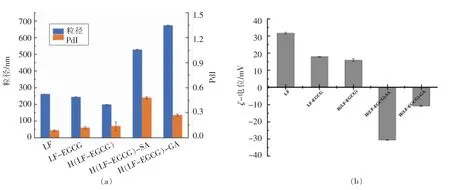
图5 不同样品制备乳液的PdI、粒径(a)和ζ-电位(b)Fig.5 PdI,particle size (a),and ζ-potential (b) of emulsions prepared with different samples
由LF、LF-EGCG 和H(LF-EGCG)共价复合物稳定的单层乳液液滴分布均匀、粒径较小,具体表现为较小的PdI 值(<0.15)和粒径(<300 nm)。与二元共价复合物制备的单层乳液相比,由H(LF-EGCG)-多糖稳定的双层乳液液滴粒径较大(粒径>500 nm,PdI<0.15),表明SA 和GA 分子都可以吸附到阳离子LF-EGCG 共价复合物包埋的液滴表面,通过形成较厚的界面层,提高液滴间的空间排斥作用,防止乳液聚集,进一步增强了乳液的稳定性。在双层乳液中,LF 吸附在油/水界面层,多糖长链则延伸至水相,这样形成的复合物大大促进了小液滴的形成[25]。
LF 包埋的乳液带正电荷,而多糖包埋的液滴ζ-电位值由31 mV 左右变为-30 mV 左右,这表明带有负电荷的GA 和SA 成功吸附在H (LFEGCG)稳定的乳液液滴表面。这种现象主要是由于:(1) 海藻酸钠和阿拉伯胶都是阴离子多糖,可以通过静电结合吸附到乳铁蛋白表面;(2)LF 上暴露的疏水基所导致的疏水性相互作用。根据Zhao 等[26]的研究结果可知,当电位绝对值大于25 mV 时,此时的乳液抗絮凝能力强。因此得出结论,EGCG 共价结合LF 或负电荷多糖的吸附,导致乳液液滴间出现了较强的静电排斥现象,使得乳液物理稳定性良好。
根据以上分析,利用阴离子多糖稳定形成的姜黄素双层乳液,特别是SA 稳定的乳液,由于其较强的静电排斥作用,同时又在乳液液滴的表面形成了相对厚的带电界面层,两者的共同作用导致SA 的加入能够抑制液滴的聚集,形成稳定的乳液。
2.6 姜黄素乳液的流变特性
流变学是研究物质的流动与形变的科学。研究物质的流变特性,其目的不仅在于研究力学行为,也着重于不同物质的力学特性与结构之间的关系。根据斯托克斯定律,乳液的黏度越大,乳液液滴的沉降或上浮速率也就越小,从而在一定程度上增强了乳液的物理稳定性。因此,研究乳液的黏度对深入了解乳状液的物理稳定性至关重要。
从图6可以明显看到,所有乳液的表观黏度随着剪切速率的升高(从0.1 s-1增加到100 s-1)而显著下降,表现出明显的剪切变稀行为,符合假塑性流体特征。未加入多糖的单层乳液中,由LF 稳定的姜黄素乳液的表观黏度显著高于由LFEGCG 共价复合物稳定的乳液,表明乳液未发生絮凝现象。在加入阴离子多糖后双层乳液的表观黏度明显增加,说明包裹在液滴表面的多糖较长的分子链在溶液中相互缠结或聚集,产生较强的氢键和疏水作用力,从而增加溶液的黏度[27]。
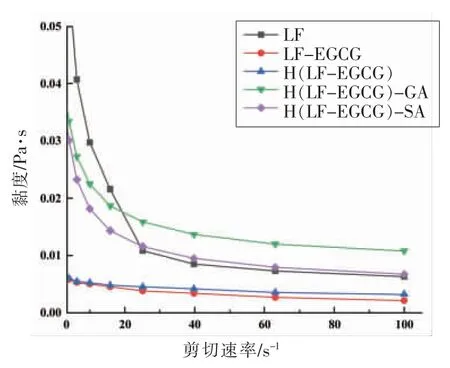
图6 不同样品制备的乳液的表观黏度Fig.6 The apparent viscosity of emulsions prepared with different samples
2.7 姜黄素乳液的光照稳定性
由于结构中具有共轭键,姜黄素在受到不利的环境压力(光、热和氧气)时,容易发生化学降解[28]。图7显示了暴露于一定强度的光照条件下,在处理2 h 的过程中不同乳液中姜黄素保留率的变化。通过图7a 可观察到,在没有乳液保护的姜黄素乙醇溶液中检测到最严重的姜黄素降解,双层乳液中的姜黄素比单独使用LF-EGCG 或LF稳定的乳液具有更好的化学稳定性。当紫外线处理2 h 后,通过LF-EGCG 和多糖稳定的双层乳液中姜黄素的保留率相似,分别为64.0%和63.7%,而单独使用LF 的保留率仅为33.8%。通过比较LF-EGCG(39.8%)和H(LF-EGCG)(57.1%)稳定的单层乳液,可以发现H(LF-EGCG)稳定的单层乳液中姜黄素的保留率比LF-EGCG 稳定的单层乳液中姜黄素的保留率相对更高。
为了比较不同乳液对姜黄素稳定的效果,采用一级反应动力学公式ln(C/C0)=-kt(式中,k——反应速率常数;t——时间,min)对数据进行拟合,如图7b 所示,计算了速率常数和半衰期。通过表1中半衰期的计算结果发现,随着光照时间的延长,姜黄素的保留率逐渐降低,与未经乳液包埋的游离姜黄素相比,SA 和GA 稳定的双层乳液半衰期明显增加,由54.15 min 分别增加至198.04 min和195.44 min。单层乳液的保护性也较为明显,LF(74.53 min)、LF-EGCG (100.46 min) 和H (LFEGCG)(157.53 min) 包埋的姜黄素乳液对应的半衰期也相继大于姜黄素乙醇溶液。在LF-EGCG和H(LF-EGCG)稳定的单层乳液中姜黄素降解较少的原因可能是EGCG 具有优异的抗氧化活性,可以保护姜黄素免受自由基的攻击[29]。
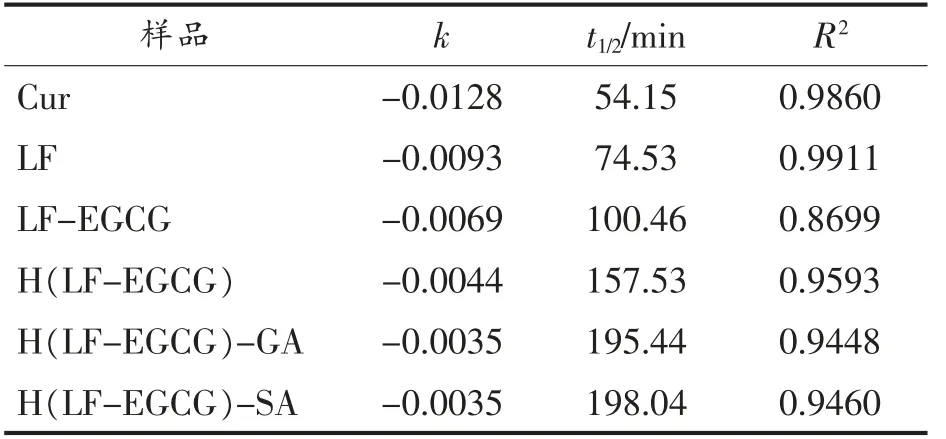
表1 姜黄素光降解一级动力学模型参数Table 1 Parameters of first-order kinetic model for photodegradation of curcumin
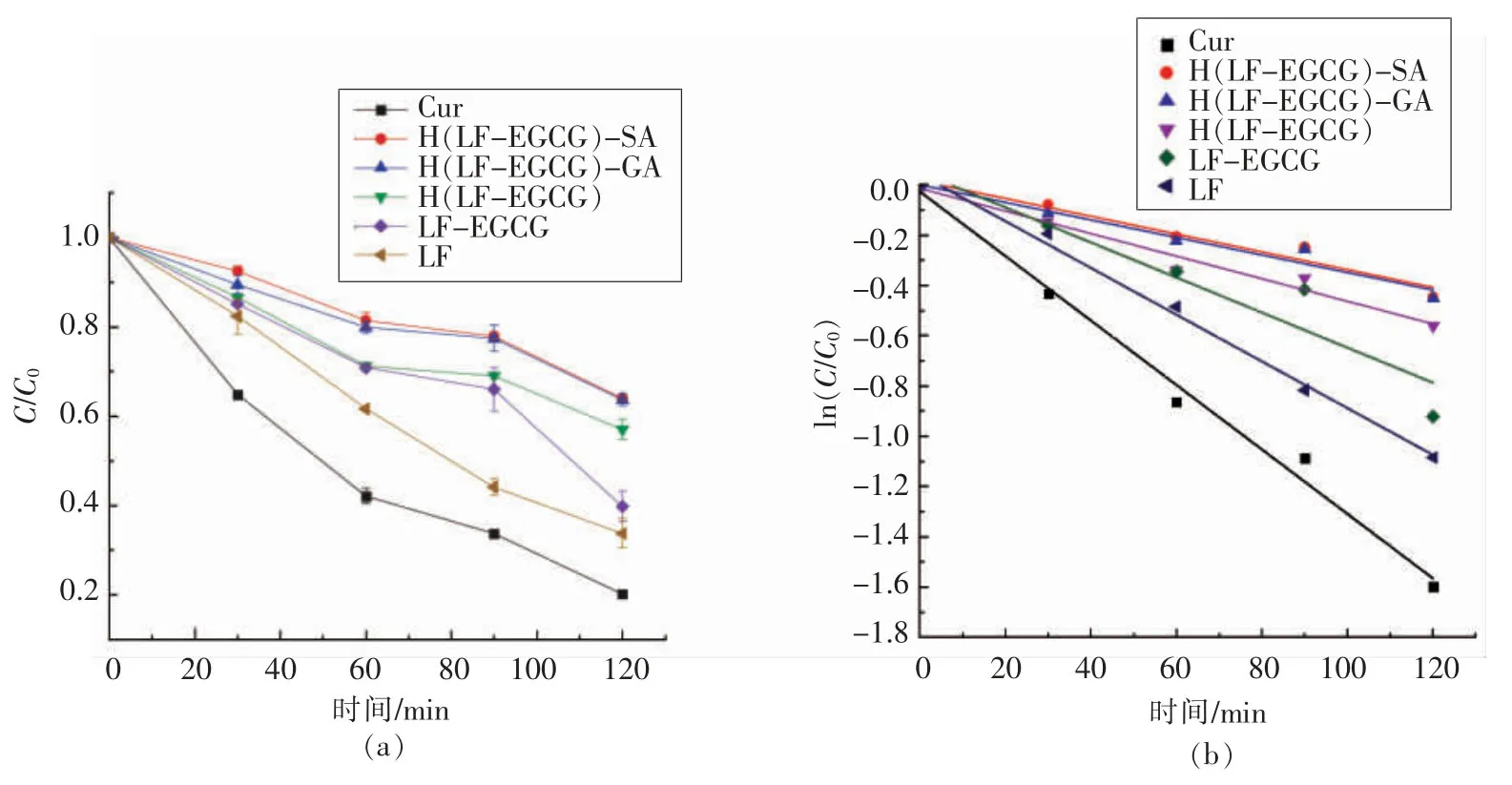
图7 不同样品的姜黄素保留率(a)和光降解一级动力学模型(b)Fig.7 Curcumin retention rate of different samples (a) and first-order kinetic model of photodegradation (b)
综上所述,由H(LF-EGCG)、SA 和GA 制备的双层乳液的光稳定性显著强于LF 以及二元复合物稳定的单层乳液。推测双层乳液显著抑制姜黄素降解的原因:首先,双层乳液与单层乳液相比,静电吸附作用下的阴离子多糖吸附在携带正电荷的H(LF-EGCG)所包埋的姜黄素乳液液滴表面,最终形成较厚的界面层。而该界面层的存在极大地降低了姜黄素的降解率,通过隔绝外界环境中游离扩散的自由基达到保护作用;第二,体积越大,相应的比表面积越小,双层乳液的液滴粒径相较于单层乳液较大,因此其比表面积小。比表面积小会导致化学反应效率低下,因此降低了功能因子降解的化学反应速率[29]。
2.8 姜黄素的生物可及性
通过体外消化模型,模拟人体消化过程,分析了姜黄素的生物可及性,结果如图8所示。LF 稳定的姜黄素乳液生物可及性较低(<25%),是由于姜黄素与乳铁蛋白分子或乳铁蛋白的消化产物结合,导致其在胶束相中未检出[30]。不同的姜黄素乳液,其姜黄素的生物可及性存在差异,LF、LFEGCG 和H(LF-EGCG)共价复合物稳定的单层乳液中姜黄素的生物可及性分别为23.54%,31.18%和36.15%;双层乳液中,GA 稳定的乳液中姜黄素生物可及性最高,达到了69.53%,SA 为60.63%。这些结果表明,使用多糖尤其是GA 包埋脂质液滴增加了转移到胶束相中姜黄素的含量,研究推测可能的原因为:多糖包埋可能有助于控制脂质在胃肠道内的消化率,包埋后的脂质被消化后,再释放出亲脂成分,导致混合胶束中姜黄素的保留率升高[30];也可能是由于多糖所带的负电荷导致静电排斥作用,减少了模拟消化条件下发生的液滴聚集[25]。
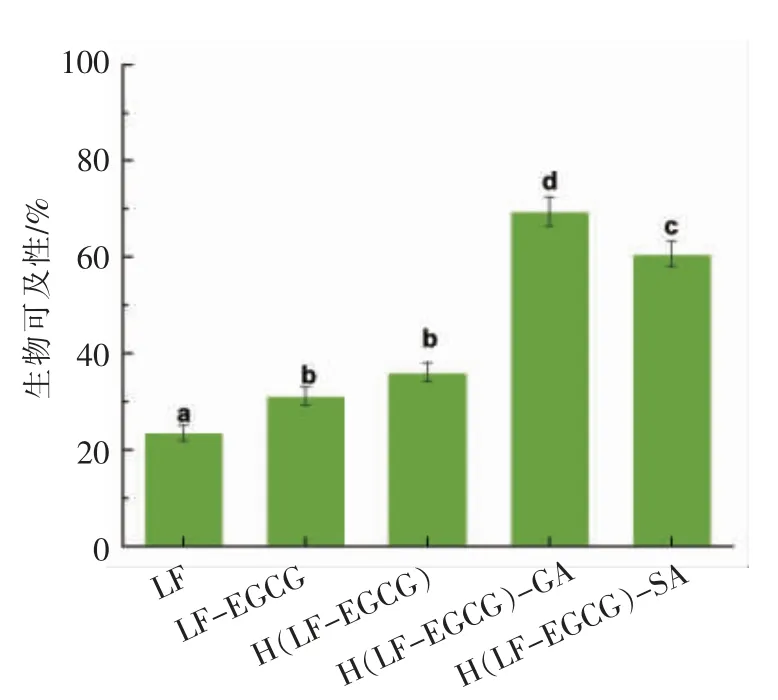
图8 不同样品制备的乳液中姜黄素的生物可及性Fig.8 Bioaccessibility of curcumin in emulsions prepared with different samples
3 结论
本研究制备了LF-EGCG 二元共价复合物,研究了蛋白质多酚共价复合物和多糖间的相互作用,利用光谱学分析了LF、EGCG 及多糖间的相互作用机理,FTIR 和荧光光谱显示LF 与EGCG 在碱处理后发生了共价结合,多糖则是通过氢键结合。在此基础上,通过层层自组装法构建姜黄素乳液,主要探究了界面组成和结构对乳液的流变特性、稳定性以及姜黄素生物可及性的影响。研究发现与单独使用LF 或LF-EGCG、H(LF-EGCG)二元复合物稳定的乳液相比,添加多糖使液滴的表面多了一层较厚的保护层,能有效阻止液滴的破裂,抑制姜黄素降解,提高姜黄素的光照稳定性和生物可及性。本研究结果可用于合理设计具有较好理化稳定性的乳液递送体系,同时可拓宽姜黄素在食品和药品领域的应用范围。
