血清白细胞介素-35、成纤维细胞生长因子-23 及胎球蛋白A 浓度在冠心病患者中的表达及与其冠状动脉狭窄的关系△
2021-11-22张丽霞赵存瑞江尕学王俊乾
张 博,张丽霞,赵存瑞,江尕学,王俊乾,白 明
(兰州大学第一医院心内科,兰州730000)
我国冠状动脉粥样硬化性心脏病(coronary heart disease,CHD)患者约1 100 万,每年死亡例数约达400 万,其发病率及病死率有不断增加的趋势[1]。目前冠状动脉造影是诊断CHD 的“金标准”,其能在对冠状动脉狭窄程度进行诊断的同时,还能进行介入治疗,但其是一种有创性检查,有较多的禁忌症与并发症。深入研究CHD 的疾病发生、发展机制,寻找反映冠状动脉狭窄程度及疾病严重程度的血清标志物,具有重要的临床价值。目前认为,炎症反应是动脉粥样硬化的形成和发展重要因素[2]。白细胞介素(interleukin,IL)-35和胎球蛋白A 是近年来发现的抗炎性细胞因子,两者是非特异性负急性时相蛋白,有助于间接反映动脉粥样硬化的进展过程[3-4]。成纤维细胞生长因子-23(fibroblast growth factor 23,FGF-23)是由成骨细胞分泌产生的促炎细胞因子。研究表明,多种心血管疾病,如CHD、血管功能障碍等均存在FGF-23 异常表达的现象,其能通过促进血管钙化使动脉粥样硬化的进展加速[5]。本研究通过检测CHD 患者血清IL-35、FGF-23、胎球蛋白A 浓度,分析三者与冠状动脉狭窄的相关性,现作如下报道。
1 资料和方法
1.1 一般资料
选取2018 年2 月至2019 年2 月兰州大学第一医院收治的102例CHD患者为CHD组。纳入标准:(1)CHD 诊断根据临床表现、心肌酶学、心电图及冠状动脉造影等检查,符合2018 年中华医学会心血管病学分会制定的CHD 诊断标准[6];(2)患者均知情同意并已签署知情同意书;(3)半年内无创伤手术史。排除标准:(1)合并恶性肿瘤性疾病;(2)合并感染性或风湿免疫性疾病;(3)近期使用糖皮质激素等用药史。CHD 组中,男65 例,女37 例;年龄为(56.7±5.2)岁;根据CHD 类型分为稳定型心绞痛(stable angina pectoris,SAP)亚组(n=34),不稳定性心绞痛(unstable angina pectoris,USAP)亚组(n=31)及急性心肌梗死(acute myocardial infarction,AMI)亚组(n=37)。根据冠状动脉狭窄严重程度,将CHD 组患者轻度病变亚组(n=31)、中度病变亚组(n=38)、重度病变亚组(n=33)。以同期50 名健康查体者为对照组,男29 例,女21 例,年龄为(54.8±5.1)岁。两组受试者的年龄、性别比较,差异无统计学意义(P>0.05)。
1.2 血清IL-35、FGF-23、胎球蛋白A 浓度检测方法
取所有研究对象清晨空腹静脉血5 mL,以3 000 r/min 离心10 min,离心半径10 cm,取上层血清-20℃保存,采用酶联免疫吸附试验(ELISA)法检测血清IL-35、FGF-23、胎球蛋白A浓度。试剂盒均购自上海颖心生物科技公司(货号YX80322B、YX80061B 及TX21792)。以标准品的浓度为横坐标,以酶标仪测定的标准品450 nm 处的OD 值为纵坐标,绘制标准曲线。酶标仪检测样品450 nm处的OD 值,并根据血清样品的OD 值,计算对应的样品浓度,再乘以稀释倍数,得到样品实际浓度。
1.3 冠状动脉狭窄程度评价方法
所有患者进行冠状动脉造影检查,检查成功后采用Gensini 评分系统对各病变位置冠状动脉狭窄程度进行评价[7],狭窄程度为1%~25%计1 分、狭窄程度为26%~50%计2 分、狭窄程度为51%~75%计4 分、狭窄程度为76%~90%计8 分、狭窄程度为91%~99%计16 分、完全闭塞计32 分。病变位置:右侧冠状动脉病变、左前降支远端及左回旋支的中段计1 分,左前降支的中段计1.5 分,左前降支及回旋支的近端计2.5分,左主干计5分。Gensini评分的计算为狭窄程度和病变部位所得分值相乘再相加,其中重度病变大于等于100 分,中度病变为50~99 分,轻度病变小于50 分。
1.4 观察指标
收集两组一般临床资料,包括性别、年龄、原发性高血压(高血压)史、糖尿病史及吸烟史及脉压。常规生化指标应用全自动生化分析仪进行检测,记录血清三酰甘油(triacylglycerol,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholester⁃ol,HDL-C)。
1.5 统计学分析
2 结果
2.1 各组血清IL-35、FGF-23、胎球蛋白A浓度比较
与对照组比较,CHD 组血清IL-35 及胎球蛋白A 浓度明显较低,而FGF-23 浓度明显较高,差异具有统计学意义(均P<0.05);AMI 亚组血清IL-35、胎球蛋白A 浓度明显低于SAP 亚组及对照组,差异有统计学意义(均P<0.05),而与UAP亚组比较差异无统计学意义(均P>0.05);AMI亚组血清FGF-23浓度明显高于SAP亚组及对照组,差异有统计学意义(均P<0.05),而与UAP 亚组比较,差异无统计学意义(P>0.05),见表1。
表1 各组血清IL-35、FGF-23、胎球蛋白A 浓度比较 []
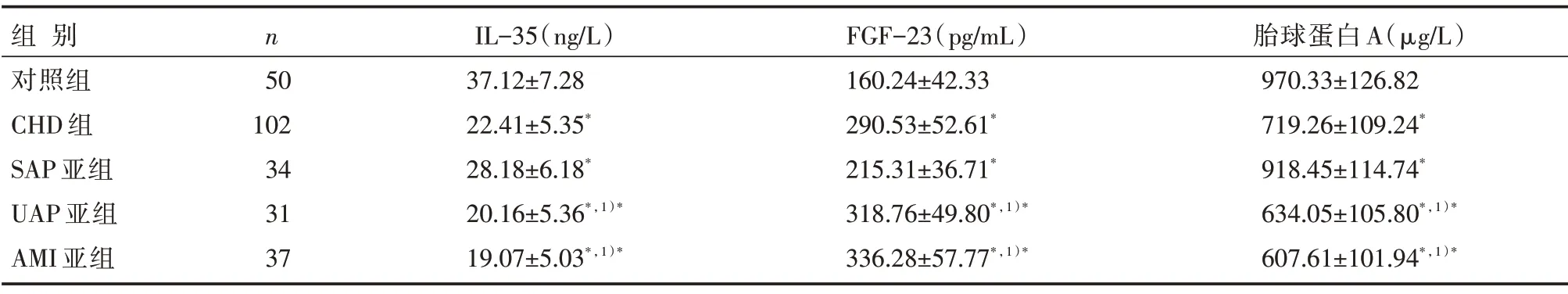
表1 各组血清IL-35、FGF-23、胎球蛋白A 浓度比较 []
注:与对照组比较,*P<0.05;与SAP 亚组比较,1)*P<0.05
2.2 冠状动脉狭窄程度与血清指标的相关性分析结果
反映CHD 患者冠状动脉狭窄程度的Gensini评分与血清FGF-23 浓度呈显著正相关,而与血清IL-35、胎球蛋白A 浓度呈显著负相关(均P<0.05),而与HDL-C、LDL-C、TC、TG 无明显相关性(均P>0.05),见表2。
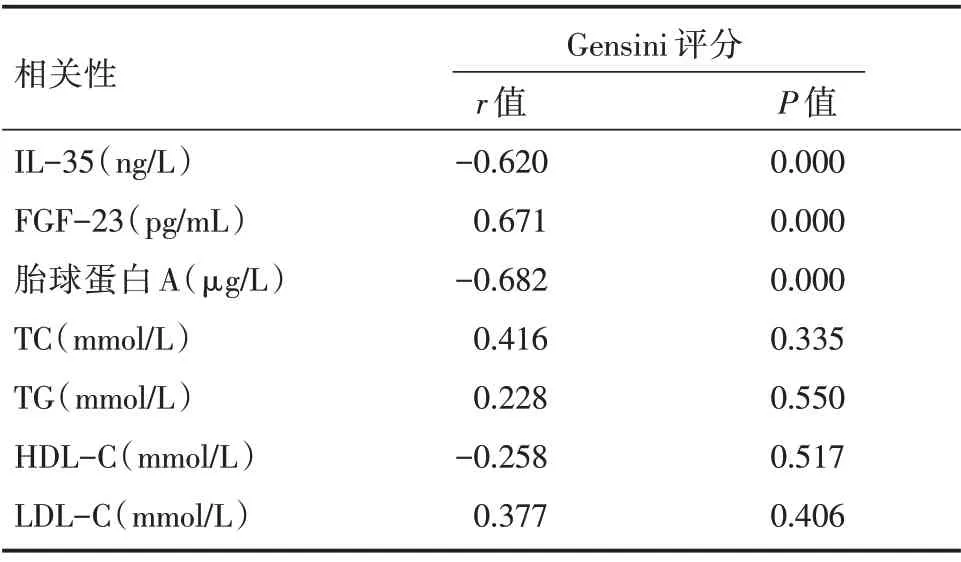
表2 冠状动脉狭窄程度与血清各指标的相关性分析结果
2.3 单因素分析冠状动脉狭窄严重程度的危险因素
冠状动脉狭窄严重程度与糖尿病史、血清FGF-23、IL-35及胎球蛋白A浓度有关(均P<0.05)。与轻度病变亚组患者相比,中、重度病变亚组患者血清FGF-23 浓度明显较高,而IL-35、胎球蛋白A浓度明显较低;冠状动脉中、重度病变亚组患者糖尿病比例高于轻度病变亚组患者,差异有统计学意义(均P<0.05),详见表3、4。
表3 不同冠状动脉病变程度亚组患者血清指标及基线资料比较 [n(%),]
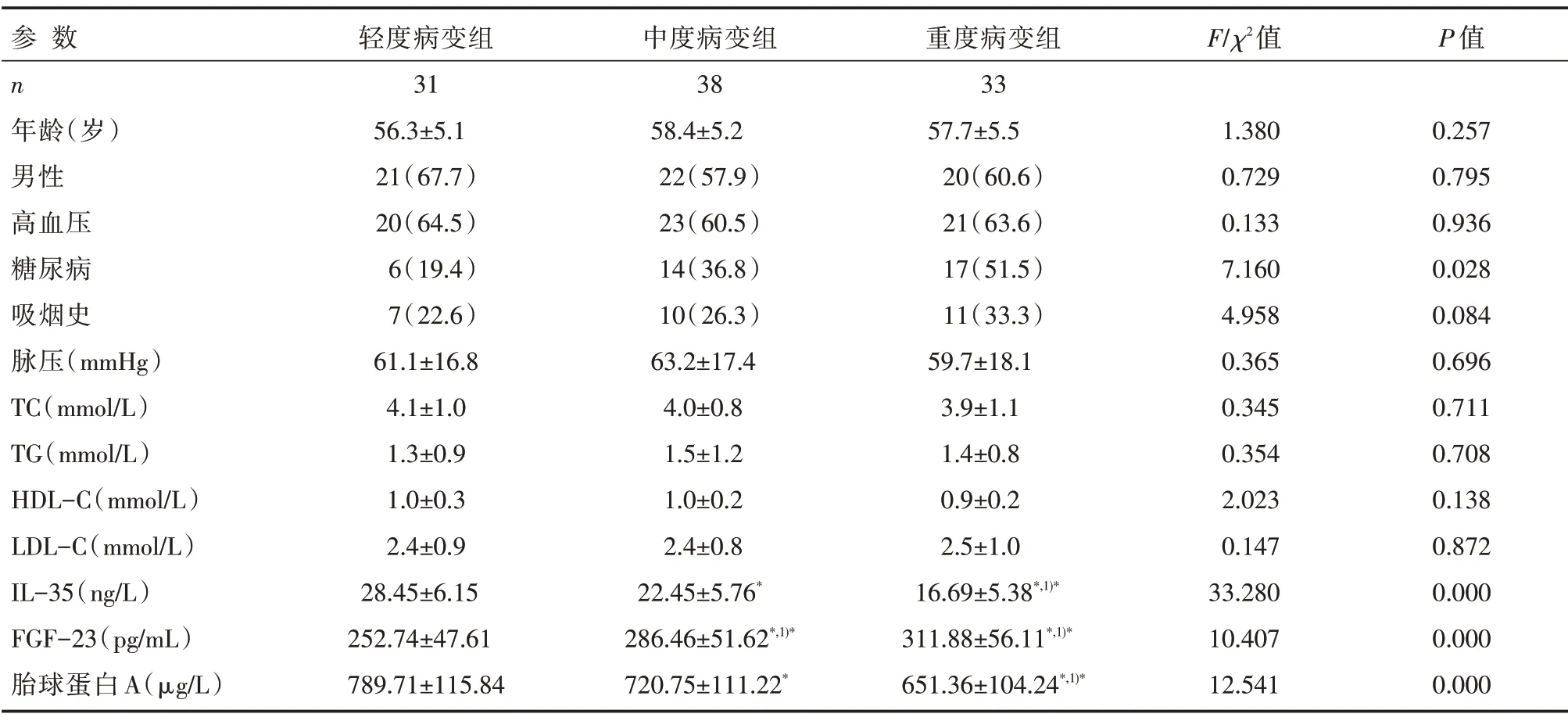
表3 不同冠状动脉病变程度亚组患者血清指标及基线资料比较 [n(%),]
注:与轻度病变亚组相比,*P<0.05;与中度病变亚组相比,1)*P<0.05;1 mmHg=0.133 kPa
2.4 多因素Logistic 回归分析冠状动脉狭窄严重程度的危险因素
多因素Logistic 回归分析结果显示血清IL-35、FGF-23、胎球蛋白A 浓度与冠状动脉狭窄程度有关,糖尿病史、血清高浓度FGF-23 及低浓度IL-35、胎球蛋白A 是冠状动脉狭窄严重程度的危险因素(P<0.05),见表4。
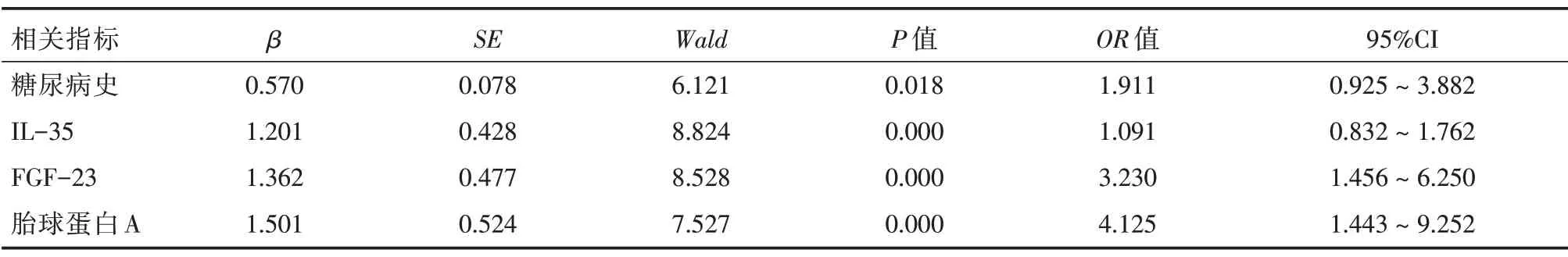
表4 冠状动脉狭窄严重程度的多因素Logistic 回归分析结果
3 讨论
动脉粥样硬化等因素常引起冠状动脉的狭窄和闭塞,导致CHD的发生。随着我国人口老龄化及人民饮食生活方式的改变,CHD 发病率及病死率呈不断上升的趋势。目前临床上对CHD 的机制尚未完全阐明,常见的CHD 危险因素包括吸烟、糖尿病及高血压等。但近年来学者们注意到,引起CHD 发生的主要因素——动脉粥样硬化是一个慢性炎症反应过程,涉及多种免疫细胞及炎症性因子功能失调,引起促炎及抗炎因子平衡失调,影响疾病的发生、发展的过程[8]。随着研究的不断深入,有学者发现,血清中某些促炎或抗炎因子的表达异常,能够引起冠状动脉血管重构,动脉内膜增厚,导致冠状动脉狭窄的发生,在CHD 的发生、发展中起着至关重要的作用[9]。寻找能够反映CHD疾病严重程度及冠状动脉狭窄程度的血清炎症因子,以及时、早期诊断及干预CHD的发展,对降低CHD 患者的致死率有重要意义。
FGF-23 是成纤维细胞生长因子蛋白家族成员,该家族具有广泛的促有丝分裂和细胞存活活性,并参与多种生物学过程。FGF-23 参与调节磷酸盐的稳态及慢性炎症过程,在矿物质代谢及促炎过程中发挥重要作用,提示可能亦参与心血管疾病的发生、发展。目前FGF-23 在CHD 患者血清浓度及其与冠状动脉狭窄的严重程度报道较少。本研究发现,CHD 组血清FGF-23 浓度均显著高于对照组,表明血清FGF-23 浓度可能是CHD发生的重要危险因素。研究发现,随着患者血清FGF-23 浓度不断升高,胆固醇和低密度脂蛋白代谢异常,引起冠状动脉脂质浸润和内皮损伤,促进动脉粥样硬化的发生[10]。AMI 亚组及UAP 亚组患者血清FGF-23 浓度明显高于SAP 亚组,表明随着血清FGF-23 浓度升高,CHD 患者病情严重程度上升越明显。其原因可能是FGF-23作为一种促炎性标志物,通过增加血管内皮细胞中血管细胞黏附分子-1 及E-选择素等的表达,促进单核细胞向内皮细胞黏附,促进动脉粥样硬化的进展[11]。此外,血清FGF-23 浓度与Gensini 评分呈显著正相关,并且血清高浓度FGF-23 是冠状动脉狭窄严重程度的危险因素,表明血清FGF-23 浓度越高,CHD患者冠状动脉狭窄程度越重。分析其机制,可能是血清FGF-23 浓度升高促进动脉平滑肌细胞的增生[12],同时FGF-23 增强磷酸盐诱导的血管钙化,促使动脉内皮细胞向成骨细胞分化,导致动脉壁僵硬,促进动脉粥样硬化斑块的形成,使冠状动脉狭窄程度增加[13]。此外,本研究中糖尿病史亦是冠状动脉狭窄程度的危险因素,一方面,高血糖导致代谢紊乱,多种代谢产物损伤血管内皮细胞,且血管内皮修复较慢,促进动脉粥样硬化的的发展。另一方面,有研究报道糖尿病患者中高浓度FGF23 能通过降低1,25 双羟维生素D 的生物学活性或促进25 羟维生素D 的降解,引起血管损伤,导致动脉粥样硬化[14]。
IL-35 及胎球蛋白A 是常见的抗炎性细胞因子。IL-35 是两亚基构成的异二聚体,主要表达于调节性T 细胞、效应性T 细胞及巨噬细胞中,通过结合相应靶细胞表面的B7H1 受体,发挥免疫的负向调节作用[15]。胎球蛋白A 是肝细胞合成的带负电荷的血清糖蛋白,由两条多肽链组成,参与内吞作用、大脑发育和骨组织的形成等过程。研究表明,胎球蛋白A 是急性期炎症反应负性蛋白,在动脉内膜炎症反应中发挥重要作用[16]。本研究中,CHD 组血清IL-35 及胎球蛋白A 浓度均显著低于对照组,并且AMI 组患者更为明显,提示IL-35 及胎球蛋白A 均参与CHD 的发生、发展过程,两者的抑制炎症作用在CHD 时明显减弱,加重炎症反应的程度及病情的恶化。其机制可能是CHD 发生时,动脉炎症部位的细胞因子如肿瘤坏死因子、IL-2 等浓度升高,负向调控胎球蛋白A 的表达,导致胎球蛋白A 表达下调,并同时抑制炎症局部调节性T 细胞IL-35 的分泌,导致IL-35 表达下调[17]。此外,血清IL-35 及胎球蛋白A 浓度与Gensini 评分呈显著负相关,并且血清低浓度IL-35、胎球蛋白A 是冠状动脉狭窄严重程度的危险因素,表明血清IL-35、胎球蛋白A 浓度越低,CHD 患者冠状动脉狭窄程度越重。说明血清IL-35、胎球蛋白A浓度在CHD 动脉粥样硬化的发展过程中具有关键性作用,随着上述炎症因子浓度的不断降低,动脉粥样硬化的程度不断加剧。有学者报道,动脉粥样硬化发展过程中IL-35 能够抑制线粒体活性氧诱导的H3K14 的乙酰化,而H3K14 的乙酰化能促进血管内皮细胞中转录因子AP-1 结合到细胞间黏附分子-1(ICAM-1)的启动子区域,促进细胞间黏附分子-1 的表达,因此IL-35 浓度越低,导致细胞间黏附分子-1 浓度显著升高,引起冠状动脉狭窄程度增加,而在动物模型中加用IL-35 治疗后,动脉粥样硬化的病变进展显著受到抑制[18]。而在体外心血管疾病研究模型中,发现胎球蛋白A能够抑制血管内皮细胞炎症反应、巨噬细胞泡沫细胞的形成、血管内皮细胞的增殖和胶原生成,抑制动脉粥样硬化的发生,因此,胎球蛋白A 浓度越低,动脉粥样硬化病变越重,冠状动脉的狭窄程度越重[19]。同时也提醒了临床工作中可通过对上述炎症因子浓度进行有效检测及控制,可一定程度上避免动脉粥样硬化的发生,改善CHD患者预后。
综上所述,血清IL-35、FGF-23、胎球蛋白A浓度在CHD 患者疾病发生、发展过程中发挥着极其重要的作用,并且是冠状动脉狭窄严重程度的危险因素,可能成为临床防治CHD 的敏感指标,值得临床深入的研究。
