参附注射液对失血性休克小鼠核因子-κB受体活化因子配体/骨保护素(RANKL/OPG)信号通路及肠屏障功能的影响※
2021-11-18于士昌翟建宾赵臣亮赵宏达
于士昌 翟建宾 赵臣亮 赵宏达 赵 亮
(河北省中医院心胸外科,河北 石家庄 050011)
失血性休克(hemorrhagic shock,HS)是临床常见病症,主要由主动脉瘤破裂、消化道大出血、手术创伤、外伤等导致体内血液大量丢失,严重时可导致死亡[1-2]。HS可诱导患者体内产生大量炎症因子,引发严重的炎性反应,引发肠屏障功能受损、肠黏膜通透性增高,造成肠道细菌移位,最终因肠源性脓毒血症引起多器官功能障碍,是导致患者病亡的主要原因[3-5]。核因子-κB受体活化因子配体/骨保护素(RANKL/OPG)信号通路是调控骨代谢的主要信号通路,也可参与调控炎性反应,下调RANKL/OPG表达可降低炎症因子水平,减少牙周组织炎症细胞浸润,显著抑制牙槽骨丢失[6]。另外研究发现,RANKL/OPG在炎症性肠病中高表达,与促炎因子白细胞介素8(IL-8)表达呈正相关[7],提示RANKL/OPG有望成为改善HS引发的肠屏障功能障碍的作用靶点。参附注射液来源于参附汤,主要由人参、附子2味中药组成,可温阳,益气,固脱,主治阳虚、厥脱诸证。现代药理研究表明,参附注射液能改善微循环、血压,在HS的临床抢救中应用广泛,并可降低脓毒症患者氧化应激水平,改善肠屏障功能损伤症状[8-9]。本实验通过构建HS小鼠模型,观察参附注射液对HS小鼠RANKL/OPG信号通路及肠屏障功能的影响,结果如下。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级BALB/c雄性小鼠72只,体质量18~22 g,购自济南朋悦实验动物繁育有限公司,动物合格证号:SCXK(鲁) 20190003。饲养在中国人民解放军陆军军医大学新桥医院动物房中,室内保持清洁,通风良好,噪声低于80 db,昼夜交替光照,温度约23 ℃,相对湿度约55%。
1.1.2 主要试剂 参附注射液[华润三九(雅安)药业有限公司,国药准字Z51020664];林格液(上海联迈生物工程有限公司,货号LM25-03060);OCT包埋剂(上海鑫乐生物科技有限公司,货号14020108926);苏木素-伊红(HE)染色试剂盒、丙二醛(MDA)含量检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、高效RIPA组织/细胞裂解液(北京索莱宝科技有限公司,货号分别为G1120、BC0020、BC0170、R0010);小鼠肠型脂肪酸结合蛋白(I-FABP)检测试剂盒(北京百奥莱博科技有限公司,货号ZN2607);二胺氧化酶(DAO)测试盒(南京建成生物工程研究所,货号A088-2);小鼠IL-1β酶联免疫吸附(ELISA)试剂盒、IL-6 ELISA试剂盒、BCA蛋白定量试剂盒、兔源Anti-β-Tubulin一抗、兔源Anti-RANKL一抗、兔源Anti-OPG一抗(美国Abcam公司,货号分别为ab197742、ab100713、ab102536、ab6046、ab9957、ab73400)。
1.1.3 主要仪器 血压测量仪(BP100型,上海玉研科学仪器有限公司),冰冻切片机(CM1950型,德国Leica公司),光学显微镜(Olympus CKX41型,德国Leica公司),电泳仪(JS-power600型,上海培清科技有限公司),酶标仪(Elx800型,美国Bio-Rad公司),转膜仪(Power-pac 3000型,美国Bio-Rad公司),凝胶成像分析仪(ImageMaster型,Applied Biosystems公司)。
1.2 方法
1.2.1 小鼠分组 将72只BALB/c小鼠按照随机数字表法分为6组,即假手术组、模型组、林格液组、参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组,每组各12只。
1.2.2 HS小鼠模型建立 除假手术组小鼠外,其余5组小鼠均参照文献[10],以15 mg/kg的剂量注射5%戊巴比妥钠溶液进行麻醉,固定在操作台,分离小鼠双侧股动脉并置管,其中一侧股动脉导管连接血压测量仪,持续测量小鼠血压,经另一侧股动脉导管取血,至小鼠血压降至30 mmHg(3.99 kPa),记录小鼠取血量,维持血压在(30±5)mmHg状态90 min,即完成HS小鼠造模。假手术组小鼠只分离双侧股动脉并置管,不取血。
1.2.2 给药 HS小鼠造模完成后,各药物处理组立刻经取血侧股动脉导管补液,均在30 min内完成补液。林格液组小鼠予取血量3倍的林格液补液[11];参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组将参附注射液溶于林格液,配制成2.5、5.0、10.0 mL/kg的药液[11],分别予取血量3倍的上述药液补液;假手术组、模型组小鼠不进行补液处理。
1.3 标本采集及检测方法
1.3.1 小鼠小肠组织病理损伤检测 补液完成后6 h,各组小鼠经股动脉导管取血3 mL,然后取下双侧导管,处死小鼠。血液经离心后,将上层血清保存于-80 ℃备用;开腹取出小肠组织,剪下约1.0 g,剪碎后置于匀浆管中,加入高效RIPA组织/细胞裂解液1.5 mL,4 ℃匀浆后离心,取上清液,按照试剂盒说明书,用BCA法测得其中总蛋白浓度,在-80 ℃保存备用;其他小肠组织置于0.9%氯化钠注射液中漂洗后,置于4%多聚甲醛溶液中固定,24 h后以30%蔗糖溶液脱水,48 h后加入OCT包埋剂,放置在-25 ℃包埋,最后以冰冻切片机切片,将所得冰冻切片取出,于室温放置30 min、4 ℃丙酮固定10 min、3%过氧化氢(H2O2)溶液孵育5 min、磷酸缓冲盐溶液(PBS)洗涤2次后,按照试剂盒说明书指导进行HE染色,最终封片,光学显微镜下观察着色情况并任选5个视野拍照。根据小肠黏膜组织病理形态,进行Chiu评分[12]:正常肠黏膜评0分;绒毛顶端黏膜下出现间隙评1分;黏膜下间隙扩大,肠黏膜与黏膜下层分离评2分;黏膜与黏膜下层分离延伸到肠绒毛两侧评3分;绒毛变钝,固有层及其血管暴露,炎性组织浸润评4分;固有层消化崩解,出血或形成溃疡评5分。
1.3.2 小鼠小肠组织MDA、SOD水平和血清DAO、I-FABP、IL-1β、IL-6水平检测 取出1.3.1中保存于-80 ℃的血清和小肠组织蛋白样品液,提前在冰水浴中冻融,各取出300 μL,小肠组织蛋白样品液中MDA、SOD水平采用可见分光光度法测定:向各组样品液中加入各步骤相关试剂,以可见分光光度计测定560 nm(SOD)、600 nm(MDA)下的吸光度,计算SOD、MDA含量,具体步骤参照各试剂盒说明书进行。血清DAO水平采用紫外比色法测定:向各组样品液中加入各步骤相关试剂,以全自动生化分析仪测定340 nm波长下的吸光度,计算DAO含量,具体步骤参照试剂盒说明书进行;血清I-FABP、IL-1β、IL-6水平采用ELISA法测定:向包被过的酶标板中加入稀释液和样品液,混匀后37 ℃温育30 min,洗涤后加入酶标试剂温育30 min,再次洗涤后加入显色剂,37 ℃避光显色15 min,加终止液终止反应,测定450 nm波长下的吸光度,计算I-FABP、IL-1β、IL-6含量,具体步骤参照各自试剂盒说明书进行。
1.3.3 小鼠小肠组织RANKL/OPG通路相关蛋白表达检测 1.3.2中剩余的小肠组织蛋白样品液,加入上样缓冲液并于100 ℃下变性,各取含20 μg蛋白的样品液,加入配制好的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS- PAGE)凝胶上样孔中,使用110 V恒定电压电泳后湿转,以5%的脱脂牛奶室温孵育硝酸纤维膜1.5 h,封闭其上转移的蛋白,裁剪膜,分离目的蛋白条带,加入兔源Anti-β-Tubulin一抗、兔源Anti-RANKL一抗、兔源Anti-OPG一抗溶液,4 ℃孵育过夜后以TBST溶液洗膜,室温孵育羊抗兔二抗溶液,2 h后以TBST溶液洗膜,采用增强化学发光法(ECL)显色后以凝胶成像分析仪采集蛋白条带图像,通过Image -Pro plus软件分析各条带灰度值,得出各目的蛋白相对表达量。
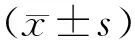
2 结果
2.1 各组小鼠小肠黏膜组织病理变化 假手术组小鼠小肠组织黏膜正常,无病理变化;模型组小鼠小肠黏膜上皮细胞坏死、绒毛破坏、塌陷,组织水肿严重,且有大量炎症细胞浸润,病理损伤最严重;林格液组小鼠小肠黏膜上皮细胞坏死明显,绒毛形态排列紊乱、破坏重、组织充血明显,可见少量炎症细胞浸润,病理损伤次严重;参附注射液低剂量+林格液组小鼠小肠黏膜上皮绒毛膜变钝、黏膜与黏膜下层分离,组织水肿减轻,病理损伤稍减轻;参附注射液中剂量+林格液组小鼠小肠黏膜下间隙扩大,绒毛膜变短,组织稍水肿,病理损伤减轻;参附注射液高剂量+林格液组小鼠小肠黏膜出现间隙,组织稍水肿,病理损伤最轻。见图1。
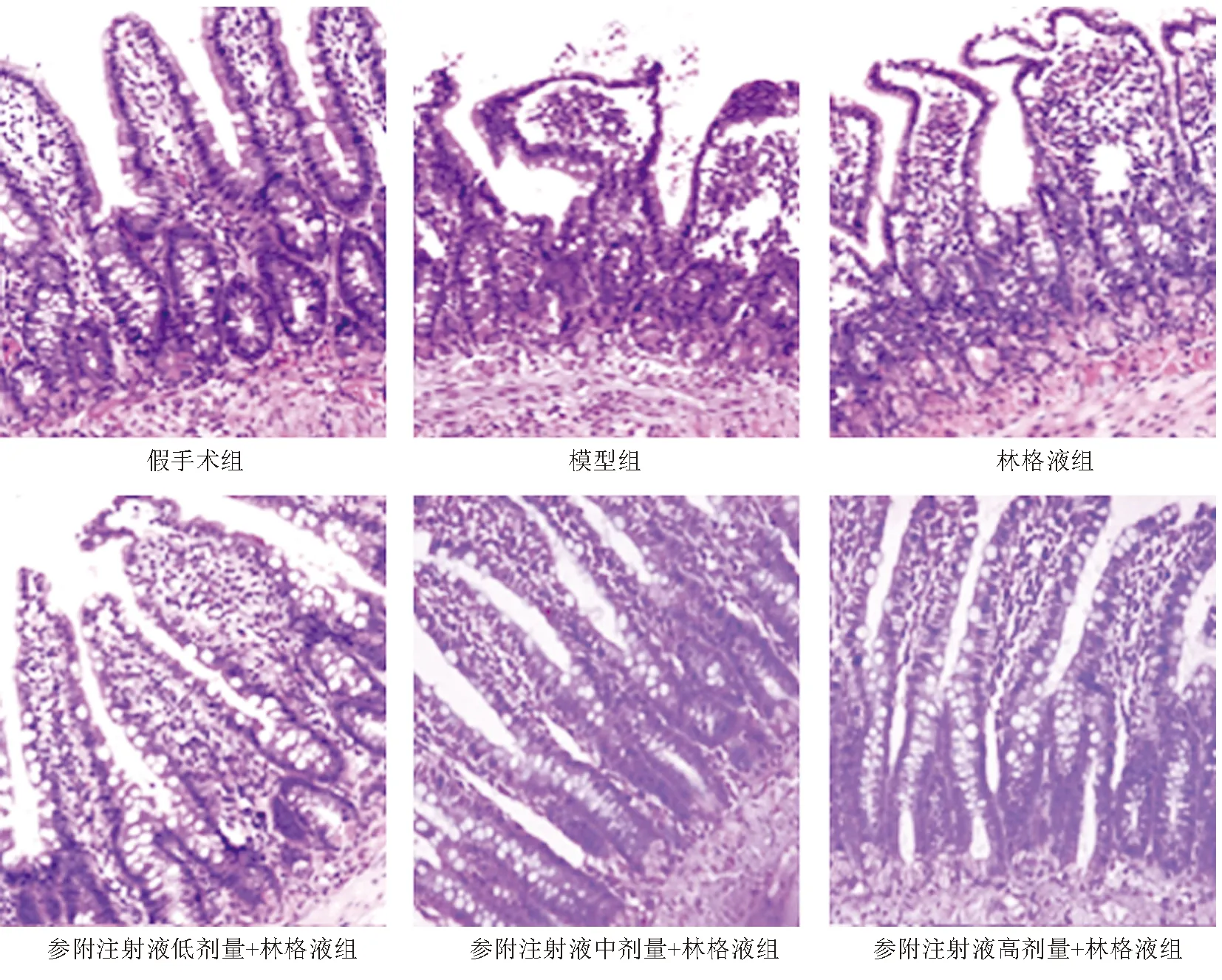
图1 各组小鼠小肠黏膜组织病理变化(HE,×400)
2.2 各组小鼠小肠黏膜Chiu评分比较 见表1。
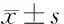
表1 各组小鼠小肠黏膜Chiu评分比较 分,
由表1可见,模型组小鼠小肠黏膜Chiu评分高于假手术组(P<0.05);林格液组、参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠黏膜Chiu评分均低于模型组(P<0.05); 参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠黏膜Chiu评分均低于林格液组(P<0.05);参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠黏膜Chiu评分均低于参附注射液低剂量+林格液组(P<0.05),参附注射液高剂量+林格液组小鼠小肠黏膜Chiu评分低于参附注射液中剂量+林格液组(P<0.05),参附注射液低、中、高剂量+林格液组之间呈剂量依赖性。
2.3 各组小鼠血清DAO、I-FABP水平比较 见表2。
由表2可见,模型组小鼠血清DAO、I-FABP水平均高于假手术组(P<0.05);林格液组、参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠血清DAO、I-FABP水平均低于模型组(P<0.05);参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠血清DAO、I-FABP水平均低于林格液组(P<0.05);参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠血清DAO、I-FABP水平均低于参附注射液低剂量+林格液组(P<0.05),参附注射液高剂量+林格液组小鼠血清DAO、I-FABP水平均低于参附注射液中剂量+林格液组(P<0.05),参附注射液低、中、高剂量+林格液组之间呈剂量依赖性。
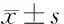
表2 各组小鼠血清DAO、I-FABP水平比较
2.4 各组小鼠小肠组织MDA、SOD水平比较 表3。
表3 各组小鼠小肠组织MDA、SOD水平比较
由表3可见,模型组小鼠小肠组织MDA水平高于假手术组(P<0.05),SOD水平低于假手术组(P<0.05);林格液组、参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠组织MDA水平均低于模型组(P<0.05),SOD水平高于模型组(P<0.05);参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠组织MDA水平均低于林格液组(P<0.05),SOD水平高于林格液组(P<0.05);参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠组织MDA水平均低于参附注射液低剂量+林格液组(P<0.05),SOD水平高于参附注射液低剂量+林格液组(P<0.05);参附注射液高剂量+林格液组小鼠小肠组织MDA水平低于参附注射液中剂量+林格液组(P<0.05),SOD水平高于参附注射液中剂量+林格液组(P<0.05),参附注射液低、中、高剂量+林格液组之间呈剂量依赖性。
2.5 各组小鼠血清IL-1β、IL-6水平比较 见表4。
表4 各组小鼠血清IL-1β、IL-6水平比较
由表4可见,模型组小鼠血清IL-1β、IL-6水平均高于假手术组(P<0.05);林格液组、参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠血清IL-1β、IL-6水平均低于模型组(P<0.05);参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠血清IL-1β、IL-6水平均低于林格液组(P<0.05);参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠血清IL-1β、IL-6水平均低于参附注射液低剂量+林格液组(P<0.05),参附注射液高剂量+林格液组小鼠血清IL-1β、IL-6水平均低于参附注射液中剂量+林格液组(P<0.05),参附注射液低、中、高剂量+林格液组之间呈剂量依赖性。
2.6 各组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平比较 见表5。
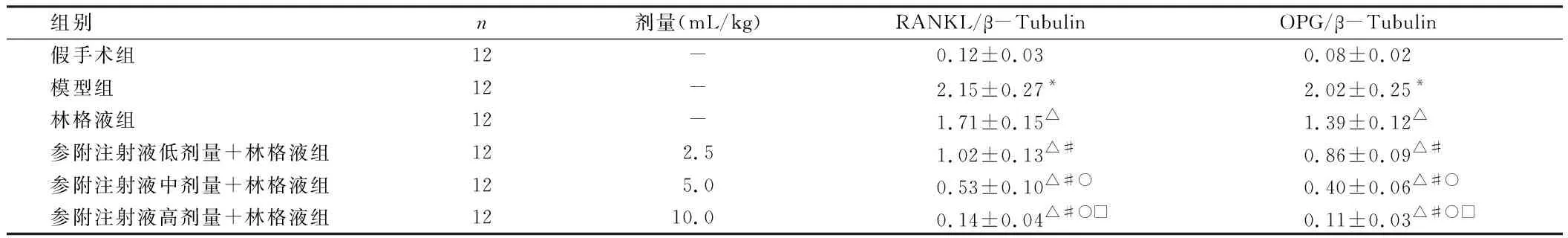
表5 各组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平比较
由表5可见,模型组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平均高于假手术组(P<0.05);林格液组、参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平均低于模型组(P<0.05);参附注射液低剂量+林格液组、参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平均低于林格液组(P<0.05);参附注射液中剂量+林格液组、参附注射液高剂量+林格液组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平均低于参附注射液低剂量+林格液组(P<0.05),参附注射液高剂量+林格液组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达水平均低于参附注射液中剂量+林格液组(P<0.05),参附注射液低、中、高剂量+林格液组之间呈剂量依赖性。各组小鼠小肠组织RANKL/OPG信号通路相关蛋白表达见图2。
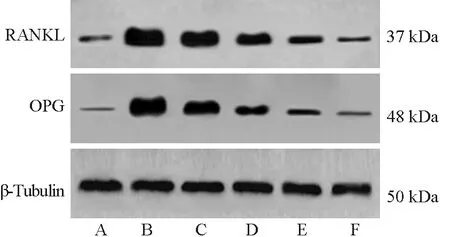
A:假手术组;B:模型组;C:林格液组;D:参附注射液低剂量+林格液组;E:参附注射液中剂量+林格液组;F:参附注射液高剂量+林格液组
3 讨论
HS发生时,机体器官会因大量失血发生缺血缺氧损伤,随后因进行复苏而使血液再灌注,造成组织器官进一步损伤,肠道损伤是HS后的一种主要并发症,可引发全身炎性反应综合征,增加患者死亡率,因此保护肠屏障功能对改善HS患者预后至关重要。缺血再灌注引发的炎性反应和氧化应激损伤是导致肠屏障功能损伤的主要致病机制[13-14]。DAO和I-FABP是肠黏膜组织中的重要蛋白,肠黏膜受损时,可大量进入血液中,因而血清DAO、I-FABP水平可作为判断肠屏障受损程度的标志[15-16]。本实验通过取出小鼠30%的总血容量来建立HS模型,结果显示,小鼠大量失血后,可导致小肠黏膜上皮细胞坏死、数量减少、间隙增大,绒毛破坏、塌陷,排列紊乱,组织充血、水肿,且有大量炎症细胞浸润,病理损伤严重,Chiu评分、血清DAO、I-FABP、IL-1β、IL-6水平及小肠组织MDA水平升高,SOD水平降低,表明大量失血可诱导促炎因子IL-1β、IL-6水平升高,引发炎症和氧化应激反应,造成严重的肠黏膜病理损伤,破坏肠屏障功能,提示HS模型建立成功。
HS属中医学厥脱阳虚诸证,患者表现出病势危急、脉细欲绝、阳气欲脱、心肾阳虚等症状,参附注射液源自明代《校注妇人良方》中的参附汤,具有温阳、固脱、益气功效,对阳虚厥脱诸证有较好疗效,利用现代药物提取技术制成注射液,较传统汤药起效更快,临床中用于HS、急性心力衰竭及心源性猝死等疾病治疗,可降低脓毒症患者氧化应激水平,修复其肠屏障功能[8-9,17],还能明显抑制创伤性心脏骤停复苏引发的炎性反应,减轻肾细胞凋亡,改善肾功能[18]。本实验结果显示,林格液单独应用和参附注射液低、中、高剂量+林格液联合应用复苏HS小鼠,均可减轻肠黏膜病理损伤,降低肠黏膜组织Chiu评分、血清DAO、I-FABP、IL-1β及IL-6水平、小肠组织MDA水平,升高SOD水平,且参附注射液+林格液联合应用较林格液单独应用作用更强,并呈剂量依赖性,表明以林格液复苏HS小鼠,可降低促炎因子表达,抑制炎症,减弱氧化应激,保护肠屏障;在林格液应用的基础上联合参附注射液复苏HS小鼠,可进一步减弱炎症及氧化应激损伤,提高肠屏障保护功能,并随参附注射液剂量升高而作用增强。
RANKL/OPG是骨代谢领域研究的热点信号,参与介导炎性反应的发生及进展,在各种炎性疾病中的调控作用受到越来越多的关注,研究发现,RANKL/OPG信号在炎性肠道疾病中处于激活状态,HS可上调该通路蛋白表达,诱导炎症因子IL-6大量合成释放,引发炎症发生并进展,延缓骨折愈合[7,19-20],但参附注射液对HS小鼠RANKL/OPG通路影响目前还未知。本实验结果显示,HS小鼠小肠组织中RANKL及OPG蛋白表达水平明显升高,林格液单独应用和参附注射液低、中、高剂量+林格液应用处理HS小鼠,均可降低小肠组织RANKL及OPG蛋白表达水平,且参附注射液+林格液应用较林格液单独应用作用更强,并呈剂量依赖性,表明RANKL/OPG信号参与调控HS后肠屏障损伤过程,参附注射液可抑制RANKL/OPG信号通路激活,保护肠屏障功能。
综上所述,参附注射液可下调HS小鼠小肠组织RANKL、OPG蛋白表达,抑制炎性反应发生,降低氧化应激水平,减轻肠黏膜损伤,促使其屏障功能恢复,阻滞RANKL/OPG信号传导可能是其药理机制。本研究进一步证实了参附注射液可减轻HS引发的肠屏障功能损伤,并对其药理机制进行了初步探讨,后续还应对激活并抑制RANKL/OPG信号进行对照验证,以探索更确切的作用机制。
