低共熔溶剂催化合成环氧大豆油工艺研究
2021-11-17杨心雅端木佳辉毛晓锐邱林燕包陈洁韩晓祥修丽丽
杨心雅 端木佳辉 毛晓锐 邱林燕 禹 宸 包陈洁 韩晓祥 修丽丽
(浙江工商大学应用化学系,杭州 310018)
随着矿物资源的日趋枯竭,开展可再生资源的利用备受关注。环氧大豆油是由可再生资源大豆油为原料制备的环境友好产品,具有无毒、能生物降解的特性,同时因与塑料相容性好、光热稳定性高、挥发性低、增塑效果优良等特点而作为增塑剂得到广泛应用[1]。环氧大豆油是唯一可用于食品包装材料的环氧类增塑剂[2]。基于环氧大豆油类相关新产品的开发,使其在聚氨酯工业、环保涂料与油墨、泡沫塑料等[3-5]领域具有广阔应用前景。
环氧大豆油制备工艺主要有溶剂法和非溶剂法两种。其中非溶剂法因操作简便,反应温度低,效率高,副反应少而备受关注,但反应常用有机酸进行催化,催化过程中常存在催化剂分离难、环境污染大等问题。为解决上述问题,各种新型的催化剂或催化方式被开发和应用。如,离子交换树脂,金属氧化物,固体超强酸,杂多酸等[6-10]催化剂的使用,以及酶催化环氧化反应等[11,12]。这些方式虽在一定程度上解决了传统制备过程存在的缺点,但仍存在催化剂制备成本高、效率低、稳定性差等问题。因此,寻找一种高效、经济的催化剂以实现环氧大豆油的绿色合成研究成为研究的热点。
近年来,低共熔溶剂(Deep Eutectic Solvent (DES),亦称低共熔物)由于其制备简单、操作方便,性质可调,且具有无毒,易生物降解的特性而备受关注[13],以其为反应介质主要应用于分离工程、电化学及纳米材料合成等领域[14,15]。低共熔溶剂独特的溶剂性能使其可用作生物催化过程的溶剂[16],作为替代溶剂,具有生产简单,挥发性低,生物相容性好,成本效益高的特点[17]。具有酸性能的低共熔溶剂常作为催化剂代替质子酸参与催化反应中,主要见诸于酯化/转酯化反应[18-20],在催化大豆油环氧化反应中也见诸于文献报道[21,22]。低共熔溶剂催化反应时不仅具有较好的催化性能,同时大大减少环境污染,降低生产成本。本文以转基因大豆油为模型化合物考察了氯化胆碱-甲磺酸低共熔溶剂在大豆油-H2O2环氧化制备环氧大豆油反应中的催化活性,并利用响应面分析法优化工艺条件,为规模化、低成本制备环氧大豆油提供参考。
1 实验部分
1.1 试剂与仪器
氯化胆碱、甲磺酸、乙醇、乙酸、30%过氧化氢、氢氧化钠、盐酸、丙酮等(均为AR)。市售大豆油。
集热式恒温加热磁力搅拌器(DF-103S),SX2-5-12型高温箱形电阻炉,旋转蒸发仪(RE-52A),循环水式真空泵(SHZ-D(Ⅲ))。
1.2 低共熔溶剂的制备
参考文献[18]方法制备氯化胆碱-甲磺酸低共熔溶剂,并以其为催化剂催化制备环氧大豆油。氯化胆碱与甲磺酸摩尔比为1∶3。
1.3 低共熔溶剂催化合成环氧大豆油
在100 mL三颈烧瓶中依次加入一定量的市售大豆油(8 g)、乙酸和催化剂(以大豆油的质量为基准),装上恒压滴液漏斗,打开磁力搅拌器并调整转速为300 r/min,逐滴滴加适量H2O2(以大豆油的质量为基准),同时加热反应。反应结束后,加入30 mL去离子水,乙酸乙酯萃取溶液,合并有机层,有机层用5%碳酸氢钠溶液洗涤,再用热水洗涤至中性,减压蒸除溶剂得环氧大豆油。按照GB/T 1677—2008《增塑剂环氧值的测定》,即盐酸-丙酮法对环氧大豆油环氧值进行测定。
1.4 响应面设计(RSM)[23]
根据单因素试验结果(每组实验重复三次),采用Box-Benhnken中心组合设计,以大豆油环氧值(Y)为响应值,对反应温度(A)、催化剂量(B)、H2O2用量(C)及反应时间(D)进行优化,试验因素水平及编码见表1。

表1 试验因素水平及编码表
1.5 数据处理
采用Origin 8.0 软件进行绘图,采用Design-Expert v6.5 软件进行数据处理、分析。
2 结果与讨论
2.1 反应温度对大豆油环氧化反应的影响
通常情况下,随着反应温度的升高化学反应速度加快。在催化剂量5%,乙酸用量8%, H2O2用量80%(以上均为质量分数,且以大豆油为基准),反应时间4 h 条件下,考察了不同反应温度对环氧大豆油环氧值的影响,结果如图1所示。由图1a可见,当反应温度在55 ℃至75 ℃范围内时,随着反应温度的上升,环氧值呈线性增加。这是因为随着反应温度的升高,反应物分子间运动加剧,分子间有效碰撞频率增加,环氧化反应速率加快,环氧值增加;反应温度为75 ℃时,环氧值最大,为6.08;继续增加反应温度,环氧值下降。过高的反应温度会导致过氧化氢分解速度加快,同时环氧化开环和发生凝胶等副反应速度也加快[24],导致环氧值下降,且过高反应温度条件下合成的环氧大豆油颜色较深。因此,从节约能耗和产物品质的角度出发,选择最佳反应温度为75 ℃。

图1 不同反应因素对大豆油环氧值的影响
2.2 催化剂用量对大豆油环氧化反应的影响
图1b为乙酸用量8%,H2O2用量80%,反应温度75 ℃,反应时间4 h条件下,不同催化剂用量对环氧值的影响。由图可见,当催化剂用量小于4%时,产物环氧值随着催化剂用量的增加而增加;但是当催化剂用量大于4%时,环氧值随着催化剂用量的增加而下降。环氧化反应是酸催化反应,催化剂量增加,参与反应的酸性活性位点增加,环氧化速度加快,产物环氧值增加;当催化剂用量增加到一定程度时,催化剂活性位点达到饱和,继续增加催化剂用量,反应体系的酸性增强,从而加快环氧大豆油开环等副反应发生,使环氧值降低。因此,催化剂用量选用4%较为适宜。
2.3 乙酸用量对大豆油环氧化反应的影响
在催化剂量4%,H2O2用量80%,反应温度75℃,反应时间4 h条件下,乙酸用量对环氧大豆油环氧值的影响如图1c所示。在H2O2催化环氧化制备环氧大豆油反应过程中,反应体系中乙酸的存在起到氧载体的作用,反应开始时,乙酸与H2O2作用形成过氧乙酸,过氧乙酸氧化大豆油双键生成目标产物环氧大豆油。由图可见,随着乙酸用量的增大,产物的环氧值呈线性增加,当乙酸用量超过9%时,环氧值开始下降。环氧化反应是可逆反应,反应物的增加有利于化学平衡向右进行。当乙酸用量较少时,氧化生成过氧乙酸量少,此时反应物浓度较低,环氧化速度较慢,随着乙酸用量的增大,氧化生成过氧乙酸量增加,环氧化速度加快,环氧值提高;而当乙酸用量过大时,体系中酸性增强,从而导致产物开环副反应加剧,使产物环氧值下降。因此,最佳的乙酸用量为9%。
2.4 H2O2用量对大豆油环氧化反应的影响
图1d为氧化剂H2O2用量对环氧大豆油环氧值的影响,其他条件控制为:催化剂量4%,乙酸用量9%,反应温度75℃,反应时间4 h。由图可见,H2O2用量在60%~100%内变化时,大豆油环氧值随着H2O2用量的增加呈现先上升后下降的趋势。当H2O2用量为80%时,大豆油环氧值达到最大值,为6.54;继续增加H2O2用量,大豆油环氧值下降。这是因为随着H2O2用量的增加,氧化产物过氧乙酸含量增加,从而使化学平衡向生成产物方向移动,环氧值提高;而过多的H2O2增加了反应体积,降低了过氧乙酸浓度及催化剂的相对用量,使环氧化反应速率降低,同时产物水解开环成双羟基化合物副反应增加[25],导致环氧值下降。所以,将H2O2用量确定为80%。
2.5 反应时间对大豆油环氧化反应的影响
一般来说,延长反应时间有助于化学反应的进行。在催化剂用量4%,乙酸用量9%,H2O2用量80%,反应温度75 ℃条件下,考察反应时间对大豆油环氧化反应的影响,结果如图1e所示。由图可见,反应4 h内,环氧大豆油环氧值随着反应时间的增加而增加,延长反应时间至5 h时,环氧值变化不明显,进一步延长反应时间,环氧值降低。大豆油环氧化反应过程中,环氧化反应与开环反应是同时存在的竞争性反应,反应初期,环氧化物质浓度较低,环氧化反应速度较开环副反应速度快,所以环氧值随着反应时间的增加而增加;随着反应进行,即反应时间为4 h时,此时环氧化产物浓度较高,大豆油环氧化反应与开环副反应速度相当,反应达到平衡,环氧值随反应的延长变化不明显;继续延长反应时间,开环副反应速度大于环氧化反应速度,导致产物环氧值下降。因此,从反应速率和产物环氧值考虑,将反应时间选为4 h为宜。
2.6 RSM响应面分析法
2.6.1 响应面试验结果
在上述实验的基础上,选择对大豆油环氧值影响较大的四个因素,即反应温度(A)、催化剂用量(B)、H2O2用量(C)和反应时间(D)为自变量,环氧值为响应值,采用四因素三水平响应面分析法优化大豆油环氧化反应工艺条件,响应面试验设计方案及相应的实验结果见表2。

表2 响应面设计及产率结果
2.6.2 响应面模型分析
为直观地展现出不同反应参数与大豆油环氧值之间的关系,本研究运用 Design-Expert v6.5 软件,对表2中数据进行二次项拟合,得到的二次回归方程为:
Y=+6.54-0.29A+0.21B-0.69C-0.24D-0.36A2-0.18B2-0.43C2-0.27D2+ 0.093AB+0.077AC+0.095AD-0.078BC-0.097BD-0.15CD
二次回归方程的拟合系数R2和AdjR2分别为0.990 4和0.980 8,其值均与1接近,说明模型可靠,实验值与预测值之间无明显差异。
表3是由表2中实验结果得到的方差分析,以此来评估该预测模型的显著性以及不同反应参数对大豆油环氧值的影响。由表3可见,模型的F值为103.33,远小于分布表中的F值,P值小于0.000 1,失拟项为0.11,表明该模型显著,拟合效果较好。变异系数(CV)也是衡量实验模型合理性的一个重要参数,可以用来判断平均值的偏离情况,本实验模型的CV值为1.39%≪15%;此外,标准偏差(Std.Dev.)为0.084,且Adeq Precision值为35.889≫4,说明本实验具有良好的重复性和精确度。综上可知,该回归模型可准确预测不同反应参数对大豆油环氧值的影响。
根据方差分析表的P值可知,A、B、C、D四个因素及其二次项均对大豆油环氧值产生极显著的影响(P≪0.01)。反应温度和H2O2用量、反应时间之间的交互作用对大豆油环氧值影响不显著(P>0.05),而H2O2用量和反应时间交互作用则对大豆油环氧值产生极显著的影响,同时,反应温度和催化剂用量、反应温度与反应时间、催化剂量与反应时间均对大豆油环氧值产生显著的影响(0.01 表3 方差分析表 以低共熔溶剂为催化剂催化大豆油制备环氧大豆油的反应中,环氧值受多种因素的共同影响,根据回归模型分析得到制备环氧大豆油的最佳工艺条件为:反应温度72.75 ℃,催化剂量4.79%,H2O2用量为71.63%,反应时间3.56 h,乙酸用量9%,在此条件下环氧大豆油环氧值为7.03。为了便于实验操作,将上述反应条件修正为:反应温度73 ℃,催化剂量4.8%,H2O2用量为72%,反应时间3.6 h,乙酸用量9%,在此最佳条件下平行3次实验,所得大豆油环氧值的平均值为6.98。此结果与理论预测值大致相同,表明该回归模型能够说明不同因素对大豆油环氧值的影响。 氯化胆碱-甲磺酸低共熔溶剂在催化大豆油环氧化反应过程中具有较好的催化性能,随着反应温度的升高,催化剂用量、乙酸用量和过氧化氢用量的增加及反应时间的延长,环氧大豆油环氧值呈先增加后下降的趋势;以低共熔溶剂为催化剂,通过响应面分析法优化得到环氧大豆油合成的最佳工艺条件为:大豆油用量8 g,反应温度73 ℃,催化剂量4.8%,H2O2用量为72%,反应时间3.6 h,乙酸用量9%,在此条件下,环氧大豆油的环氧值为6.98。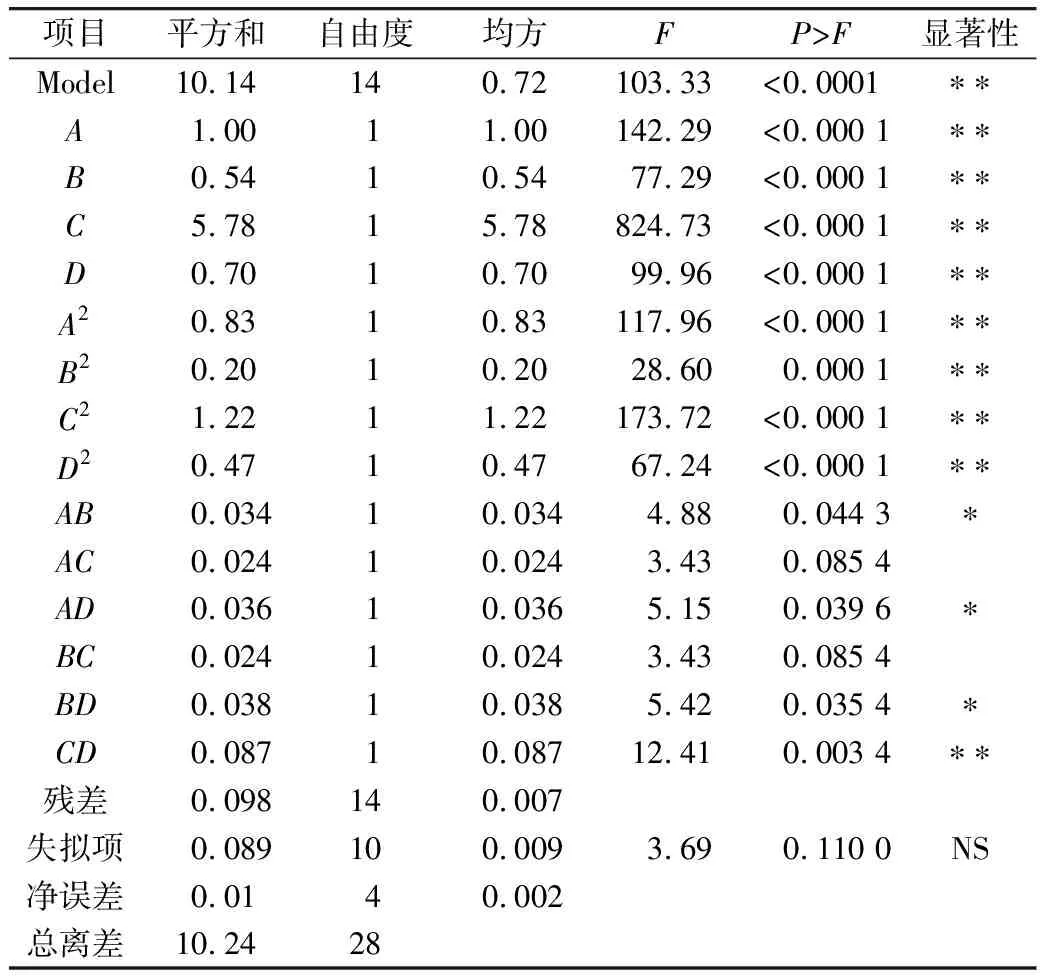
3 结论
