猪源大肠埃希菌中质粒介导喹诺酮耐药(PMQR)基因的多样性研究
2021-11-16郭晶晶侯思梦刘连杰刘晓强
郭晶晶,侯思梦,刘连杰,邱 芳,刘晓强
(西北农林科技大学 动物医学院,陕西杨凌 712100)
大肠埃希菌是人和动物的肠道共生菌,也是一种条件致病菌,能引起温血动物的腹泻,主要表现肠炎、肠毒血症等多种临床症状。猪大肠埃希病是养猪场最常见的细菌病之一,发病率和死亡率都较高,猪场一旦有发生就很难根除,给养猪业造成严重的经济损失[1]。使用抗菌药物一直是养殖场控制细菌性疾病的重要手段,但是致病菌和内源性微生物的耐药性选择压力在过度使用或滥用抗菌药物的背景下不断增大,造成耐药菌株在世界范围内广泛流行,且多重耐药菌甚至超级耐药菌时有报道,部分多重耐药株可耐 12 种抗生素[2]。耐药菌的产生和扩散不仅在很大程度上造成动物疫病防控难度加大,给养殖业造成巨大损失,也给食品安全和公共卫生安全带来潜在威胁[3]。
氟喹诺酮类药物是一类广谱、高效的化学合成类抗菌药物,在人医临床和动物临床实践中均发挥着重要作用[4-5]。然而,随着此类药物的广泛使用,不规范用药甚至滥用频现,导致人类、动物及环境细菌耐药性不断增强。近些年的研究[6-8]显示,大肠埃希菌对氟喹诺酮类药物的耐药情况越来越严重。其耐药机制主要包括喹诺酮类耐药决定区(Quinolone resistance determining region, QRDR)靶基因突变、质粒介导喹诺酮类耐药(Plasmid mediated quinolone resistance,PMQR)基因、膜通透性下降以及药物主动外排[9]。其中,PMQR基因可以介导耐药性的水平传播,并造成严重的公共卫生问题而受到越来越多的社会关注。耐药基因位于质粒上使得耐药基因在不同细菌间可以水平传播,提高了耐药基因的转移率,使耐药性菌株更易产生,而且这些基因可通过接合转移导致细菌出现多重耐药,这对临床感染的控制提出了更高的要求,极大地增加了治疗难度[10]。研究显示,PMQR基因在医院、动物甚至食品源均有检出,且在动物源有极高的检出率[11]。目前,对于陕西地区关于猪源大肠埃希菌PMQR基因的报道较少,本研究从陕西关中部分猪场采集肛拭子,分离鉴定大肠埃希菌。在药敏试验的基础上,利用PCR扩增检测耐氟喹诺酮类药物的菌株中PMQR基因的种类及流行情况,同时利用PCR扩增和测序分析PMQR阳性菌株的QRDR突变情况,为耐药性监测和猪场合理用药提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 样品采集 2017年4月-2018年11月,选取陕西关中地区不同的猪场,调查各猪场发病情况以及用药情况。使用无菌棉拭子在生理盐水中浸湿,插入待采样仔猪的肛门2~3 cm,用棉拭子在肛门内轻轻擦涂,然后将拭子放入盛有生理盐水的无菌离心管,再将无菌离心管放入0~4 ℃采样箱带回实验室,4 h内进行大肠埃希菌的分离。每个肛门拭子样品不能重复。
1.1.2 药品与试剂 抗菌药物阿莫西林、头孢噻呋、阿米卡星、氟苯尼考、环丙沙星、恩诺沙星、土霉素、替米考星购自大连美伦生物科技有限公司;普多沙星购自美国拜耳动物保健品有限公司;美罗培南购自陕西标普医药科技有限公司。麦康凯培养基、伊红美蓝培养基、LB培养基和MH培养基购自北京索莱宝科技有限公司;PCR 相关试剂均购自上海生工生物工程有限公司。
1.1.3 仪器 超净工作台(上海苏净净化有限公司);电热恒温培养箱(北京科伟永兴仪器有限公司产品);PCR仪(美国BIO-RAD);水平电泳槽(北京六一仪器厂);凝胶成像分析系统(北京元业伯乐科技发展有限公司);压力蒸汽灭菌器(上海博迅实业有限公司)。
1.2 方 法
1.2.1 大肠埃希菌的分离、鉴定 参照参考文献[12]的方法。将样品稀释并涂布至麦康凯培养板上,37 ℃培养24 h,然后挑取粉红色菌落接种于伊红美蓝培养基,37 ℃培养18~24 h,进一步分离和纯化,最后使用16S rRNA基因序列分析进行分子生物学鉴定。鉴定好的大肠埃希菌-80 ℃保存,备用。
1.2.2 药敏试验 按照CLSL推荐的微量稀释法[13],测定470株受试大肠埃希菌对6类10种抗菌药物的最小抑菌浓度(MIC),大肠埃希菌ATCC 25922为质控菌。依据CLSL的抗菌药物敏感性标准判定各菌株的敏感度,以敏感(S)、中介(I)和耐药(R)进行判定,对3类或3类以上抗菌药物同时耐药的菌株判定为多重耐药菌。同时统计分析受试菌对受试药物的耐药率、MIC50和MIC90。
1.2.3PMQR基因及QRDR突变检测 选取受试菌中对氟喹诺酮类药物耐药的菌株,提取DNA,PCR扩增检测耐氟喹诺酮类的菌株中6种PMQR基因片段(qnrA、qnrB、qnrS、qnrD、aac(6′)-Ib-cr、qepA)的流行情况。PMG 252、PMG 298、PMG 306和J7261205为阳性对照菌株。对于PMQR基因阳性菌株,PCR扩增并测序分析其编码DNA促旋酶的gyrA基因和拓扑异构酶Ⅳ的parC基因。相关引物由上海生工生物工程有限公司合成(表1)。
PCR反应体系为12.5 μL,包括ddH2O 4.5 μL、2×PCR Master 6 μL、上下游引物各0.5 μL、模板1 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸1 min,30个循环;72 ℃ 延伸5 min。PCR扩增产物经10 g/L琼脂糖凝胶电泳后使用凝胶成像分析系统观察结果。

表1 PCR引物序列
2 结果与分析
2.1 大肠埃希菌的分离鉴定结果
肛拭子采集的样品经分离培养基鉴别、革兰氏染色镜检和16S rRNA测序分析,共获得470株大肠埃希菌。
2.2 药敏试验结果
由表2可知,470株受试菌株对阿莫西林和土霉素的耐药性最为严重,耐药率达100%和 98.51%,其次为恩诺沙星、阿米卡星、环丙沙星、普多沙星、氟苯尼考、替米考星和头孢噻呋的耐药率分别达89.58%、60.64%、56.80%、57.66%、52.98%、50.85%和44.47%。没有发现对美罗培南耐药的菌株,但值得注意的是,9株大肠埃希菌对美罗培南的敏感性为中介。在470株受试大肠埃希菌中,89.58%为多重耐药菌株。
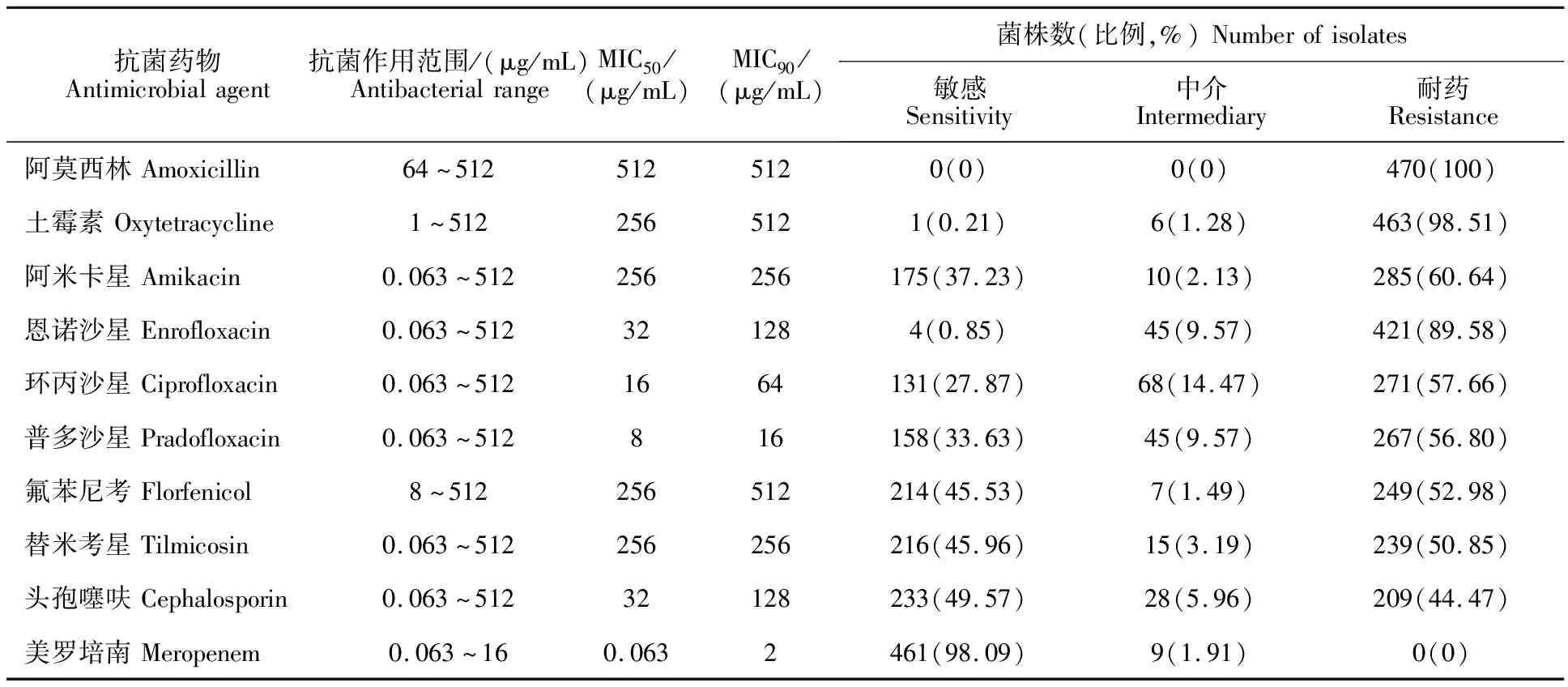
表2 470株猪源大肠埃希菌的耐药性
进一步的分析表明,阿莫西林的MIC50达512 μg/mL,阿米卡星、氟苯尼考、土霉素、替米考星的MIC50达256 μg/mL。3种氟喹诺酮类药物和头孢噻呋的MIC50相对较低,为8~32 μg/mL,美罗培南的MIC50最低,为0.063 μg/mL。
2.3 PMQR的流行性及QRDR突变分析
采用特异性引物,通过PCR扩增,对所有耐氟喹诺酮类药物的菌株的6个PMQR基因的流行情况和QRDR突变进行检测分析,结果见表3。对恩诺沙星、环丙沙星和普多沙星耐药的421株大肠埃希菌中共有282株携带PMQR基因,其中qnrS基因的检出率最高,为50%,aac(6′)-Ib-cr、qnrB、qnrA、qnrD和qepA基因的检出率分别为36.52%、30.14%、17.38%、11.45%和 2.49%。55.30%(156/282)的菌株携带有1种PMQR基因,37.90%(107/282)携带有2种PMQR基因,6.40%(18/282)携带有3种PMQR基因,1(0.35%)株携带有4种PMQR基因,且所有携带PMQR基因的菌株均为多重耐药菌株。在282株携带PMQR基因的菌株中,279(98.90%)株检测到QRDR突变,其中以gyrA基因83位氨基酸突变(Ser83Leu)为主,同时部分菌株出现87位氨基酸突变(Asp87Asn),132(46.80%)株携带PMQR基因的菌株的parC基因发生1个位点(Ser80Ile)或2个位点(Ser80Ile+ Glu84Val)突变,且发生parC基因突变的菌株均伴有gyrA基因的单位点或双位点突变。此外,随着菌株所携带PMQR基因的增多,gyrA和parC基因的突变位点也相应增加,如部分携带3个PMQR基因的菌株出现3个突变位点(Ser83Leu,Asp87Asn,Ser80Ile)或4个突变位点(Ser83Leu,Asp87Asn,Ser80Ile和Glu84Val)。

表3 猪源大肠埃希菌PMQR基因及QRDR突变检测结果
3 讨 论
本研究结果表明,陕西关中地区某些猪场分离的大肠埃希菌对临床常用药物已经产生较为严重的耐药性,对氟喹诺酮类药物恩诺沙星、环丙沙星和普多沙星的耐药率也超过55%,其中对恩诺沙星的耐药率最高,接近90%。另外,多重耐药菌高达89.58%。多重耐药菌比例的不断增大以及多重耐药菌的广泛传播,会极大地威胁养殖业的健康发展和公共卫生安全。药敏试验结果提示,大肠埃希菌对阿莫西林和土霉素均存在严重的耐药性。而在受试的3种氟喹诺酮类药物中,恩诺沙星的耐药性高达89.50%,可能是恩诺沙星作为一种动物专用氟喹诺酮类药物在临床使用较为频繁所导致,而普多沙星是一种近些年才上市的新型动物专用氟喹诺酮类药物,尚未获批用于食品动物,但其耐药性已接近环丙沙星,阿米卡星、氟苯尼考、环丙沙星和替米考星的耐药性则趋于严重,在临床使用中应引起重视。本研究受试菌株对美罗培南仍然保持较高的敏感率,美罗培南作为一种碳青霉烯酶抗生素,并未获批广泛用于食品动物,然而,有9株受试菌对其敏感性明显下降,已处于中介,临床上要引起足够重视。
大量研究表明,PMQR基因通常位于大小不等的可接合质粒上,其耐药机制主要包括,qnr基因调控DNA解旋酶活性机制,aac(6′)-Ib-cr基因编码乙酰基转移酶修饰喹诺酮类机制以及qepA介导蛋白质主动外排机制[11]。本研究结果显示,对氟喹诺酮类药物耐药的菌株中,qnrS、aac(6′)-Ib-cr、qnrB、qnrA、qnrD和qepA基因的检出率分别为50%、36.52%、30.14%、17.38%、11.35%和2.49%。可以看出,PMQR基因在此次采集的猪场的试验样本中种类较多,且流行广泛。PMQR基因存在地域差异,在同一区域内不同养殖场或不同种属动物的流行也有差异。王丽娟等[6]发现在陕西牛源大肠埃希菌中也以qnrS和aac(6′)-Ib-cr最为流行,但是未检测到qnrA、qnrD和qepA基因。杨艳丽等[14]在研究中发现新疆地区牛源大肠埃希菌中主要携带qnrA、qnrS和aac(6′)-Ib-cr3种耐药基因,以qnrA基因(12.07%)检出率最高。田亚凯[15]发现犬源大肠埃希菌主要携带oqxA、oqxB和qnrS3种耐药基因,其中qnrS基因(14.70%)最为流行。坤清芳等[16]报道四川省兔源大肠埃希菌中aac(6′)-Ib-cr检出率最高,达80.4%,其他PMQR基因qnrD、qnrS、oqxA和oqxB检出率也较高,分别达59.8%、59.8%、63.9%和51.5%。Oliveira等[17]在排放的废水和重复使用的废水中都检测到高浓度的qnr基因。此外,国内外医院的人源样品中,PMQR基因也都有较高的检出率[18-22]。由此可见,PMQR基因广泛存在于各种动物、人体以及环境中。然而,PMQR基因的种类及数量随着地区、样品来源的不同而具有较大差异,这可能与不同地区抗菌药物的用药背景、饲养环境、以及种属体质的不同有关。实际上,大肠埃希菌对喹诺酮类药物耐药的最主要机制是QRDR突变,且突变位点数量与耐药水平呈正相关。本研究中421株对氟喹诺酮类药物耐药的菌株中,有282株携带有PMQR基因,说明还存在其他机制。同时98.90%的PMQR阳性菌株发生QRDR突变,且靶基因gyrA和parC的突变位点数目与PMQR的数目以及耐药水平之间存在关联。虽然PMQR基因的出现并不是细菌对喹诺酮类药物耐药的决定因素,但其可以提高耐药水平,并通过质粒介导而在不同种属菌株水平传播,从而加速耐药性的传播和蔓延。然而,菌株中QRDR靶基因突变和获得PMQR基因的先后顺序会影响耐药性的发展,如果菌株发生靶基因突变再捕获PMQR基因,可迅速促进耐药的发展[23]。
PMQR基因的多样性、快速的水平传播能力及其和QRDR之间可能存在协同作用,增加了临床使用氟喹诺酮类药物治疗的不确定性。同时,应不断增强对多重耐药菌的防控意识,加强PMQR耐药基因和QRDR突变的检测,合理选择抗菌药物并合理联合用药,对于预防并控制耐药基因的传播具有重要意义。此外,及时处理舍内粪便,提高饲养管理水平,也有助于减缓、防止多重耐药情况的发生。
