葛根芩连汤治疗2 型糖尿病合并非酒精性脂肪性肝病效果的临床研究
2021-11-15范尧夫曹琳孙洪平许娟包薇萍褚晓秋
范尧夫,曹琳,孙洪平,许娟,包薇萍,褚晓秋
非酒精性脂肪性肝病(NAFLD)是指除饮酒及其他肝损害因素外所致的肝实质细胞脂肪变性及沉积,疾病谱包括从单纯性肝脂肪变性到非酒精性脂肪性肝炎(NASH)、肝纤维化和肝硬化,甚至演变为肝癌[1-2]。随着全球肥胖的流行,NAFLD 的发病率不断上升,现已成为世界范围内最常见的慢性肝病。一项前瞻性调查研究发现,糖尿病患者中NAFLD 及肝癌的发病率是非糖尿病患者的2 倍[3]。越来越多的证据证实,2 型糖尿病(T2DM)与NAFLD 发病密切相关,一方面T2DM会加速NAFLD 的不良结局,使其进展为NASH、肝纤维化、肝癌,增加肝脏相关死亡率[4-5];另一方面NAFLD 会加重胰岛素抵抗(IR),影响机体糖脂代谢,致使T2DM 患者心血管事件发生率显著增加[6-7]。目前临床上针对T2DM 合并NAFLD 的认识不足、重视程度不够,加上缺乏有效的药物,常导致临床诊疗延误。现代医学对于本病的治疗以改善IR、减重降脂、抗氧化为原则,主要采用降糖药物联合保肝药物,但疗效并不显著。
2017 年,中医药治疗糖尿病首次被写进《中国2型糖尿病防治指南(2017 年版)》[8],其中葛根芩连汤作为治疗T2DM 的经典方剂被纳入。本课题组前期研究结果表明,葛根芩连汤治疗T2DM 临床效果显著,并能缓解IR、抑制胰岛素受体降解,恢复胰岛素信号转导通路[9-10]。但葛根芩连汤能否有效治疗T2DM 合并NAFLD 尚不明确。研究证实,IR、炎性反应和免疫系统的激活均会引起T2DM 合并NAFLD 的发展[11-12]。本研究以免疫功能、血糖、血脂以及肝脏彩色超声评分为疗效评定指标,探讨葛根芩连汤对T2DM 合并NAFLD 患者的临床疗效,旨在为葛根芩连汤治疗该病的临床应用提供理论依据。
1 资料与方法
1.1 一般资料 选取2020 年1 月至2021 年3 月就诊于南京中医药大学附属中西医结合医院的T2DM 合并NAFLD 患者100 例,其均为湿热证。采用随机数字表法将患者分为观察组和对照组,随机数字的保管由非本研究组成员负责,以保证随机分配的隐匿性与正确实施,其中观察组49 例,对照组51 例。本研究经南京中医药大学附属中西医结合医院伦理委员会审查批准(伦理号:2020LWKYZ028-01)。
1.2 纳入与排除标准 纳入标准:(1)符合《中国2型糖尿病防治指南(2017 年版)》[8]中关于T2DM 的诊断标准;(2)符合《非酒精性脂肪性肝病防治指南(2018 年更新版)》[13]中关于NAFLD 的诊断标准;(3)年龄18~70 岁;(4)患者充分了解治疗方案可能带来的益处和风险,自愿参与,签署知情同意书。排除标准:(1)1 型糖尿病、特殊类型糖尿病、合并急性并发症或严重慢性并发症的T2DM;(2)明确诊断为病毒性肝病、药物性肝炎、酒精性肝病以及其他明确病因的肝脏疾病;(3)存在严重肝肾功能不全、急性心脑血管意外、血液系统或其他全身系统性疾病;(4)处于妊娠期及哺乳期;(5)近3 个月参加其他药物临床研究;(6)合并精神疾病患者。
1.3 中止标准 (1)治疗过程中出现糖尿病急性并发症,如乳酸酸中毒、糖尿病酮症酸中毒、高渗性高血糖状态及严重的低血糖;(2)血糖控制较差〔空腹血糖(FPG)持续3 d ≥9 mmol/L,餐后2 h 血糖(2 hPG)持续3 d ≥16.7 mmol/L〕;(3)因药物引起严重的不良反应,如恶心、呕吐、腹泻等;(4)研究过程中主动要求退出试验。
1.4 剔除和脱落标准 (1)依从性差,未规律接受治疗者;(2)自行退出研究者;(3)因出现不良事件而不宜继续治疗者;(4)失访者。
1.5 治疗方法 参照《中国2 型糖尿病防治指南(2017 年版)》[8],对照组给予常规治疗,包括健康教育、饮食运动指导、控制热量摄入、降糖、降压、降脂等;其中降糖药物采用吡格列酮二甲双胍片(江苏德源药业股份有限公司,国药准字H20110005,规格:15 mg∶500 mg),2 次/d,1 粒/ 次;降 压 药 物涉及缬沙坦胶囊(北京诺华制药有限公司,国药准字H20040217)、厄贝沙坦片〔赛诺菲(杭州)制药有限公司,国药准字J20171089〕、苯磺酸左氨氯地平片〔施慧达药业集团(吉林)有限公司,国药准字H19991083〕、硝苯地平控释片(拜耳医药保健有限公司,国药准字J20180025);降脂药物采用瑞舒伐他汀钙片(南京正大天晴制药有限公司,国药准字H20080670,规格:10 mg),1 次/d,1 粒/次,睡前口服。
观察组在对照组治疗基础上加用葛根芩连汤(组方:
葛根30 g、黄芩15 g、黄连10 g、炙甘草6 g,药物饮片由医院中药房统一提供,经鉴定符合临床用药标准。采用煎药机以常规水煎煮2 次,混合药液)口服治疗,1 剂/d,煎煮400 ml,分早晚温服。两组疗程均为8 周。

1.7 统计学方法 采用SPSS 22.0 软件进行统计学分析,计量资料以(±s)表示,两组间比较采用两独立样本t 检验,组内治疗前后比较采用配对样本t 检验;计数资料以相对数表示,两组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组病例剔除和脱落情况 研究过程中观察组脱落4 例(其中2 例放弃继续中药治疗,1 例出院后失访,1 例出现低血糖而退出研究),最终完成45 例;对照组脱落6 例(其中3 例因血糖明显异常改为胰岛素降糖治疗,2 例出院后失访,1 例出现脑卒中而退出研究),最终完成45 例。两组患者性别、年龄、病程、体质量、高血压发生率比较,差异无统计学意义(P>0.05),见表1。
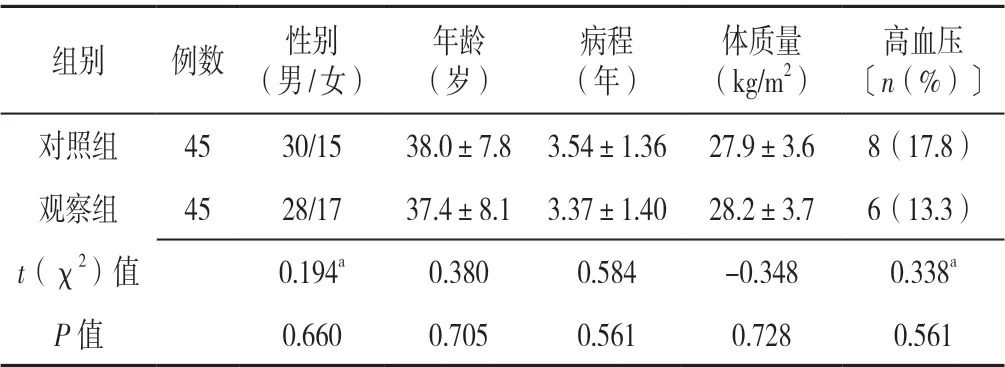
表1 两组患者一般资料比较Table 1 Comparison of general information between control and observation groups
2.2 两组患者中医证候积分比较 治疗前,两组患者中医证候积分比较,差异无统计学意义(P>0.05)。治疗后,观察组中医证候积分低于对照组,差异有统计学意义(P<0.05)。两组治疗后中医证候积分均低于同组治疗前,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后中医证候积分比较(±s,分)Table 2 Comparison of mean scores of TCM syndromes in two groups before and after treatment
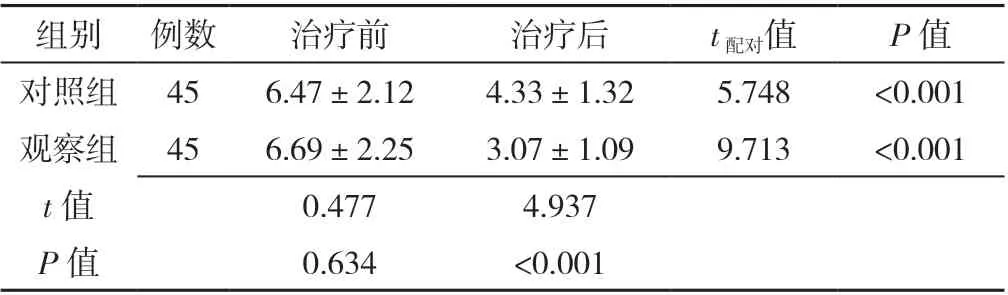
表2 两组患者治疗前后中医证候积分比较(±s,分)Table 2 Comparison of mean scores of TCM syndromes in two groups before and after treatment
组别 例数 治疗前 治疗后 t配对值 P 值对照组 45 6.47±2.12 4.33±1.32 5.748 <0.001观察组 45 6.69±2.25 3.07±1.09 9.713 <0.001 t 值 0.477 4.937 P 值 0.634 <0.001
2.3 两组患者糖脂代谢指标比较 治疗前,两组患者FPG、2 hPG、HbA1c、TG、TC、LDL-C、HOMA-IR 比较,差异均无统计学意义(P>0.05)。治疗后,两组患者HbA1c、TC 水平比较,差异均无统计学意义(P>0.05)。治疗后,观察组FPG、2 hPG、TG、LDL-C、HOMA-IR低于对照组,差异均有统计学意义(P<0.05)。两组治疗 后FPG、2 hPG、HbA1c、TG、TC、LDL-C、HOMAIR 均低于同组治疗前,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后糖脂代谢指标比较(±s)Table 3 Comparison of mean levels of glycolipid metabolism indices in two groups before and after treatment
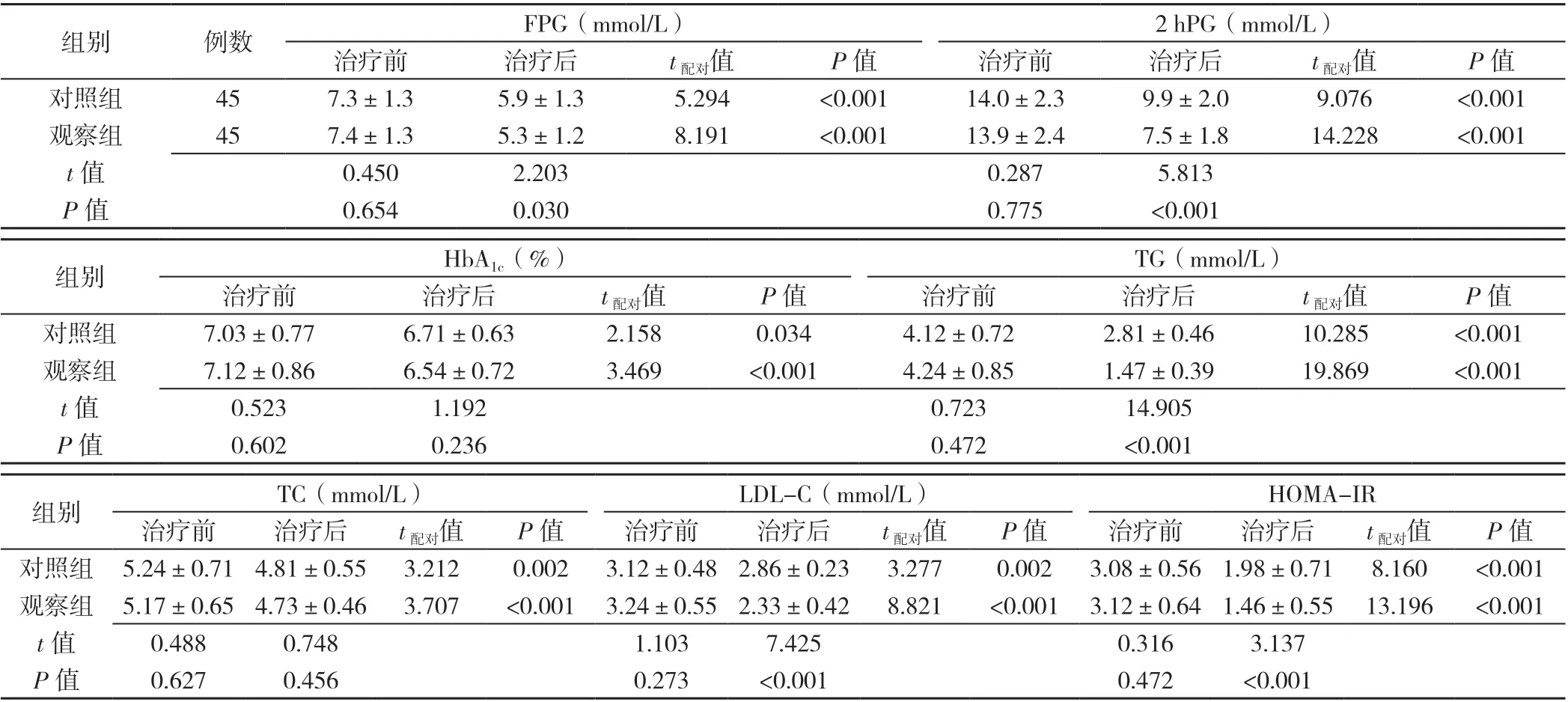
表3 两组患者治疗前后糖脂代谢指标比较(±s)Table 3 Comparison of mean levels of glycolipid metabolism indices in two groups before and after treatment
注:FPG=空腹血糖,2 hPG=餐后2 h 血糖,HbA1c=糖化血红蛋白,TG=三酰甘油,TC=总胆固醇,LDL-C=低密度脂蛋白胆固醇,HOMA-IR=稳态模型评估胰岛素抵抗指数
组别 例数 FPG(mmol/L) 2 hPG(mmol/L)治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值对照组 45 7.3±1.3 5.9±1.3 5.294 <0.001 14.0±2.3 9.9±2.0 9.076 <0.001观察组 45 7.4±1.3 5.3±1.2 8.191 <0.001 13.9±2.4 7.5±1.8 14.228 <0.001 t 值 0.450 2.203 0.287 5.813 P 值 0.654 0.030 0.775 <0.001组别 HbA1c(%) TG(mmol/L)治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值对照组 7.03±0.77 6.71±0.63 2.158 0.034 4.12±0.72 2.81±0.46 10.285 <0.001观察组 7.12±0.86 6.54±0.72 3.469 <0.001 4.24±0.85 1.47±0.39 19.869 <0.001 t 值 0.523 1.192 0.723 14.905 P 值 0.602 0.236 0.472 <0.001组别 TC(mmol/L) LDL-C(mmol/L) HOMA-IR治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值对照组 5.24±0.71 4.81±0.55 3.212 0.002 3.12±0.48 2.86±0.23 3.277 0.002 3.08±0.56 1.98±0.71 8.160 <0.001观察组 5.17±0.65 4.73±0.46 3.707 <0.001 3.24±0.55 2.33±0.42 8.821 <0.001 3.12±0.64 1.46±0.55 13.196 <0.001 t 值 0.488 0.748 1.103 7.425 0.316 3.137 P 值 0.627 0.456 0.273 <0.001 0.472 <0.001
2.4 两组患者肝功能比较 治疗前,两组患者ALT、AST、GGT比较,差异均无统计学意义(P>0.05)。治疗后,观察组ALT、AST、GGT 水平低于对照组,差异均有统计学意义(P<0.05)。两组治疗后ALT、AST、GGT 水平均低于同组治疗前,差异有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后肝功能指标比较(±s)Table 4 Comparison of mean levels of liver function markers in two groups before and after treatment
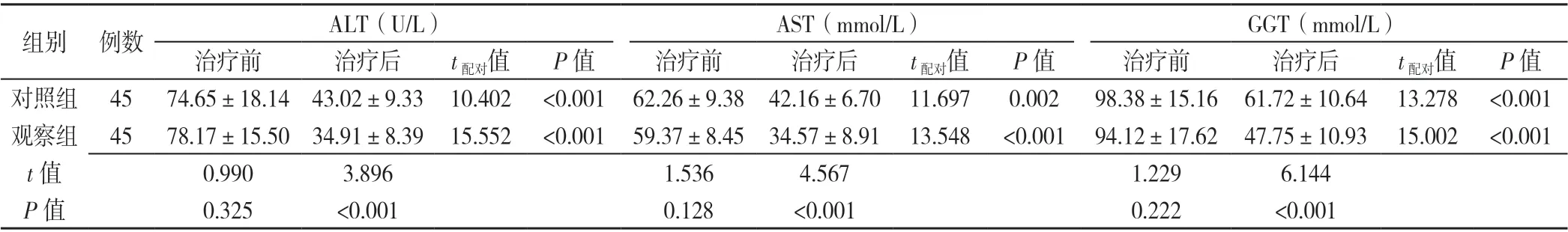
表4 两组患者治疗前后肝功能指标比较(±s)Table 4 Comparison of mean levels of liver function markers in two groups before and after treatment
注:ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,GGT=谷氨酰转肽酶
组别 例数 ALT(U/L) AST(mmol/L) GGT(mmol/L)治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值对照组 45 74.65±18.14 43.02±9.33 10.402 <0.001 62.26±9.38 42.16±6.70 11.697 0.002 98.38±15.16 61.72±10.64 13.278 <0.001观察组 45 78.17±15.50 34.91±8.39 15.552 <0.001 59.37±8.45 34.57±8.91 13.548 <0.001 94.12±17.62 47.75±10.93 15.002 <0.001 t 值 0.990 3.896 1.536 4.567 1.229 6.144 P 值 0.325 <0.001 0.128 <0.001 0.222 <0.001


表5 两组患者治疗前后免疫功能指标比较(±s)Table 5 Comparison of mean levels of immune function markers in two groups before and after treatment
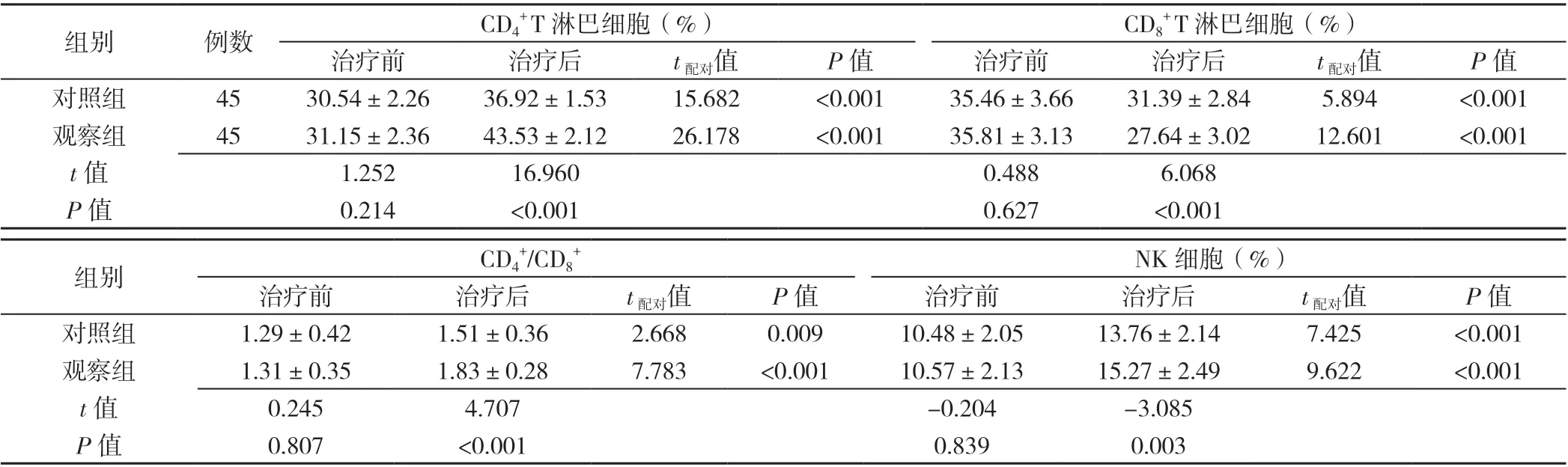
表5 两组患者治疗前后免疫功能指标比较(±s)Table 5 Comparison of mean levels of immune function markers in two groups before and after treatment
注:NK 细胞=自然杀伤细胞
+ T 淋巴细胞(%)治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值对照组 45 30.54±2.26 36.92±1.53 15.682 <0.001 35.46±3.66 31.39±2.84 5.894 <0.001观察组 45 31.15±2.36 43.53±2.12 26.178 <0.001 35.81±3.13 27.64±3.02 12.601 <0.001 t 值 1.252 16.960 0.488 6.068 P 值 0.214 <0.001 0.627 <0.001组别 例数 CD4+ T 淋巴细胞(%) CD8组别 CD4+/CD8+ NK 细胞(%)治疗前 治疗后 t配对值 P 值 治疗前 治疗后 t配对值 P 值对照组 1.29±0.42 1.51±0.36 2.668 0.009 10.48±2.05 13.76±2.14 7.425 <0.001观察组 1.31±0.35 1.83±0.28 7.783 <0.001 10.57±2.13 15.27±2.49 9.622 <0.001 t 值 0.245 4.707 -0.204 -3.085 P 值 0.807 <0.001 0.839 0.003

表6 两组患者治疗前后肝脏超声评分比较(±s,分)Table 6 Comparison of mean NAFLD fibrosis scores measured by color Doppler ultrasonography in two groups before and after treatment
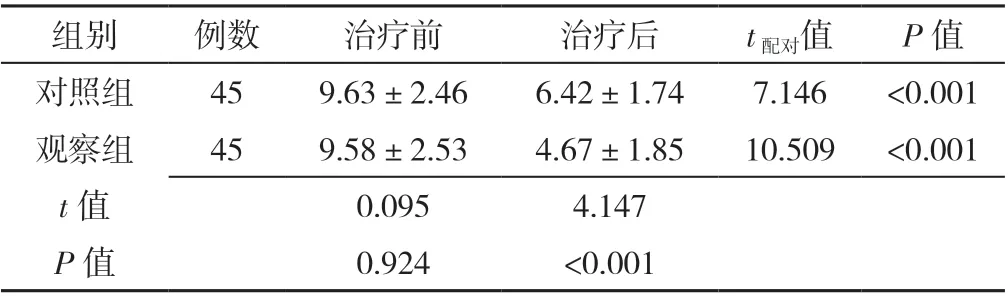
表6 两组患者治疗前后肝脏超声评分比较(±s,分)Table 6 Comparison of mean NAFLD fibrosis scores measured by color Doppler ultrasonography in two groups before and after treatment
组别 例数 治疗前 治疗后 t配对值 P 值对照组 45 9.63±2.46 6.42±1.74 7.146 <0.001观察组 45 9.58±2.53 4.67±1.85 10.509 <0.001 t 值 0.095 4.147 P 值 0.924 <0.001
3 讨论
目前糖尿病已被认为是全球性的流行性疾病。国际糖尿病联盟(IDF)预计,到2030 年全球糖尿病患病人数将达到3.66 亿[15]。研究显示,NAFLD 患者血糖异常发生率为18%~33%,而T2DM 患者的NAFLD 发生率高达49%~62%[16]。有研究证实,T2DM 与NAFLD 互为彼此的独立危险因素,两者并存后会加速病情进展,严重影响患者的生活质量[17]。因此,针对T2DM 合并NAFLD 的早期诊断及有效治疗显得尤为重要。

中医学并无“T2DM”和“NAFLD”病名,根据其临床表现,可归属于“消渴”“脾瘅”“肝着”“肥气”等范畴。诸多医家认为肝郁脾虚、痰瘀互结、湿热内阻等是T2DM 合并NAFLD 临床主要证候要素,治则当以疏肝健脾、清热化湿、化痰祛瘀为法[23]。葛根芩连汤出自《伤寒论》,治疗伤寒表证未解,邪陷阳明,具有解表清里之功。现代临床常用于治疗急性肠炎、细菌性痢疾、肠伤寒、胃肠型感冒等属表证未解,里热甚者。葛根辛甘而凉,入脾胃经,既能解表退热,又能升阳脾胃清阳之气而治下利,故为君药。黄连、黄芩清热燥湿、厚肠止利,故为臣药;甘草甘缓和中,调和诸药,为佐使药。全方具有解表清里、清热燥湿之功。正好切中T2DM 合并NAFLD“痰湿内阻”的病机。从现代医学角度看,葛根芩连汤可以显著改善肥胖大鼠的肝脏脂肪变性[9];其中葛根素可以有效抑制蛋白质非酶糖基化、提高胰岛素受体的敏感性[24];小檗碱可改善db/db 小鼠糖脂代谢、增强外周组织腺苷酸活化蛋白激酶(AMPK)活性[25];黄芩苷可降低NAFLD 大鼠的游离脂肪酸浓度,并增强乙酰辅酶A 羧化酶磷酸化的能力[26];甘草黄酮可抑制血糖升高和腹部脂肪积累,降低胰岛素、瘦素水平,调节糖尿病相关分子靶点生物活性的作用[27-28]。本研究结果显示,葛根芩连汤可以明显降低中医证候积分、血糖、血脂、肝功能、HOMAIR 及肝脏超声评分,疗效明显优于对照组,提示葛根芩连汤治疗T2DM 合并NAFLD 在改善临床症状、糖脂代谢指标、肝功能及IR 上有显著优势,具有临床应用价值。
综上所述,葛根芩连汤可以有效改善T2DM 合并NAFLD 患者的糖脂代谢,缓解临床症状,减轻IR,提高机体免疫功能,值得临床推广应用。但是本研究也存在不足之处,首先在疗程结束后未进行长期随访,无法有效评估葛根芩连汤的持续效果;其次,本研究纳入的样本量少、干预时间短,因此还需要开展多中心大样本的随机试验进行进一步研究。
作者贡献:范尧夫、褚晓秋进行试验设计与实施、资料收集整理,撰写论文并对文章负责;曹琳、孙洪平、包薇萍进行试验实施、评估、资料收集;许娟进行文章的质量控制及审校。
本文无利益冲突。
