原发性垂体癌的临床特点与诊治分析
2021-11-15马斯奇孔腾霄张栋韬袁善鹏焦贺男李雪元闫东明
马斯奇 孔腾霄 张栋韬 袁善鹏 高 鹏 焦贺男 李雪元 闫东明
郑州大学第一附属医院,河南 郑州 450052
垂体癌是一种罕见的垂体肿瘤,发病率低于全部垂体肿瘤的1%。从影像学上很难鉴别垂体癌和垂体腺瘤,然而某些特征可能提示这是一种更具侵袭性的垂体病变,包括垂体腺瘤内“非典型”细胞的组织学特征。垂体癌组织结构与腺瘤相同,但细胞分化不良,有大量的核分裂象,可向远处转移,通常具有侵袭性和分泌亢进功能[常见激素为促肾上腺皮质激素(ACTH)和泌乳素(PRL)][1]。垂体癌在女性和男性患者中发生的频率相等,多见于成人,初诊时往往诊断为侵袭性大腺瘤,病理学仍然是诊断的唯一金标准[2-4]。郑州大学第一附属医院近13 a接诊的垂体腺瘤患者中发现原发性垂体癌5例,初诊发现患者以视力下降、视野障碍为主诉入院,检查内分泌激素ACTH有不同程度的升高,PRL均>470 ng/mL。本文通过病例分析结合文献复习探讨疾病的表现和发展过程,在临床工作中对此病有更加深刻的认识,以便早期发现制定适宜的治疗方案。
1 资料与方法
1.1 病例纳入和排除标准纳入标准:(1)郑州大学第一附属医院神经外科收治,术后病理明确诊断为垂体癌;(2)原发性垂体癌患者,尽可能手术切除;(3)主要观察患者临床表现(以视神经功能受损症状为主)、内分泌激素检查、影像学特征、手术时间及方式、预后情况;(4)回顾性病例研究。
排除标准:(1)其他部位有肿瘤发生或发生转移者;(2)在外院治疗复发者;(3)术前接受放化疗者;(4)随访失访或临床资料不完善者。
1.2 病例资料收集郑州大学第一附属医院2008-01—2021-01治疗的5例经手术切除术后病理确诊为垂体癌患者的资料,其中男3例,女2例;年龄35~64(48.2±11.7)岁。患者均以首发视力下降、视野障碍为主诉入院,其中2例女性患者均有月经紊乱、泌乳等特点。入院完善神经系统体格检查(表1),术前行鞍区磁共振增强扫描,视力、视野、眼底检查,查内分泌激素,共同特点为ACTH有不同程度的升高,PRL均>470 ng/mL。术前CT、B超检查示,双肺及腹腔、盆腔均未发现占位性病变。

表1 原发性垂体癌患者术前和术后临床情况和影像学表现Table 1 preoperative and postoperative clinical and imagingmanifestations of primary pituitary cancer
病例1,患者 女,40岁,主诉:停经、泌乳16 a,视力下降伴复视1月余。既往史:无。体格检查:双侧瞳孔等大等圆,直接、间接对光反射迟钝。视力:左侧0.2,右侧0.8;视野:左侧视野偏盲,复视。术前MRI示,T1等信号,T2高信号,鞍区形态不规则,双侧海绵窦受包绕,鞍上可见巨大团块影,病变范围约27 mm×31 mm×40mm(前后径×左右径×上下径),行右额下入路瘤体切除。第一次病理回示,垂体腺癌,Ki-67(15%),p53(10%)。再次手术行经颅内镜经鼻蝶垂体肿瘤切除术。第二次病理回示,(鞍区占位)考虑垂体癌,免疫组化结果:AE1/AE3(CK)(+),EMA(+),CD56(56C04)(+),SYN(+),CgA(部分+),GH(部分+),LH(-),TSH(-),FSH(-),Prolactin(部分+),TTF-1(+),CollagenⅣ(网状支架破坏),Ki-67(70%+)。
病例2,患者 男,64岁,主诉:双眼视力模糊2年余,加重7 d。既往史:既往高血压史5年余,未规律服药,最高血压160/100 mmHg(1 mmHg=0.133 kPa)。体格检查:双侧瞳孔等大等圆,直接、间接对光反射正常。视力:左侧0.5,右侧0.1;视野:双侧颞侧偏盲,术前MRI示,T1低信号,T2高信号,蝶鞍扩大,包绕两侧海绵窦,侵犯鞍上并压迫第三脑室,病变范围约25.3 mm×29.1 mm×39.6 mm(前后径×左右径×上下径),行右额下入路瘤体切除。病理回示,(垂体)腺癌。免疫组化:CK(+),CD56(+),Syn(+),P53(个别+),GFAP(-),S-100(-),NeuN(-),PLAP(-),Ki-67(1%+)。
病例3,患者 男,35岁,主诉:左眼视力障碍2年余。既往史:无。体格检查:双侧瞳孔等大等圆,直接、间接对光反射正常。视力:左侧0.3,右侧0.1;视野:双侧颞侧偏盲。术前MRI示,T1等信号,T2高信号,瘤体边界不清,侵及两侧海绵窦,突向蝶骨平台。病变范围约30 mm×33 mm×41 mm(前后径×左右径×上下径),行右额下入路瘤体切除。病理回示,(垂体瘤)腺癌。免疫组化:CK(弱+),Syn(+),P53(50%+),Ki-67(5%+),PRL(+),GH(-),ACTH(-),TSH(-),FSH(-),LH(-)。
病例4,患者 女,46岁,主诉:闭经3 a伴泌乳2 a。既往史:无。体格检查:双侧瞳孔等大等圆,直接对光反射稍迟钝,间接对光反射正常。视力:左侧0.3,右侧0.8;视野:左侧颞侧偏盲,复视。术前MRI示,T1等信号,T2高信号,蝶鞍扩大伴鞍底下陷,双侧海绵窦包绕,瘤体向上压迫视交叉。病变范围约33 mm×32 mm×40mm(前后径×左右径×上下径),行右额下入路瘤体切除。病理回示,(鞍区占位)垂体腺癌。免疫组化:CD56(+),Syn(+),AE1/AE3(-),CD30(-),P53(30%+),Ki-67(20%+),EMA(-),LCA(-)。
病例5,患者 男,56岁,主诉:双眼逐渐模糊1月余。既往史:无。体格检查:双侧瞳孔等大等圆,直接、间接对光反射正常。视力:左侧0.5,右侧0.2;视野:双侧颞侧偏盲。术前MRI示,T1低信号,T2高信号,鞍内及鞍上可见较大团块状的等T1稍长T2信号,病变向右上延伸至鞍上池,双侧海绵窦受包绕,垂体柄未见明确显示,视交叉受压向上(图1)。病变范围约25 mm×23 mm×36 mm(前后径×左右径×上下径),行经颅内镜经鼻蝶垂体肿瘤切除术。病理回示,(鞍区占位)垂体腺癌,部分可见腺样囊性癌成分,符合腺样囊性癌,侵犯鞍区(图2)。免疫组化结果:AE1/AE3(CK)(+),CD56(56C04)(+),SYN(+),NSE(-),CollagenⅣ(-),P53(+),Ki-67(局灶40%+,局灶3%+),CK5/6(+),P63(+),CK(H)(+),SMA(-),Calponin(灶+),S-100(-),CK7(+)。
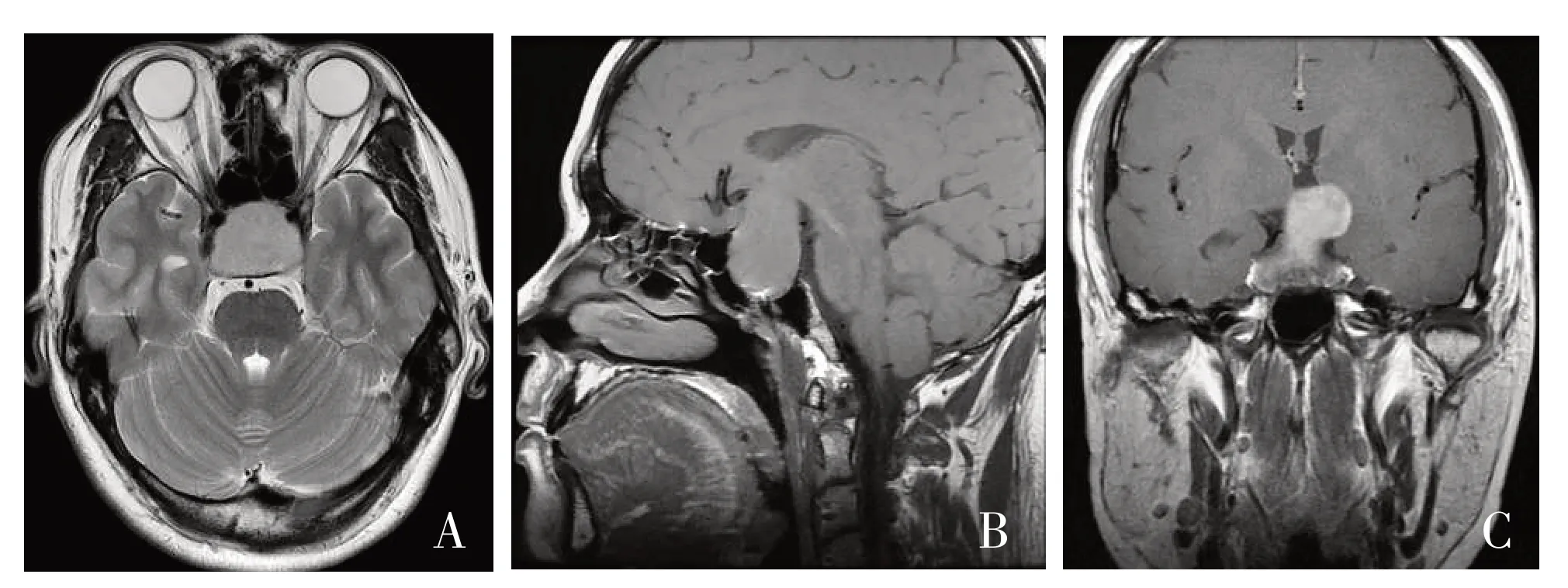
图1 病例5垂体磁共振平扫 A:轴位T2像;B:矢状位T1像;C:冠状位T1像。鞍内及鞍上可见较大团块状等T1稍长T2信号,病变向右上延伸至鞍上池,双侧海绵窦包绕,垂体柄受压,视交叉受压上抬Figure 1 Plain MRI scan of pituitary of case 5.A:Axial T2 image;B:Sagittal T1 image;C:Coronal T1 image.Largemass like T1 and slightly long T2 signals can be seen in the sella and suprasella.The lesion extends to the suprasellar cistern to the right,surrounded by bilateral cavernous sinuses,the pituitary stalk is com pressed,and the optic cross is com p ressed and lifted up

图2 病例5垂体癌组织病理切片(×200)A:肿瘤细胞弥漫排列,异型性明显,核不规则,胞浆嗜酸性(HE染色×200);B:泌乳素蛋白表达,弥漫散在颗粒状胞浆内染色(免疫组化×200)Figure 2 Histopathological section of pituitary carcinom a of case 5(×200).A:Tum or cells are diffusely arranged,w ith obvious atypia,irregular nuclei and eosinophilic cytop lasm(HE staining×200);B:Prolactin protein expression:diffuse and scattered staining in granular cytoplasm(immunohistochem istry×200)
2 结果
原发性垂体癌患者出现视神经功能受损表现乃瘤体压迫视神经出现视野模糊、视力下降、视野偏盲等临床症状[5-8],病因为视束起始处视交叉受压[9-11],患者出现同向偏盲;同侧偏盲为视交叉以上受压;视交叉正中部受压,出现双眼颞侧偏盲[12-16]。前4例患者由于就诊时间较早,当时受医疗水平的限制及术前仅凭影像学条件的限制难以与侵袭性垂体瘤鉴别。结合术前病史、体征,患者均表现为激素分泌异常及肿瘤压迫症状,当时采用开颅经右额下入路行肿瘤切除,由于瘤体较大,侵袭海绵窦较多,在取材行病理实验室检查的同时尽可能切除瘤体解除视神经压迫。术后所有病例血ACTH和PRL均明显下降(表2),病例1出现肾上腺皮质功能减退、尿崩症状。病例3、病例4出现尿崩症状,均诉头痛较术前好转,但只有病例3术后诉视力较前好转,术后视野左侧颞侧偏盲,右侧颞侧视野范围约60°,较术前好转。病例1和病例4术后泌乳素较高给予口服溴隐亭继续治疗。对症治疗患者出院后3个月后门诊复查并建议放射治疗。病例1于5个月后再次发现视力恶化,入院体格检查,视力左眼手动、右侧视力0.2,左侧视野偏盲,复视。再次行瘤体切除术,术后病理回示垂体癌。病例5于2019-09就诊,完善相关检查,发现左侧鼻腔及上颌窦均有瘤体侵犯。综合考虑后行神经内镜下经鼻蝶垂体肿瘤切除术。术后患者出现尿崩症状,诉头痛、视力、视野较前好转,遵医嘱行放射治疗。所有患者要求出院3个月后门诊复查MRI、内分泌激素。

表2 原发性垂体癌患者术前和术后血ACTH和PRL情况Table 2 Serum ACTH and PRL in patientsw ith primary pituitary cancer before and after operation
3 讨论
根据世界卫生组织(WHO)分类系统的定义,垂体癌是表现为脑脊液和(或)全身转移的垂体上皮性肿瘤[17-18]。它们是非常罕见的肿瘤,约占手术切除的垂体瘤的0.2%。在最初诊断为垂体瘤时,转移瘤很少出现。绝大多数已报道的垂体癌是神经内分泌肿瘤,其内分泌表现与垂体腺瘤难以区分[19-22]。本文收集的5例患者,初诊均为视力、视野受损,术后并无明显改善,预后很差。垂体癌患者通常表现为视力受损、头痛、闭经或库欣综合征,最常见的内分泌综合征是库欣病(42%)和高泌乳素血症(33%),其次是肢端肥大症(6%)和甲状腺功能亢进症(1%)。尽管垂体癌体积很大,但通常不伴垂体功能减退。垂体癌倾向于通过淋巴和血液扩散进行全身扩散,据报道约47%的病例全身转移,约40%颅内和脊髓转移,全身和中枢神经系统均转移约13%。转移的部位包括大脑皮质、小脑、脊髓、软脑膜、眼、心、肺、颈淋巴结、胰腺、肝、肾、盆腔淋巴结、卵巢、子宫肌层和骨骼[3,23-26]。
垂体肿瘤的发生、发展是一个多步骤、多因素的过程,其中内分泌因素、遗传倾向和特定的体细胞突变起重要作用[27-30]。尽管目前垂体肿瘤分子机制的研究已经取得重大进展,一些证据表明从良性腺瘤到垂体癌的进展伴随着分子通路异常的累积变化,但具体细节仍不清楚[31]。研究发现常见的TP53、H-ras、Rb基因与垂体肿瘤的发生无直接关系,但这些癌基因在肿瘤的进展和转移中起至关重要的作用[4,32-36]。原发性垂体癌呈现典型垂体腺瘤的组织形态学特征,如细胞多形性、细胞核异型性、核分裂像、坏死和血管侵袭,其免疫组织化学染色为突触素(Syn)、嗜铬素A(CgA)、P53蛋白呈阳性,Ki-67抗原标记指数增加[37-38]。Ki-67蛋白是细胞增殖的标志,存在于细胞分裂周期的GAP-1(G1)期、合成期(S)和GAP-2(G2)期以及有丝分裂期。该表达由单克隆抗体MIB-1检测,并以Ki-67增殖指数的形式表示为免疫阳性细胞核的百分比。Ki-67增殖指数在非侵袭性腺瘤、浸润性腺瘤和癌中分别为1.37%、4.66%和11.91%[5]。Ki-67结合其他增殖指标可有助于临床医生在病史早期“标记”可能复发和潜在癌变的垂体瘤。肿瘤抑制因子p53蛋白编码是一种对细胞增殖至关重要的核磷蛋白。P53在许多人类癌症中普遍发生突变,在垂体癌中不发生突变,但P53免疫反应与垂体癌的侵袭性有关[6,39]。
垂体癌的治疗尚无明确标准,据文献回顾研究,手术切除为最常用治疗方法[40]。放射治疗在相当数量的病例中也被用作切除后的主要和辅助治疗。当病变为内分泌肿瘤时选择相应的药物控制激素的峰值以便达到瘤体缩小的目的。(1)库欣病:帕瑞肽是目前唯一被批准用于治疗库欣病的药物,其能与生长抑素受体SSTR1和SSTR5有高结合力,能有效抑制GH、IGF-1、ACTH的分泌。(2)高泌乳素血症:多巴胺激动剂(溴隐亭、卡麦角林)可使大部分患者泌乳素降到正常范围内,且能缩小全部或部分瘤体。(3)肢端肥大症:生长抑素类似物(奥曲肽、兰瑞肽、帕瑞肽)可抑制生长激素的升高,但对缩小肿瘤体积效果不明显。(4)甲状腺功能亢进症:对生长抑素类似物反应敏感[7],除生长抑素类似物外,化疗药物包括替莫唑胺、曲美他滨、卡培他滨、维罗莫司、舒尼替尼、贝伐单抗等。替莫唑胺最初用于治疗间变性星形细胞瘤和胶质母细胞瘤,其用于垂体癌患者的长期疗效的第一份报告发表于2006年[8]。目前,根据欧洲内分泌学学会的说法,替莫唑胺被认为是治疗侵袭性垂体瘤的一线化疗药物[7]。然而,总的来说,现有的治疗垂体癌的化疗药物主要是经验性的和非特异性的。最新实验室和临床研究结果表明,免疫疗法可能是一种很有前途的替代疗法,用于治疗对常规疗法耐药的垂体癌和难治性侵袭性垂体瘤。免疫治疗、放射治疗或与替莫唑胺联合治疗比单一治疗更具有协同作用。针对原发性垂体癌仍需要更多的实验和临床研究进一步验证免疫治疗的确切疗效[9]。
从垂体腺瘤发展为垂体癌是一种特殊情况,目前缺乏可靠的预测指标。较高的增殖指数提示原位癌或转移前癌的存在,提示具有迅速进展和致死的潜在危险。由于目前治疗这种疾病的能力有限,定期的生化和影像监测是必不可少的,也可能是早期发现和积极治疗可疑转移的关键因素。只有通过定期甚至频繁的生化和影像监测以及详细的预后跟踪随访,才能更好地指导临床治疗,以期取得积极的临床结果。
