抑制铁死亡改善血管性痴呆大鼠认知功能的作用与机制研究
2021-11-15贺莎莎刘进友李书剑田发发
贺莎莎 刘进友 李书剑 田发发 方 佳
1)中南大学湘雅二医院,湖南 长沙 410011 2)河南省人民医院,河南 郑州 450003 3)中南大学湘雅医院,湖南 长沙 410008
血管性痴呆(vascular dementia,VD)是一组由多种脑血管因素导致的获得性认知功能障碍综合征,是仅次于阿尔茨海默病的第二大痴呆类型[1-2]。慢性脑灌注不足是VD认知功能障碍和海马神经元丢失的主要原因[3]。目前,VD的致病机制尚未完全阐明,治疗方法非常有限,不能阻止或减缓疾病的发生、进展,仅限于预防和治疗脑血管病及其危险因素,如高血压和糖尿病等[4-5]。
铁死亡是一种铁和脂质过氧化反应依赖的调控性细胞死亡方式,其在形态、生物化学及基因水平不同于其他类型的细胞死亡方式,如凋亡、坏死及自噬[6]。脂质过氧化和活性氧堆积是铁死亡的关键促发因素[7]。有报道VD模型大鼠海马CA1区与大脑皮质可观察到铁代谢紊乱及铁沉积现象[8]。脂质过氧化和氧化应激参与了VD模型大鼠海马神经元损伤的机制[9]。研究提示铁死亡可能参与了VD的致病机制,然而迄今为止,铁死亡在VD发生、发展中的作用及具体分子机制尚未阐明。
本研究拟通过改良双血管阻断法(2-vessel occulasion,2-VO)构建慢性脑低灌注致VD模型大鼠,探讨铁死亡在VD认知功能障碍发生、发展中的作用与机制,观察抑制铁死亡对VD模型大鼠认知功能的影响。
1 材料与方法
1.1 实验动物成年雄性SD大鼠36只,SPF级,体质量200~220 g,由中南大学湘雅医学院实验动物中心提供。动物房室温保持23~28℃,湿度50%~55%,通风条件好,饲养于12 h昼夜循环、饮水和食物充足的不锈钢笼中。实验方案遵循美国国立卫生研究院公布的实验动物使用指南,并经中南大学湘雅二医院伦理委员会批准(批准号2020058)。采用随机数字表法将36只雄性SD大鼠随机分为3组,每组12只。(1)假手术组:仅分离但不结扎血管;(2)VD组:采用改良2-VO法制作VD模型大鼠;(3)Ferrostatin-1(Fer-1)组:制备VD模型大鼠,予以特异性铁死亡抑制剂Fer-1腹腔内注射。改良2-VO法[10]即10%水合氯醛350 mg/kg腹腔注射麻醉大鼠,沿颈前中线切开,暴露颈总动脉,分离迷走神经,用7号手术线进行永久性颈总动脉结扎并切断,1周后另一条颈总动脉采用同样的方法处理。假手术组大鼠仅做颈前切口,分离暴露双侧颈总动脉,但不结扎及剪断颈总动脉,其余步骤同VD模型组。Fer-1组大鼠每日腹腔注射Fer-1(2.5μmol/kg,Selleck,美国)[11],共注射3周,然后处死。假手术组与VD组大鼠腹腔注射载体溶液(含有10%二甲基亚砜的200μL PBS)。VD组和Fer-1组中各有1只大鼠于改良2-VO术后1周内死亡。2-VO术后30 d对各组大鼠行Morris水迷宫试验检测学习记忆能力,之后处死大鼠,断头取海马组织进行下一步实验。
1.2 方法
1.2.1 Morris水迷宫试验:选用大鼠通用柱形黑色水池,计算机识别系统将其分为4个象限。水池中加入适量黑色碳素墨水,使水面浑浊至不透明,将桶内水温加热到23~25℃。选取第三象限正中放置圆形柱状平台,没入水下2 cm。试验包括定位航行试验和空间探索试验。大鼠连续5 d进行定位航行试验,每天固定时间按顺时针方向从4个不同象限入水点,记录90 s内寻找平台的时间即逃逸潜伏期,如果在90 s内未找到平台,则将大鼠引上平台并保持20 s,此时逃逸潜伏期记录为90 s。定位航行试验结束后撤除平台,次日行空间探索试验,将大鼠在第一象限面向池壁放入水中,计算机图像分析仪(TopScan,CleverSys Inc.)记录大鼠在90 s内穿越平台位置的次数,在第三象限探索的时间及游泳轨迹[12]。
1.2.2 Perls’铁染色:取新鲜海马,多聚甲醛固定,脱水后石蜡包埋,切片机切取4μm厚的冠状切片,切片置于4%多聚甲醛5 min,去离子水冲洗,用新鲜配置的0.1 mol/L HCl和0.1 mol/L亚铁氰化钾等体积混合液孵育,PBS冲洗,置于新鲜配置的1%H2O2-甲醇溶液中孵育,PBS冲洗,DAB显色,苏木素轻度复染。在染色过程中不加亚铁氰化钾-盐酸混合物作为DAB显色阴性对照,用Image J软件对海马铁沉积进行计数分析[11]。
1.2.3 尼氏染色:提取大鼠海马组织,多聚甲醛固定,常规脱水、石蜡包埋、切片(15μm)、二甲苯脱蜡、梯度酒精脱水,尼氏染色液染色,PBS缓冲液冲洗2次,70%乙醇脱水,95%乙醇分化,二甲苯透明,最后用中性树脂封片,在光学显微镜下观察,于高倍镜下(×400)随机选取3个视野计数尼氏染色阳性细胞,取平均值[13]。
1.2.4 透射电镜观察:大鼠断头取脑分离出海马CA1区,2.5%戊二醛-1.5%多聚甲醛前固定2 d(4℃),1%锇酸-1.5%亚铁氰化钾后固定1.5 h,PBS漂洗,梯度酒精脱水,环氧丙烷与环氧树脂浸泡,纯环氧树脂浸泡,包埋后入烤箱烘烤,修块,超薄切片(50 nm)并置于单个固定网格上,用醋酸铀和柠檬酸铅各染色5 min。在日立7560透射电镜下,盲法观察海马CA1区神经元超微结构、拍照[14]。
1.2.5 酶联免疫吸附试验(enzyme-linked immunoa bsorbent assay,ELISA):取海马组织标本,于冰上将100 mg组织与1 mL预冷的生理盐水中充分研磨、匀浆,按照试剂盒(A003-1、A006-2,南京建成生物工程研究所,中国)说明书操作步骤进行,通过绘制标准曲线计算海马中丙二醛(malondialdehyde,MDA)和谷胱甘肽(glutathione,GSH)的含量[15]。
1.2.6 荧光实时定量PCR(real-time quantitative PCR):取海马组织约100mg,使用Trizol试剂盒(15596026,Invitrogen,USA)抽提细胞总RNA并测定其浓度,以其为模板使用反转录试剂盒获得cDNA,对PTGS2和β-actin进行实时定量PCR检测。严格按试剂盒说明书操作,使用ABI 7300荧光定量PCR仪。根据GenBank中β-actin和PTGS2基因设计引物。PTGS2正向引物:5'-GGGAGTCTGGAGA TTGG AA-3';反向引物:5'-GTGCACATTGAA GTAGGTGA CT-3'。β-actin正 向 引 物:5'-GTGACGTTGA-CAT CCGTAAAGA-3';反向引物:5'-GCCGGACTCAT CGTACTCC-3'。1.2.7 蛋白质印迹分析(Western Blot assay):提取细胞总蛋白质后进行聚丙烯酰胺凝胶电泳,转PVDF膜,以丽春红染色液显示蛋白质条带并剪4-羟基壬烯醛(4-hydroxynonenal,4-HNE)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)及β-actin条带,用10%脱脂奶粉封闭,加入1∶1 000一抗包括抗4-HNE(兔抗鼠,ab46545,abcam,美国)、抗-GPX4(兔抗鼠,ab125066,abcam,美国)和抗β-actin(兔抗鼠,ab8227,abcam,美国)于4℃下孵育过夜,加TBST洗涤液,洗膜后加入1∶2 000特异性二抗于室温下孵育1 h,TBST缓冲液洗涤3次,ECL法检测条带,进行密度定量分析。
1.3 统计学分析采用SPSS 26.0统计软件进行数据处理,试验数据以均数±标准差(±s)表示。使用单因素方差分析(ANOVA)比较假手术组、VD组及Fer-1组的差异。在方差分析的基础上,使用Student-Newman-Keuls检验对每两个均数进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 Fer-1改善VD模型大鼠认知功能空间探索试验中记录的各组大鼠的游泳轨迹如图1A所示。在定位航行试验中,VD模型大鼠逃逸潜伏期显著长于假手术组(P<0.05),应用Fer-1腹腔注射后大鼠逃逸潜伏期较VD模型大鼠显著缩短(P<0.05,图1B)。在空间探索试验中,与假手术组相比,VD模型大鼠的跨越平台次数显著减少(P<0.05),而Fer-1组大鼠的跨平台次数较VD模型大鼠显著增多(P<0.05,图1C)。VD模型大鼠在靶象限停留的时间少于假手术组大鼠(P<0.05),而Fer-1组大鼠在靶象限停留时间较VD组大鼠显著增加(P<0.05,图1D)。
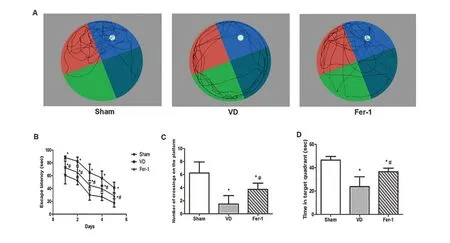
图1 Fer-1可改善VD模型大鼠的认知功能障碍A:空间探索试验中假手术组、VD组和Fer-1组大鼠的典型游泳轨迹;B:逃逸潜伏期;C:穿越平台次数;D:空间探索试验中目标象限所花费时间。与假手术组比较,*P<0.05,与VD组比较,#P<0.05Figure 1 Fer-1 improved cognitive deficits of ratmodels w ith vascular dementia.A:Typical sw imm ing traces of all groups in the space exp loration test.B:Escape latency.C:Number of p latform crossing times.D:The time spent in the target quadrant in the space exploration test.Com pared w ith the Sham group,*P<0.05;Compared w ith the VD group,#P<0.05
2.2 Fer-1减轻VD模型大鼠海马神经元丢失尼氏染色结果显示,假手术组大鼠海马CA1区神经元排列整齐致密,胞体较大,胞质蓝染,尼氏体丰富;VD组大鼠海马神经元排列疏松,尼氏体明显减少,大量神经元丢失,存活神经元数量减少,与假手术组相比有显著性差异(P<0.01,图2);应用Fer-1腹腔注射后,大鼠海马CA1区神经元数量较VD组大鼠显著增多(P<0.05)。
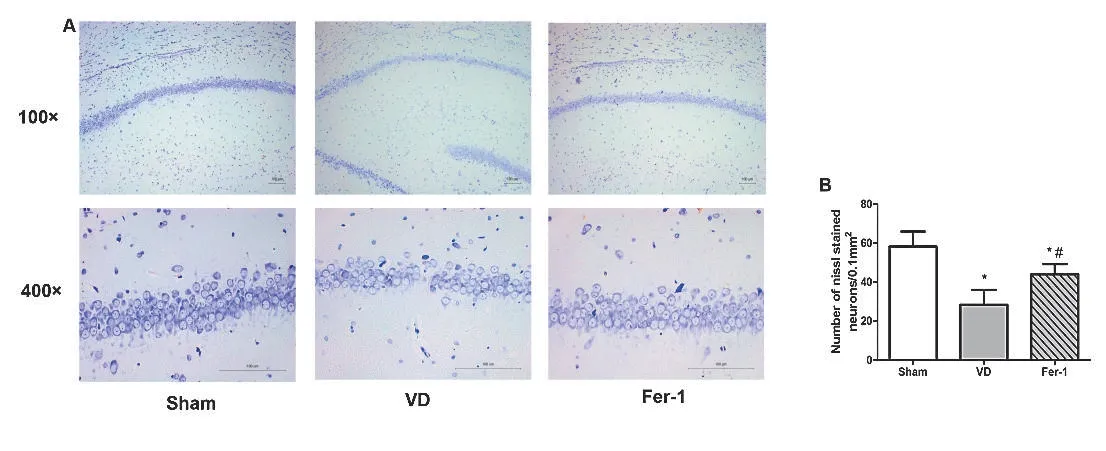
图2 Fer-1减少VD模型大鼠海马神经元死亡A:分别在100×和400×显微镜下观察假手术组、VD组和Fer-1组大鼠海马CA1区尼氏染色阳性神经元;B:对各组大鼠海马CA1区尼氏染色阳性神经元进行计数,比例尺:100μm。与假手术组相比,*P<0.05;与VD组相比,#P<0.05Figure 2 Fer-1 attenuated neuron cell death in the hippocam pus of vascular dementia(VD)rats.A:Representative photom icrographs of Nissl-stained neurons in the hippocam pal CA1 region of different groups.Neurons were visualized at 100×and 400×magnification.B:Quantitative analysis of the number of Nissl-stained neurons in the hippocam pal CA1 area of different groups.Scale bar:100m.Compared w ith the Sham group,*P<0.05;Compared w ith the VD group,#P<0.05
2.3 Fer-1改善VD模型大鼠海马神经元线粒体超微结构透射电镜结果显示,VD组大鼠海马神经元线粒体发生萎缩,线粒体变小,线粒体平均面积小于假手术组(P<0.05);腹腔注射Fer-1后,大鼠海马CA1区神经元线粒体超微结构明显改善,大鼠海马神经元线粒体平均面积与假手术组相比无显著性差异(P>0.05,图3)。

图3 Fer-1对VD模型大鼠海马神经元线粒体超微结构的作用 A:假手术组、VD组和Fer-1组神经元的超微结构;B:各组大鼠海马神经元线粒体平均面积的定量分析,比例尺:500 nm。与假手术组相比,*P<0.05;与VD组相比,#P<0.05Figure 3 Effects of Fer-1 on m itochondrial u ltrastructure of hippocam pal neurons in VD ratmodels.A:Ultrastructure of neurons in the sham group,VD group,and Fer-1 group.B:Quantification analysis of the averagem itochondrial area.Scale bar:500 nm.Compared w ith Sham group,*P<0.05;Com pared w ith the VD group,#P<0.05
2.4 Fer-1抑制VD模型大鼠海马铁沉积及前列腺素内过氧化物合酶2(prostaglandinendoperoxide synthase,PTGS2)m RNA水平Perls’染色结果显示,VD组大鼠海马CA1区铁阳性区面积的百分比显著高于假手术组(P<0.05,图4)。腹腔注射Fer-1后大鼠海马铁阳性区面积的百分比较VD组大鼠显著减低(P<0.05),提示Fer-1可减轻VD大鼠海马的铁沉积。VD模型大鼠海马铁死亡标志物PTGS2 mRNA较假手术组显著增加;与VD大鼠相比,腹腔注射Fer-1后,大鼠海马PTGS2 mRNA水平显著降低(P<0.05)。

图4 Fer-1减轻VD模型大鼠海马铁沉积与PTGS2 mRNA的表达水平A:分别在100×和400×显微镜下观察各组大鼠海马CA1区铁染色阳性区域,比例尺:100μm;B:对各组大鼠铁染色阳性区域进行定量分析;C:各组大鼠海马PTGS2mRNA水平比较。与假手术组相比,*P<0.05;与VD组相比,#P<0.05Figure 4 Fer-1 m itigated iron accumu lation and exp ression level of PTGS2 m RNA in the hippocam pus of vascular dementia(VD)rat model.A:Representative photom icrographs of iron positive area in the hippocam pal CA1 area of different groups.Neurons were visualized at 100×and 400×magnification.Scale bars:100μm.B:Quantitative analysis of the average percentages of iron positive area in different groups.C:Comparison of PTGS2 mRNA level in the hippocampus between different groups.Com pared w ith the Sham group,*P<0.05;Com pared w ith the VD group,#P<0.05
2.5 Fer-1减轻VD模型大鼠海马脂质过氧化水平与假手术组相比,VD组大鼠海马GSH和GPX4水平显著降低(P<0.05);腹腔注射Fer-1后大鼠海马GSH和GPX4水平较VD组大鼠显著增加(P<0.05)。VD组大鼠海马MDA和4-HNE水平较假手术组升高,差异有统计学意义(P<0.05);腹腔注射Fer-1后大鼠海马MDA和4-HNE的表达水平较VD组大鼠显著降低(P<0.05,图5)。

图5 假手术组、VD组和Fer-1组模型大鼠海马4-HNE(A)、MDA(B)、GPX4(C)与GSH(D)的表达水平,与假手术组相比,*P<0.05;与VD组相比,#P<0.05Figure 5 The expression levels of 4-HNE(A),MDA(B),GPX4(C),and GSH(D)in the hippocam pus of rats in the sham,VD and Fer-1 groups.Com pared w ith the Sham group,*P<0.05;Com pared w ith the VD group,#P<0.05
3 讨论
铁死亡是一种以铁依赖性脂质过氧化为特征的新型非凋亡性程序性细胞死亡方式,与认知障碍发生密切相关[16-17]。本研究首次探讨了铁死亡在VD中的致病机制以及抑制铁死亡在改善VD认知功能障碍中的作用。本研究采用改良2-VO法构建VD模型,大鼠术后苏醒较快,存活率94.4%,是一种理想的建模方法[18]。VD动物模型海马尤其是CA1区、纹状体和大脑皮质区域最容易受慢性脑低灌注的影响[19]。大脑是一个高能量需求的器官,但缺乏足够的能量储备,且大脑中富含的磷脂是产生脂质活性氧的关键底物,因此,大脑比其他器官更容易受到氧化应激的影响[20],推测铁死亡可能参与了VD认知障碍的发生、发展。
本研究中2-VO术后1个月VD模型大鼠海马神经元明显丢失,残存神经元内线粒体固缩,线粒体体积缩小,而铁死亡的标志物之一PTGS2 mRNA表达增加,提示VD模型大鼠海马神经元存在铁死亡现象。铁死亡有三大主要调节机制,包括铁蓄积、氨基酸抗氧化系统失衡及脂质过氧化物集聚[21-22]。铁摄取、储存和排泄失衡引起的细胞内铁含量增加是铁死亡的关键启动因素[23]。GPX4是一种GSH依赖性酶,是铁死亡氨基酸代谢中的重要调控靶点,选择性催化脂质过氧化物,抑制或GPX4缺失直接导致脂质过氧化物积累而激活铁死亡,此外,内源性抗氧化酶的主要辅助因子GSH缺失也可抑制GPX4的功能[24-25]。本研究发现VD模型大鼠海马CA1区铁沉积增加,抗氧化物GSH和GPX4水平降低,脂质过氧化标志物MDA和4-HNE表达增加,提示VD模型大鼠中铁蓄积、抗氧化能力下降及脂质过氧化等诱导海马神经元发生铁死亡,参与了VD认知功能障碍的发生、发展。
最新研究表明铁死亡与缺血性脑卒中、脑出血和脑缺血再灌注等神经系统疾病的发生、发展有关,而抑制铁死亡能在一定程度上延缓疾病的进程,减轻疾病的严重程度[26-29]。本研究中VD模型大鼠腹腔注射特异性铁死亡抑制剂Fer-1后,海马神经元的丢失减少,大鼠认知功能明显改善。有报道Fer-1通过螯合铁和清除脂质过氧化而产生抗铁死亡作用[30]。蛛网膜下腔出血模型大鼠中Fer-1通过增加铁排泄发挥神经保护作用[31]。Fer-1通过抑制脂质过氧化反应,作为抗氧化剂捕获自由基以抑制铁死亡[32]。VD模型大鼠腹腔注射Fer-1后,大鼠海马铁沉积减少,脂质过氧化物MDA和4-HNE表达下调,而抗氧化物GPX4和GSH表达上调。本研究提示Fer-1通过抑制海马神经元铁死亡改善VD模型大鼠的认知功能,可能的机制包括减少海马铁蓄积、增强神经元抗氧化能力以及减少脂质过氧化物聚集。
本研究证实铁死亡参与了VD认知损害的发病机制,而使用Fer-1抑制铁死亡可减少VD模型大鼠海马神经元的丢失,改善大鼠的认知损害,其机制可能与减少铁沉积、增强抗氧化能力及减少脂质过氧化物集聚相关。
本研究也存在一些局限性,首先,未观察VD模型大鼠造模后不同时期铁死亡的动态变化,由于铁沉积的严重程度可能随疾病进展而变化,应进一步研究2VO术后不同时期铁沉积程度与铁死亡情况。其次,本研究未检测不同剂量的Fer-1对VD模型大鼠认知功能的影响。因此,尚需进一步研究,探讨铁死亡在VD中的作用与具体分子机制。本研究为VD的发病机制提供了新思路,为VD的治疗提供了新靶点。
利益冲突声明:作者声明无任何利益冲突。
