低温贮藏中华管鞭虾肌肉品质及组织蛋白酶H活性变化
2021-11-14李志鹏周晓娇水珊珊HATABShaimaaRedaAbdElkhalik
李志鹏,周晓娇,水珊珊,HATAB Shaimaa Reda Abd Elkhalik,张 宾,
(1.浙江海洋大学食品与医药学院,浙江舟山 316022;2.赫利奥波利斯大学食品加工系,埃及开罗 11785)
中华管鞭虾(Solenocera crassicornis),俗称红虾,因其虾壳通透、肉质糯软,富含大量人们健康饮食所需的营养物质,而备受消费者的欢迎。中华管鞭虾捕捞点主要分布于印度、马来西亚、印度尼西亚、日本和中国沿海[1]。在我国,常见于黄海南部和东海附近,适宜的捕捞期为5月~8月,在5月捕获量最高。近年来,随着水产品销售量的日益增多,以及人们对新鲜高质量水产品的需求增大,中华管鞭虾等虾类逐渐变为世界上最重要的渔业产品[2]。但冰鲜虾类在贮藏过程中容易腐败,尤其在长距离运输过程中虾肉口感及品质劣变更为严重。如何有效解决冰鲜虾类的贮藏品质劣变问题,对保障虾类制品价值及满足消费者需求具有重要意义。
研究表明,虾体肌肉软化可能由多种原因造成。在冷藏或冻藏条件下,虾体肌肉组织中冰晶的形成和细胞体积的变化,会导致细胞和肌纤维被破坏,进而导致虾肉的软化[3]。于丽霞等[4]研究了罗氏沼虾冻藏过程中冰晶形成情况,发现罗氏沼虾在冰箱中形成冰晶颗粒较大,其对细胞产生的机械损伤作用严重。此外,虾肉中的组织蛋白酶会随着贮藏时间的延长不断作用于肌肉蛋白质,导致细胞骨架和肌原纤维蛋白被破坏。近年来,组织蛋白酶对水产品品质的影响逐渐被人们所关注,尤其在水产动物死后贮藏初期,其肌肉品质往往会发生极大的改变,组织蛋白酶被认为是对肌肉蛋白质产生降解的重要影响因素[5]。沈春蕾等[6]研究发现,在凡纳滨对虾贮藏过程中,虾头中部分蛋白酶可能会逐步迁移到虾肌肉中,进而对肌肉品质产生较大影响。目前,对于不同贮藏方式下虾肌肉组织中内源酶活性对其肌肉品质变化产生的影响,还存在较多不明之处,尤其关于中华管鞭虾等海水虾类中组织蛋白酶活性的研究还鲜有报道[7-8]。本研究以完整的中华管鞭虾为对照组,比较分析去头后的虾肌肉组织理化特性及组织蛋白酶H活性变化情况,旨在为后续海水虾类组织蛋白酶活性及其贮藏方式的选择提供理论基础。
1 材料与方法
1.1 材料与仪器
冰鲜中华管鞭虾(体长13~15 cm) 浙江舟山中国舟山国际水产城,购买后立即放入装有冰袋的保温箱内,快速运回实验室,并立即对其进行处理;磷酸氢二钠、三(羟甲基)氨基甲烷、十二烷基硫酸钠(Sodium dodecyl sulfate, SDS)、过硫酸铵(Ammonium persulphate, APS)、Na2EDTA、焦磷酸钠等 国药集团化学试剂有限公司;蛋白测定试剂盒 南京建成生物工程研究所;组织蛋白酶H测定试剂盒 上海继锦化学科技有限公司。
751UVGD型紫外-可见光分光光度计 上海第三分析仪器厂;MS-Pro型物性测试仪 美国FTC公司;Synergy H1全功能酶标仪 美国伯腾仪器有限公司;HSY-A-200恒温水浴振荡器 天津厂草科技有限公司;DiRECT-Q超纯水装置 美国MILLIPORE公司;MDF-U53V型超低温冰箱 日本SANYO公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 样品处理 将实验样品分为2组:完整虾组和去头虾组,分别进行4 ℃冷藏(贮藏6 d,每2 d取样测定1次)和-18 ℃冻藏(贮藏120 d,每20 d取样测定1次)。
1.2.2 pH的测定 依据GB/T 5009.237-2016方法进行测定。选取多只虾的第二腹节,混合后切碎,称取3 g样品(精确到0.01 g),加入10倍煮沸后冷却的蒸馏水,高速均质30 s,摇匀后静置30 min,过滤,取滤液。用pH计测量数值,每组实验平行重复三次,取平均值。
1.2.3 持水力的测定 参考卢涵[9]的实验方法,并稍作改进。选取多只虾的第二腹节,混合后切碎,称取2 g左右虾肉(重量记作W1,g),用滤纸包裹,1600×g离心10 min后,再次称重(重量记作W2,g)。持水力表示样品保持重量的百分比,计算公式如(1)所示。

1.2.4 肌原纤维蛋白含量的测定 测定方法参考李学鹏等[10]报道,并稍作修改。选取多只虾的第二腹节,混合后切碎,称取3 g样品,加入5倍体积10 mmol/L Tris-HCl(pH7.2)缓冲溶液,高速均质30 s后,4 ℃条件下5000 r/min离心10 min,取沉淀。重复以上操作3次,在最后一次沉淀中加入5倍体积10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl;pH7.2),取上清液即为制备的肌原纤维蛋白溶液,其含量采用考马斯亮蓝法进行测定。
1.2.5 质构特性的测定 参照祁雪儿等[11]实验方法,并稍作修改。选用TPA测量模型,测定虾肉硬度和弹性。设定参数为:P/50探头,测试前速度120 mm/min,测试速度60 mm/min,测后速度60 mm/min,测定部位中华管鞭虾第二腹节,样品形变量50%。采用FTC-PRO软件对虾肌肉产生的力和时间曲线进行分析,计算虾肉弹性和硬度。
1.2.6 水分含量的测定 参照GB 5009.3-2016直接干燥法,选取多只虾的第二腹节,混合后切碎,称取2 g样品(精确至0.0001 g)置于101~105 ℃烘箱中,通过干燥前、后重量变化,计算虾肌肉中水分含量。
1.2.7 亚细胞各组分的分离 参照邱恒恒[12]和李树红[13]报道方法,并稍作改进。选取多只虾的第二腹节,混合后切碎,取2 g虾肉,加入5倍体积缓冲液A(含100 mmol/L蔗糖、100 mmol/L KCl、50 mmol/L Tris、10 mmol/L Na4P2O7和1 mmol/L Na2EDTA;pH7.2),混合均质1 min;采用三层尼龙网过滤去除结缔组织,滤液采用差速离心法分离获得肌原纤维(4 ℃,1100×g,持续10 min),线粒体(4 ℃,3000×g,持续15 min)和溶酶体(4 ℃,16000×g,持续30 min);溶酶体经离心后所得上清液即为肌浆部分。将以上制备的各亚细胞组分,加入贮藏液B(含85 mmol/L CH3COONa,15 mmol/L CH3COOH以及1 mmol/L EDTA-2Na)后,立即检测组织蛋白酶H的活性。
1.2.8 组织蛋白酶H的酶活性的测定 采用试剂盒法测定各亚细胞组分中组织蛋白酶H的活性,操作过程依据试剂盒使用说明书进行。
1.2.9 SDS-PAGE分析 参照Laemmli[14]的方法,组装好已经清洗晾干的电泳槽各部件,检查是否漏水,待用。实验采用12%的分离胶及5%的浓缩胶,电极缓冲液含0.05 mol/L Tris,0.384 mol/L甘氨酸,0.1% SDS(pH8.3)。电泳采用1 mm凝胶板;标准蛋白标记(11~245 kDa);上样量为10 μL;电泳初始电压为80 V,待样品进入分离胶后改为120 V;电泳结束后,用考马斯亮蓝染色30 min,然后用不同比例的甲醇/冰醋酸脱色液脱至透明。电泳胶片置于凝胶成像仪摄像,结合Tanon软件进行分析和处理。
1.3 数据处理
以上样品测定均平行重复三次(n=3)。采用SPSS 17.0进行数据分析,不同处理组之间的差异性分析,采用多重比较分析法(Duncan法,P<0.05)。采用Origin 8.0对结果数据进行制图分析。
2 结果与分析
2.1 低温贮藏中华管鞭虾肌肉pH变化情况
pH是水产品鲜度评价的重要指标之一[15]。如图1所示,随着贮藏时间延长,完整虾和去头虾肌肉pH均呈不断上升的趋势。在0~6 d冷藏过程中,完整虾和去头虾肌肉pH分别从初始的7.05和7.08上升到7.82和7.65;在冻藏第120 d,二者肌肉pH分别上升至8.01和7.82。在低温贮藏过程中,外界污染微生物生长及其代谢产物、虾体内内源酶作用等造成肌肉蛋白质降解及氧化分解,致使肌肉中产生了氨和胺等碱性物质,因此导致了虾肌肉pH的上升[16-17]。在贮藏后期,完整虾组肌肉pH显著高于去头虾组(P<0.05),可能是由于随着贮藏时间延长,虾头中部分内源性蛋白酶迁移到肌肉组织,加快了虾肌肉蛋白质的降解速率,使其pH高于去头虾组[6]。
2.2 低温贮藏中华管鞭虾肌肉持水力变化情况
肌肉持水力表示肌肉组织阻碍其水分流失的能力,通常采用离心前后肌肉组织重量差表示其持水力的大小,即肌肉组织在离心过后重量变化大,则表示肌肉的持水能力较差[18]。如图2所示,随着贮藏时间延长,完整虾和去头虾组肌肉持水力均呈现出不断下降的趋势,且在贮藏后期,去头虾肌肉持水力均显著高于完整虾组(P<0.05)。贮藏第0 d,虾肉持水力为77.70%;经冷藏6 d后,完整虾和去头虾组肌肉持水力分别下降至65.87%和68.20%;而经冻藏120 d,二者分别下降至60.28%和64.83%,同时在40~120 d冻藏期内,肌肉持水力下降速率较快。在低温贮藏过程中,肌肉持水力的快速降低,可能主要是由于肌肉中内源蛋白酶(如组织蛋白酶H和D、钙蛋白酶及胰蛋白酶等)作用于肌原纤维蛋白,导致肌原纤维降解及收缩加剧,致使组织中相邻纤维之间空间变大,其中水分通过形成毛细管作用而不断流失[19]。Zhang等[20]研究也证实,肌肉中组织蛋白酶活性的大小和肌原纤维的分解程度密切相关,正是由于组织蛋白酶酶解作用导致了肌肉持水能力的降低。此外,在冻藏过程中,肌肉中内源酶活性虽受到一定程度的钝化或抑制,但冻结形成的冰晶颗粒挤压破坏肌纤维物理结构,也导致了肌肉组织持水能力的快速降低。在本实验中,尤其在冷藏及冻藏后期,去头虾肌肉组织持水力均显著优于完整虾组(P<0.05),这可能是由于虾头部存在大量内源酶对虾肌肉品质产生较大的影响;在较长贮藏期内,可能存在着某种迁移机制,进而影响虾肌肉组织的持水力等功能特性。

图2 冷藏(a)和冻藏(b)条件下中华管鞭虾肌肉持水力变化情况Fig.2 Changes of water holding capacity of red shrimp muscle during cold storage (a) and frozen storage (b)
2.3 低温贮藏中华管鞭虾肌肉肌原纤维蛋白含量变化情况
肌原纤维蛋白在虾肌肉中含量最高,在某种程度上其含量的高低即可表明虾肉品质变化情况[21]。如图3所示,随着贮藏时间延长,中华管鞭虾肌肉中肌原纤维蛋白含量一直呈下降趋势。贮藏第0 d时,虾肉中肌原纤维蛋白含量为57.42 mg/g;在0~4 d冷藏过程内,其下降速率较快,4~6 d时下降幅度逐渐减弱,在6 d时完整虾和去头虾组肌肉肌原纤维蛋白含量分别下降了38.32%和30.88%;在0~20 d冻藏过程内,其含量下降幅度较大,20~80 d时呈线性下降趋势,最后趋于平缓,而在冻藏120 d后,二者分别下降了61.67%和52.09%。这可能是由于随着贮藏时间的延长,虾肌肉中组织蛋白酶分解了肌原纤维蛋白,使得其蛋白含量逐渐下降[13]。在冷藏和冻藏后期时,完整虾组的肌原纤维蛋白含量均显著低于去头虾组(P<0.05),可能是由于实验中虾头内部分内源酶发生迁移,使得完整虾肌肉中组织蛋白酶活性高于去头虾组,导致其肌原纤维蛋白降解速率比去头虾组快[18]。
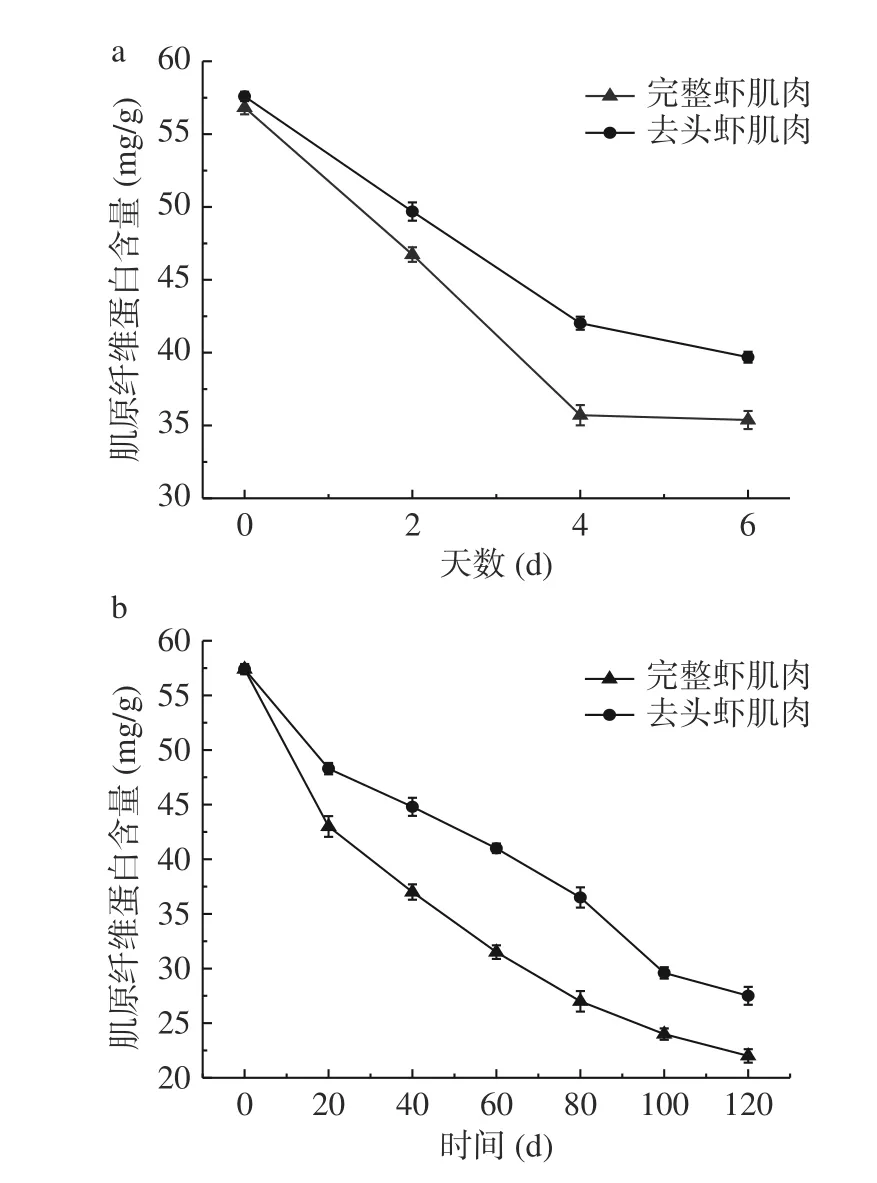
图3 冷藏(a)和冻藏(b)条件下中华管鞭虾虾肉肌原纤维蛋白变化情况Fig.3 Changes of myofibrillar protein of red shrimp muscle during cold storage (a) and frozen storage (b)
2.4 低温贮藏中华管鞭虾肌肉硬度和弹性的变化情况
硬度和弹性是影响水产品质构特性的主要因素,在贮藏过程中,肌肉间结合力的大小和肌纤维损伤,会导致肌肉的弹性和硬度发生改变[22]。如表1所示,贮藏第0 d,完整虾和去头虾组肌肉硬度分别为19.24和19.33 N;经冷藏至6 d时,二者分别下降至16.12和17.31 N;经冻藏至120 d时,二者分别下降至16.73与18.50 N。贮藏第0 d时,完整虾和去头虾组肌肉的弹性为2.01和1.98 mm;冷藏至6 d时,其肌肉弹性分别降至1.24和1.38 mm;冻藏至120 d时,二者分别降至1.70和1.77 mm。随着冷藏周期的延长,虾肌肉的硬度和弹性均呈现不断下降的趋势,而在冻藏期间其硬度和弹性出现了先上升后下降的趋势;在贮藏后期,完整虾组的硬度和弹性显著低于去头虾组(P<0.05)。该现象推测可能是由于在冷藏过程中,中华管鞭虾肌肉蛋白氧化速度加快,肌肉细胞间结合力减小,从而使得虾组织结构崩解[22]。在冻藏前期虾肌肉硬度和弹性的上升,可能是由于细胞中自由水的流失,使得肌原纤维密度变大,从而导致虾体肌肉硬度和弹性增大[23]。但随着贮藏时间延长,肌原纤维蛋白被蛋白酶降解以及冻藏期间冰晶的出现破坏了胶原结构,因此二者的硬度和弹性又逐渐降低[24]。此外,Bahuaud等[25]研究表明,冻藏条件下质构特性与组织蛋白酶活性呈负相关关系,即肌肉中组织蛋白酶活性越高,硬度及弹性下降得越多。因此,在完整虾组贮藏期间,可能发生了虾头内组织蛋白酶的迁移,引起完整虾组肌肉中组织蛋白酶活性上升幅度大,加快了完整虾组硬度和弹性劣变速率。

表1 冷藏和冻藏条件下中华管鞭虾虾肉质构特性变化情况Table 1 Changes of muscle texture characteristics of shrimps(Solenocera crassicornis) during cold storage and frozen storage
2.5 低温贮藏中华管鞭虾肌肉水分含量变化情况
如图4所示,随着贮藏周期延长,虾肌肉的水分含量呈不断下降趋势,且在贮藏后期,完整虾组肌肉的水分含量显著低于比去头虾组(P<0.05)。贮藏第0 d时,完整虾组和去头虾组肌肉的水分含量为77.35%和77.30%;经冷藏6 d后,其分别下降4.74%和3.89%;而经冻藏120 d后,二者分别下降12.62%和10.67%。在贮藏过程中,虾肌肉的肌原纤维会被组织蛋白酶快速分解,导致其含量下降,细胞间空隙变大,加剧了水分流失[18]。此外,李玲等[26]发现肌肉中蛋白质的氧化降解,以及在贮藏过程中冰晶的形成均会对细胞膜产生破坏,使细胞中水分在渗透压的作用下流出,最终导致其水分含量降低。在本研究中,完整虾组肌肉水分含量一直低于去头虾组,可能是由于在完整虾组贮藏期内,虾头中内源性蛋白酶存在某种迁移机制,使完整虾组中内源酶活性高于去头虾组,加快了蛋白氧化和肌纤维的降解,导致虾肌肉的水分含量快速下降。

图4 冷藏(a)和冻藏(b)条件下中华管鞭虾肌肉水分含量变化情况Fig.4 Changes of moisture content of red shrimp muscle during cold storage (a) and frozen storage (b)
2.6 低温贮藏中华管鞭虾肌肉不同亚细胞组分中组织蛋白酶H变化情况
组织蛋白酶H是一种内肽-氨肽酶,在贮藏过程中,其活性的上升会加快虾体肌原纤维结构劣化速率,从而影响虾肌肉品质[27-28]。如图5b和图6b所示,随着贮藏周期延长,整虾和去头虾组溶酶体中组织蛋白酶H活性呈不断下降的趋势,在冷藏6 d和冻藏120 d后分别下降14.04%、11.29%和56.96%、61.12%。这可能主要是由于虾体死后,细胞内溶酶体膜失稳而发生破裂,导致溶酶体中组织蛋白酶被释放出去,转移到了其它细胞组织中[9]。而在冻藏过程中,冰晶的生成加速了组织的破裂,溶酶体中组织蛋白酶转移速度加快,这导致其活性快速下降[12]。细胞线粒体中组织蛋白酶H活性变化情况,如图5c和图6c所示,在0~2 d冷藏过程中,二者下降幅度较小,2 d后开始快速下降;而在冻藏过程中出现先上升后下降的趋势。该现象推测可能是由于溶酶体破裂后,其中的组织蛋白酶转移到线粒体中,使得线粒体中酶活性稍微上升,随着组织蛋白酶接触并破坏线粒体结构,促使线粒体发生凋亡现象,最终导致整体酶活性呈下降趋势[29-30]。在肌原纤维中组织蛋白酶H活性变化情况(图5a和图6a),与线粒体中变化趋势大致相似。在贮藏初期,组织蛋白酶H活性呈上升趋势,这可能也与溶酶体的分解有关。肌浆中组织蛋白酶H活性变化情况,如图5d和图6d所示,在冷藏过程中,完整虾和去头虾组肌浆中组织蛋白酶H活性呈不断下降趋势;而在冻藏过程中,两者酶活性呈先上升后下降再上升的趋势,且在贮藏后期,去头虾组肌浆中组织蛋白酶活性显著低于完整虾组(P<0.05),在冷藏6 d和冻藏120 d后两者酶活性分别下降6.97%、14.00%和12.26%、22.43%。这可能主要是由于在贮藏前期,溶酶体的破裂使其中组织蛋白酶释放到肌浆中;在20~80 d冻藏过程中,组织蛋白酶活性受低温抑制逐渐减少;而在冻藏80 d后,酶活性逐渐上升,这可能是由于在冻藏80 d后低温对酶活性的抑制能力降低,从而导致组织蛋白酶活性的上升,这与柳佳彤[31]的研究结论相似。在本研究中,完整虾组肌肉的酶活性在贮藏前期明显高于去头虾组,推测可能是由于在贮藏过程中,虾头内组织蛋白酶存在某种迁移机制,使得虾头部中的酶转移到虾肌肉中。

图5 冷藏下中华管鞭虾虾肉各亚细胞组分中组织蛋白酶H的活性变化情况Fig.5 Changes of cathepsin H activity in subcellular components of red shrimp muscle during cold storage

图6 冻藏下中华管鞭虾虾肉各亚细胞组分中组织蛋白酶H的活性变化情况Fig.6 Changes of cathepsin H activity in subcellular components of red shrimp muscle during frozen storage
2.7 SDS-PAGE凝胶电泳分析
SDS-PAGE能够检测虾肌原纤维蛋白在不同贮藏方式下降解情况。研究表明,在贮藏过程中,部分蛋白质如肌球蛋白重链(MHC,~180 kDa)、副肌球蛋白(~110 kDa)、肌动蛋白(~45 kDa)、肌钙蛋白T(~34 kDa)和肌球蛋白轻链(MLC,~17 kDa),变化相对明显[32-33]。中华管鞭虾完整虾和去头虾肌原纤维蛋白的变化如图7所示,在不同贮藏方法下蛋白质图谱存在明显差异。新鲜虾(A)的蛋白条带最清晰,冷藏6 d(B、C)、冻藏120 d(D、E)后,MHC、肌钙蛋白和MLC等蛋白条带强度下降,肌动蛋白无明显变化。这是由于虾肌肉中蛋白在贮藏过程中发生降解,从而影响其结构特性。而肌肉肌原纤维蛋白的水解被认为与肌肉质量和内源酶活性的变化有关,并已证明其会损害肌肉纤维结构,且与肌肉硬度和弹性的降低有关[34]。Bhat等[35]研究表明,在肌肉中,MHC被认为是最容易降解的蛋白质,而低于MHC的90和110 kDa蛋白带的强度则被认为是肌球蛋白重链蛋白水解的指标。从图中可以发现,副肌球蛋白等盐溶性蛋白在贮藏一段时间后蛋白条带强度明显变弱,且完整虾组蛋白条带变化更为明显。这可能是由于在低温冻藏下,冰晶的形成使得肌肉组织中水分减少,使未被冻结的细胞液浓缩,从而使离子强度和pH发生很大的变化,有机溶剂和金属盐的浓度也相对增大,最终导致蛋白发生冷冻变性,其含量下降[22]。同时实验表明,在不同的贮藏方法下,虾肌肉中内源酶活性的升高加快了肌肉蛋白的降解速度,从而导致大多数蛋白条带的强度降低。这些结果论证了上述关于肌原纤维蛋白含量、酶活性、质构等的研究结果。
3 结论
本文通过对中华管鞭虾在不同贮藏方式下肌肉品质及不同亚细胞结构中蛋白酶活性的研究发现,随着贮藏周期的延长,中华管鞭虾肌肉的pH不断升高,水分含量、持水力和肌原纤维蛋白含量不断下降,其硬度和弹性均呈先上升后下降趋势;在冻藏方式下,虾肉劣化速度慢于冷藏,且虾在去头后,其部分蛋白降解速率低于完整虾;同时在不同亚细胞组分中,完整虾组肌肉酶活性在贮藏前期均明显高于去头虾组。由此可以得出,低温冻藏下去头的方式更适合中华管鞭虾的贮藏。
