铁死亡在胃癌中的研究进展*
2021-11-13综述李雪梅范红平樊玉娟赵卫东审校
王 黎 综述,严 萍,李雪梅,范红平,樊玉娟,赵卫东△ 审校
1.大理大学临床医学院,云南大理 671000;2.大理大学第一附属医院,云南大理 671000
胃癌(GC)是一种常见的消化系统肿瘤。据2018年全球癌症数据统计,胃癌的发病率在恶性肿瘤中排第5位,病死率排在第3位[1]。胃癌的危险因素包括幽门螺杆菌感染、年龄、吸烟、饮酒、饮食、EB病毒感染、遗传背景等[2]。然而,胃癌的发生、发展机制尚未完全明确,深入了解胃癌的发病机制将有助于寻找药物作用的新靶点,提供新的临床治疗途径。目前,随着细胞死亡相关研究的深入,铁死亡作为一种新型调节性细胞死亡模式逐渐受到关注。铁死亡在形态学、分子机制、免疫特征上不同于其他类型的细胞死亡,如凋亡、程序性坏死、自噬等[3]。已有文献证明,铁死亡参与多种癌症的调节,包括胃癌[4]。但目前铁死亡与胃癌相关的研究仍较少,因此,本文就铁死亡的机制以及与胃癌的相关研究进展作一综述。
1 铁死亡
2 铁死亡机制
3 铁死亡与肿瘤
4 铁死亡与胃癌
4.1铁异常与胃癌 铁是人类生活的基本元素,只有一小部分膳食铁被吸收。体内的铁含量通常通过测量游离铁、铁蛋白、总铁结合力(TIBC)和转铁蛋白饱和度(TS)来评估。铁主要与血红蛋白结合,大约30%的铁以铁蛋白的形式储存。铁蛋白代表肝脏、脾脏和骨髓中的铁水平,在缺铁时减少,在肝病、感染、炎症等疾病中增加[21]。
研究表明身体铁状况与胃癌风险之间存在负相关,铁蛋白被认为是体内储存铁的最具特异性的分子[22]。铁负荷太大会导致DNA损伤,从而增加致癌风险。然而,也有证据表明,缺铁和贫血也可能导致氧化应激水平和DNA损伤增加,增加致癌风险,特别是一些铁依赖的正常生物过程和代谢途径因缺铁而功能异常(例如癌症激活细胞的免疫反应、毒物的新陈代谢,以及DNA生物合成和修复的氧化还原调节过程)[23]。血清铁蛋白以及其他铁代谢标志物与胃癌发生风险呈负相关,这可能与胃癌早期病变导致的出血以及慢性胃炎引起的酸中毒或低氯血症有关。这些因素和机体铁状态在胃癌发生中的相互作用还需要进一步的研究。
Perilipin2(PLIN2)又称脂肪分化相关蛋白(AdRP),免疫组化显示PLIN2在胃癌组织中显著过表达。有研究发现,PLIN2是抑制胃癌脂代谢异常所致的铁死亡过程中不可或缺的蛋白。PLIN2通过调节转录因子PRDM11和IPO7下调ACSL3、ALOX15、LC3A、PRDM11的表达来调节铁死亡途径[27]。经PLIN2刺激后IPO7水平升高,作为胃癌基因和细胞输入蛋白,为细胞增殖提供能量,抵抗铁死亡。因此,PLIN2可能成为一种潜在的胃肿瘤诊断和治疗靶点的生物标志物,特别是在肥胖患者肿瘤的预测方面。
microRNA(miRNA)在包括胃癌在内的多种恶性肿瘤的发生、发展中起着重要的作用[28]。一些研究已经探索了miRNA在癌症中的治疗靶点,miRNA能够引起铁死亡也已经得到证实[29]。有研究发现,miR-103a-3p可作为恶性肿瘤早期诊断的生物标志物,miR-103a-3p在胃癌中表达上调,抑制miR-103a-3p的表达会使患者有更好的预后[30]。敲除miR-103a-3p靶向分子谷氨酰胺酶2(GLS2)能够抑制细胞活力,促进胃癌细胞铁死亡。miR-103a-3p对GLS2表达的下调在胃癌中发挥抗肿瘤作用。这些发现为胃癌的治疗提供了新的治疗靶点。
环状RNA(CircRNAs)是一系列具有闭合环状结构的非编码RNA。CircRNA在调节包括胃癌在内的多种人类癌症的进展过程中起着至关重要的中介作用。比如Circ-SFMBT2在胃癌中增加,并且Circ-SFMBT2的增加促进了胃癌细胞的发展[31]。Circ-104916通过抑制细胞生长和转移而在胃癌的发展中发挥抑制作用[32]。研究发现,Circ-0008035在胃癌组织和细胞中表达升高,促进了胃癌细胞的生长。在Erastin或RSL3处理的胃癌细胞中,在Circ-0008035基因敲除后细胞发生铁死亡,细胞内铁、过氧化脂质、ROS升高,线粒体膜电位降低[33]。还有研究表明,Circ-0008035通过与miR-375相互作用促进胃癌的发生[34]。
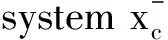
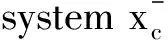
猕猴桃根(ACP)是一种中草药,猕猴桃属植物猕猴桃的根,具有抗肿瘤、免疫调节等功能,是已被批准的临床抗肿瘤药物。然而,ACP对胃癌耐药的具体机制尚不清楚。研究发现,ACP通过抑制Gpx4和SLC7A11蛋白而增加ROS的积累,调节细胞铁死亡[39]。丹参酮ⅡA是从中草药丹参根茎中分离得到的一种活性药理成分。已有报道显示丹参酮ⅡA对胃癌具有抗癌作用,能够影响胃癌AGS细胞的糖代谢,通过抑制表皮生长因子受体(EGFR)、胰岛素样生长因子受体(IGFR)、血管内皮生长因子受体(VEGFR)的表达,阻断PI3K/Akt/mTOR、Ras/Raf/MEK/ERK信号通路,抑制胃癌AGS细胞的生长[40]。丹参酮ⅡA促进了脂质过氧化,上调了铁死亡的两个标志物Ptgs2和Chac1的表达,导致细胞内谷胱甘肽和半胱氨酸水平下降,细胞内ROS水平升高,P53基因敲除可减弱其诱导的脂质过氧化和铁死亡[41]。因此,丹参酮ⅡA可能通过诱导P53上调而增强其介导的铁死亡来抑制胃癌的增殖。
5 小 结
铁死亡作为新发现的细胞死亡模式是目前研究的热点,关于铁死亡的生物学机制已经开展了许多研究。然而,铁死亡与肿瘤之间的关系仍然有待进一步研究,特别是在肿瘤微环境以及肿瘤免疫的相关领域。胃癌作为在我国发病率和病死率均第2位的恶性肿瘤,其发生、发展机制和诊断、治疗都被密切关注。本文阐述了铁死亡的相关机制以及与肿瘤发生、发展的关系,总结了目前胃癌相关生物分子介导的铁死亡过程以及一些作用于铁死亡途径的药物,为以后铁死亡的机制研究以及胃癌的治疗提供帮助。
