胰腺导管腺癌组织中miR-27、E2F7的表达及临床意义*
2021-11-13张武超寇学斌许春进舒闪闪
张武超,寇学斌△,许春进,舒闪闪
1.新乡医学院附属商丘市第一人民医院消化内科,河南商丘 476000;2.河南省商丘市妇幼保健院检验科,河南商丘 476003
胰腺癌是高度恶性的消化系统恶性肿瘤,全球每年发病人数达33.8万,死亡人数达33.1万,病死率极高,预后极差,5年总体生存率(OS)约为8%[1]。胰腺癌病理类型包括胰腺导管腺癌、腺鳞癌及多形性癌等。胰腺导管腺癌是最常见的病理类型,目前临床上的治疗方法有手术、化疗及生物治疗等,但胰腺癌患者早期无典型的临床表现,一经确诊已为晚期,失去最佳的治疗机会[2]。近年来分子生物学的发展,为胰腺导管腺癌的临床诊断及治疗提供新的方向。微小RNA(miR)是长度为18~25个核苷酸的RNA分子,本身不具有编码蛋白的功能,能与靶基因mRNA的3′非翻译(UTR) 区结合,降低 mRNA的稳定性,影响靶基因转录[3]。miR-27基因位于人类染色体19p13.12,研究发现,肝癌[4]、结直肠癌[5]等肿瘤中存在miR-27异常表达下调的现象,其作为一种抑癌基因,能够抑制下游癌基因K-ras的表达,发挥抑制肿瘤细胞增殖和转移的作用,而其表达下调参与促进肿瘤的发生、发展。E2F转录因子7(E2F7)编码基因位于12q21.2,该基因编码E2F7蛋白,属于E2F转录因子家族成员,调节哺乳动物细胞增殖、分化和凋亡等生物学过程。研究表明,E2F7在宫颈癌[6]、肝癌[7]等恶性肿瘤中发挥致癌基因的功能,其促进肿瘤细胞G1/S期的转换,导致肿瘤细胞的无限增殖,促进肿瘤进展。范源等[8]研究表明,细胞中miR-27的表达下调伴随着E2F7的上调,而敲低miR-27则促进E2F7的表达,因而miR-27和E2F7可能存在负反馈回路,影响肿瘤的发生、发展。本研究通过研究miR-27和E2F7在胰腺导管腺癌中的表达,探讨miR-27和E2F7的临床价值。
1 资料与方法
1.1一般资料 选取2018年1月至2019年1月在在新乡医学院附属商丘市第一人民医院诊治的93例胰腺导管腺癌患者的资料。纳入标准:(1)经病理学检查确诊为胰腺导管腺癌;(2)初次诊治,无化疗、放疗病史;(3)患者能够配合随访,随访资料完整。排除标准:(1)合并胃肠道感染性疾病;(2)有其他恶性肿瘤病史;(3)合并心、肺、肾等脏器功能障碍。93例胰腺导管腺癌患者中男52例,女41例;年龄38~75岁,平均(51.23±6.1)岁,≤60岁40例,>60岁53例;肿瘤分期:Ⅰ期34例,Ⅱ~Ⅲ期59例;病理分级:高分化30例,中低分化63例;肿瘤最大径:≤2 cm 52例,>2 cm 41例;肿瘤位置:胰头51例,胰体、胰尾42例;伴淋巴结转移44例,无淋巴结转移49例。所有患者自确诊之日起开始随访,以电话方式随访,每个月进行一次随访,随访内容为患者生存情况,随访时间截止至2020年2月,随访终点为患者死亡或随访结束。本研究经新乡医学院附属商丘市第一人民医院伦理委员会审核批准。
1.2方法
1.2.1实时荧光定量PCR(qPCR)检测miR-27、E2F7基因的表达 收集新鲜获取(术中获取标本,标本离体30 min以内)的癌组织及癌旁组织(距离癌组织边缘0.5 cm以上),-80 ℃保存。应用Trizol提取癌组织及癌旁组织中的RNA,Narodrop检测RNA水平。以组织中RNA为模板,进行反转录,形成cDNA,进行qPCR检测。miR-27引物正向序列:5′-TGGTGGCAGTAGAGGCTATG-3′,反向序列:5′-AGTCCAGGCCAGTATGTTAC-3′;内参U6正向序列:5′-CTCGCTTCGGCAGCACA-3′,反向序列:3′-AACGCTTCACGAATTTGCGT-5′。E2F7正向序列:5′-AATGCAGTGGTTGTTTCTGT-3′,反向序列:5′-TGCCATTGCTTCTTCACTAC-3′;内参GAPDH正向序列:5′-GGGAAACTGTGGCGTGAT-3′,反向序列:5′-GAGTGGGTGTCGCTGTTGA-3′。总体系20 μL:cDNA 1 μL,Taq聚合酶0.2 μL、上下游引物各1 μL、SYBR Greenpremix 10 μL及1 μL浓度为20 mmol/L的dNTPs,DEPC水5.8 μL。qPCR反应条件:50 ℃活化2 min,95 ℃ 预变性2 min,95 ℃ 变性15 s,60 ℃ 退火32 s,70 ℃延伸10 s,共40个循环。采用2-ΔΔCt法计算miR-27、E2F7 mRNA的相对表达水平。
1.2.2免疫印迹检测组织中E2F7蛋白表达 将50 mg的癌组织及癌旁组织冰上研磨,加入含苯甲基磺酰氟(PMSF)的RIPA裂解液,裂解0.5 h,提取组织蛋白。蛋白BCA法定量后,加SDS上样缓冲液,95 ℃金属浴煮样10 min。SDS-PAGE 胶电泳:浓缩胶恒压80 V,分离胶恒压130 V,然后进行湿转法转膜,恒流250 mA转印90 min。将PVDF 膜放入5%脱脂奶中封闭2 h,TBST洗3遍,每次5 min,一抗4 ℃孵育过夜(E2F7单克隆抗体购自Abcam,货号:56022),二抗室温孵育1 h。ECL暗室显影照相。
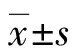
2 结 果
2.1组织中miR-27、E2F7的表达 癌组织中miR-27的相对表达水平为0.425±0.081,在癌旁组织中为1.370±0.225,癌组织中miR-27的相对表达水平明显低于癌旁组织(t=38.109,P<0.001);癌组织中E2F7基因的相对表达水平为1.755±0.306,在癌旁组织中为0.317±0.094,癌组织中E2F7基因的相对表达水平明显高于癌旁组织(t=43.321,P<0.001),见图1A。免疫印迹结果显示,E2F7蛋白在癌组织和癌旁组织中的相对灰度值分别为2.147±0.421、0.308±0.019,癌组织中E2F7蛋白相对灰度值明显高于癌旁组织(t=42.082,P<0.001)。见图1B。以癌组织中miR-27相对表达水平的均值0.425为界,miR-27高表达组45例,miR-27低表达组48例;以癌组织中E2F7基因相对表达水平的均值1.755为界,E2F7基因高表达组44例,E2F7基因低表达组49例。
2.2癌组织中miR-27、E2F7基因的表达的相关性及相互作用预测 Pearson线性相关分析结果,癌组织中miR-27与E2F7基因的相对表达水平呈负相关(r=-0.612,P<0.001),见图2。采用TargetScan Human7.2在线软件(http://www.targetscan.org/vert_72/)预测miR-27与E2F7基因的结合位点,结果显示E2F7基因的3′非编码区第788~795个碱基存在与miR-27相互作用的位点,见图3。
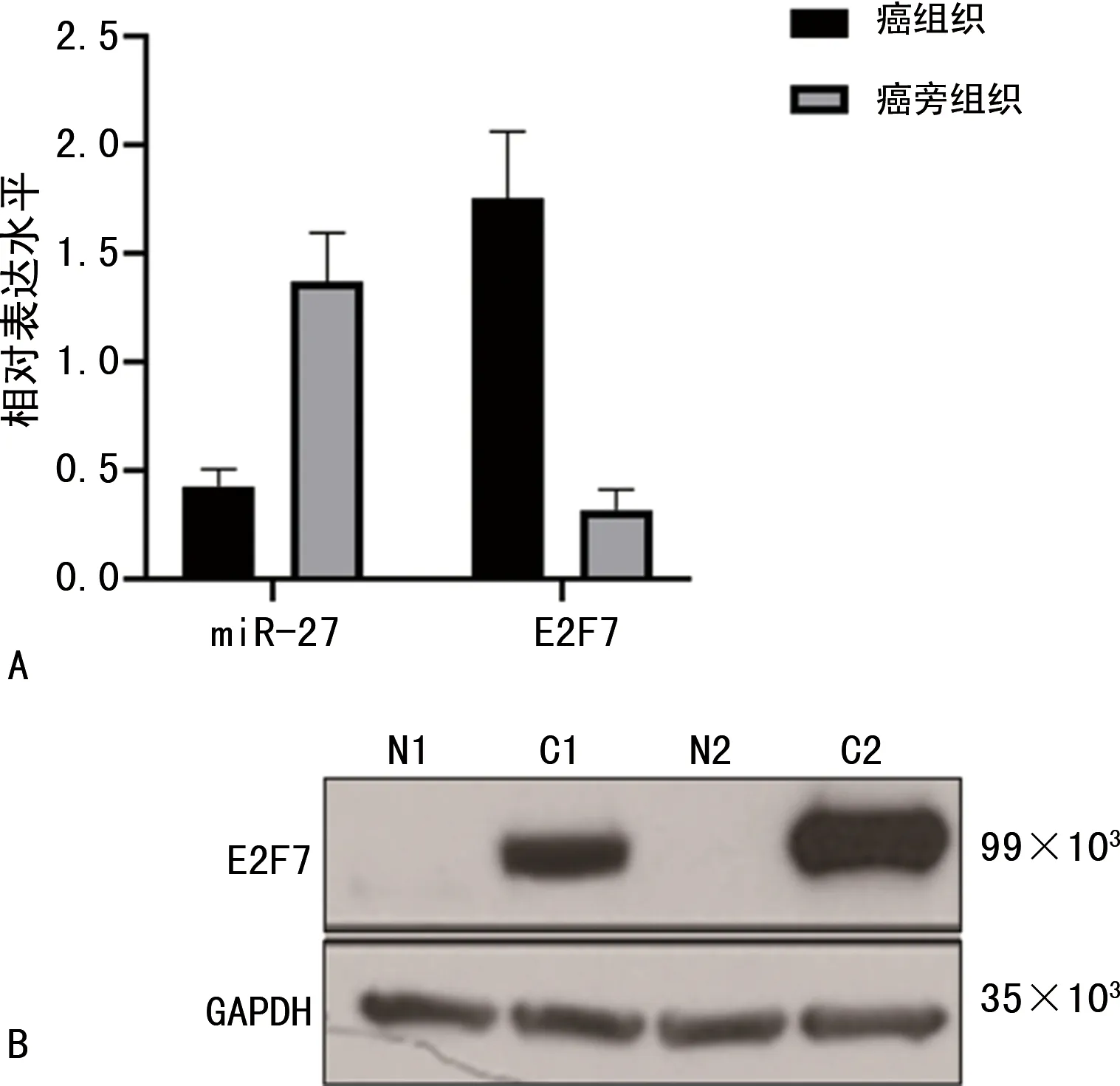
注:A表示癌组织与癌旁组织中miR-27与E2F7 mRNA相对表达水平比较;B表示癌组织与癌旁组织E2F7蛋白表达比较。N1为病例1癌旁组织,C1为病例1癌组织;N2病例2癌旁组织,C2为病例2癌组织。
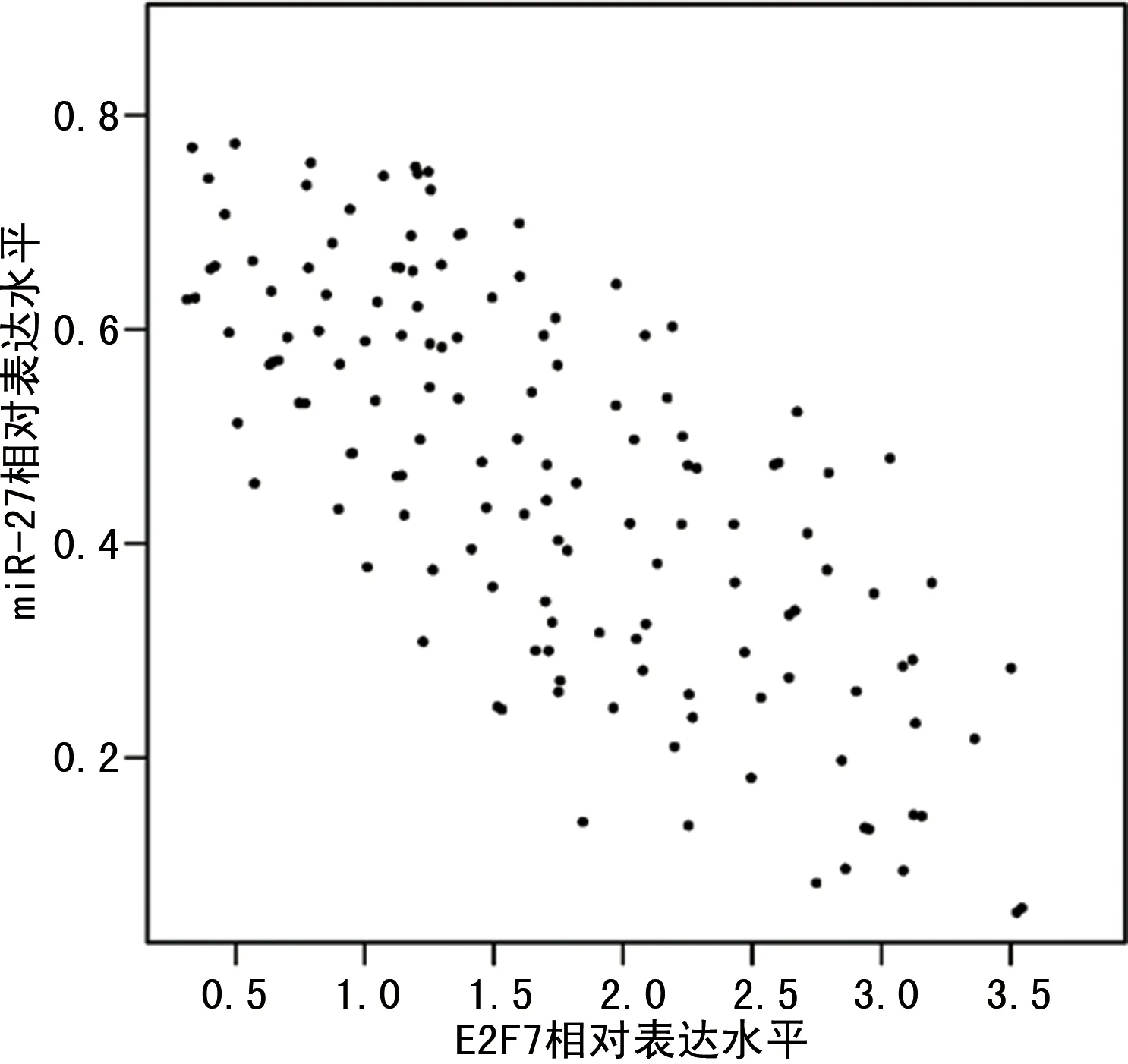
图2 癌组织中miR-27与E2F7基因表达的相关性

图3 生物信息学在线软件预测miR-27与 E2F7基因的结合位点
2.3癌组织中miR-27、E2F7基因的相对表达水平与临床病理特征的关系 不同肿瘤TNM分期、有或无淋巴结转移的胰腺导管腺癌患者癌组织中miR-27与E2F7基因相对表达水平差异均有统计学意义(P<0.05),而不同性别、年龄、病理分级、肿瘤最大径、肿瘤位置的患者癌组织中miR-27与E2F7基因相对表达水平差异均无统计学意义(P>0.05)。Ⅱ~Ⅲ期、有淋巴结转移的患者癌组织中miR-27的相对表达水平均明显低于Ⅰ期、无淋巴结转移的患者(P<0.05);Ⅱ~Ⅲ期、有淋巴结转移的患者癌组织中E2F7基因相对表达水平均明显高于Ⅰ期、无淋巴结转移的患者(P<0.05),见表1。
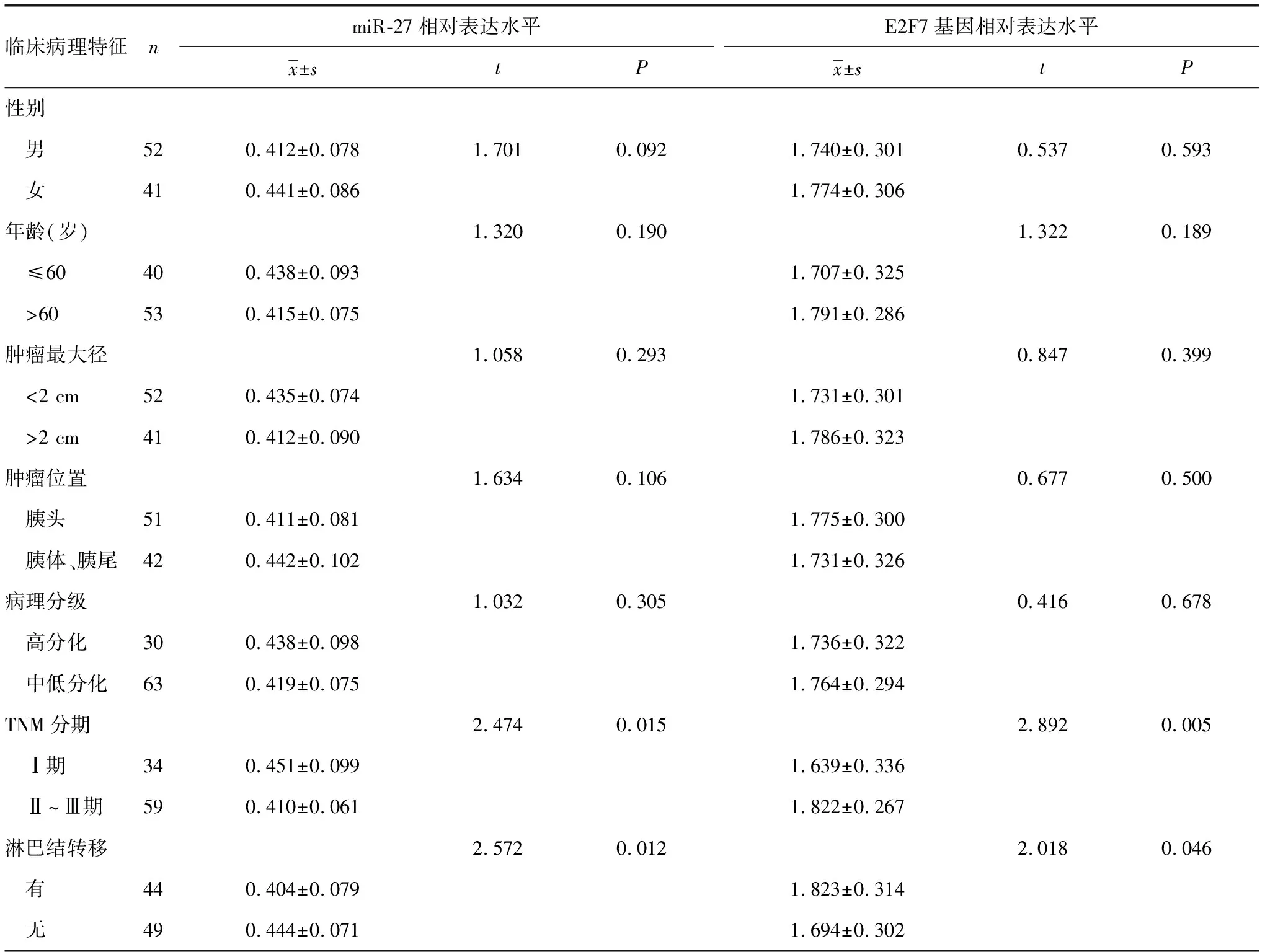
表1 癌组织中miR-27、E2F7基因相对表达水平与患者临床病理特征的关系
2.4癌组织中miR-27与E2F7基因的不同表达与患者预后的关系 所有患者出院后随访2~12个月,中位随访时间7个月,随访结束时死亡62例,1年OS为33.3%(31/93)。miR-27高表达组及低表达组患者的1年OS分别为51.1%(23/45)、16.7%(8/48),miR-27低表达组患者1年OS明显低于高表达组患者(χ2=5.129,P=0.015)。E2F7基因高表达组及低表达组患者的1年OS分别为13.6%(6/44)、51.0%(25/49),E2F7基因高表达组患者1年OS明显低于低表达组患者(χ2=6.514,P=0.002),见图4。
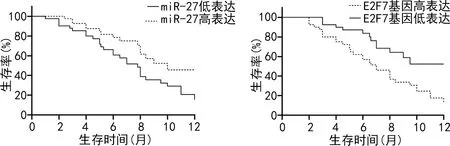
图4 miR-27、E2F7基因不同表达患者的预后比较
3 讨 论
目前胰腺导管腺癌的病死率高,该病病因及发病机制尚不清楚[9]。目前认为,遗传因素、环境因素等引起的分子遗传学改变是胰腺导管腺癌发生、发展的重要机制,大量癌基因的激活或(和)抑癌基因的失活,促进了肿瘤的恶性进展[10]。深入探讨胰腺导管腺癌发生、发展的机制,对于寻找新的诊断治疗方案具有重要的临床价值。
miR-27基因位于人类19号染色体。研究表明,肿瘤中miR-27作为一种抑癌基因,miR-27的表达下调可促进了癌基因ATG10的表达,导致肿瘤的恶性增殖及转化[11]。本研究发现,癌组织中miR-27的表达水平下调,其机制尚不清楚,可能与长链非编码RNA(LncRNA)对miR-27的表达调控有关。LI等[12]研究表明,LncRNA SNAI3-AS1本身可作为分子支架结合miR-27分子,同时抑制miR-27基因的表达,导致下游癌基因PEG10表达上调,促进肿瘤细胞的增殖及转移。此外,本研究发现,Ⅱ~Ⅲ期、有淋巴结转移的患者癌组织中miR-27表达较低,表明miR-27的低表达促进胰腺导管腺癌的恶性进展。其机制可能与miR-27的抑癌基因功能有关。YILMAZ等[13]学者发现,miR-27能够结合肿瘤中重要的癌基因K-ras mRNA的3′UTR区,抑制K-ras的表达,miR-27表达水平的降低导致K-ras过度激活,促进肿瘤细胞的恶性增殖,导致肿瘤分期升高。此外,有研究发现,血管内皮生长因子(VEGF)是miR-27的直接作用靶点,肿瘤中miR-27的表达下调促进VEGF的分泌,促进肿瘤血管及淋巴管的生成,增强肿瘤细胞的迁移能力,导致淋巴结转移[14]。本研究中miR-27低表达组患者的1年OS较低,表明胰腺导管腺癌组织中miR-27的低表达与患者的不良预后关系密切,有望成为判断患者预后的分子指标。
转录因子E2F7是促进细胞生长的重要因素,参与调控细胞周期、肿瘤血管生成和DNA的损伤修复等生理学过程。E2F7属于非典型E2F因子家族成员,包含两个单独的DNA结合结构域,通过DNA结合结构域与靶标的启动子位点结合,促进下游靶基因的表达[15]。有研究表明,E2F7作为一种癌基因,在胃癌、肝癌和头颈部癌等恶性肿瘤中表达上调,并通过激活c-myc等基因的表达,促进肿瘤的增殖[16]。本研究表明,胰腺导管腺癌组织中E2F7的表达升高,可能与E2F7转录后表达调控异常有关。XU 等[17]研究发现,E2F7受到miR-10b的转录后表达调控,miR-10b能够结合E2F7的mRNA,降低E2F7mRNA的稳定性,抑制E2F7的表达,而肿瘤发生时miR-10b的表达水平降低,导致E2F7 的表达上调。本研究中,E2F7基因的表达与较高的肿瘤TNM分期及淋巴结转移有关,表明E2F7的高表达促进胰腺导管腺癌的恶性进展。其原因可能与E2F7对肿瘤细胞周期的调控有关。有研究表明,E2F7的表达上调能够通过抑制P53基因介导的凋亡信号传导通路的传导,抑制肿瘤凋亡,促进肿瘤恶性增殖,导致分期升高[18]。研究表明,E2F7的水平升高能够降低细胞基因组的不稳定性,抑制与基因组稳定性有关的基因(如53BP1)的表达,导致DNA损伤修复障碍,促进肿瘤细胞恶性进展[19]。本研究中,E2F7基因高表达的胰腺导管腺癌患者1年OS较低,表明E2F7基因的高表达能反映患者的不良预后。 此外,癌组织中miR-27与E2F7基因的表达呈显著负相关,本研究同时采用生物信息学预测,结果两者存在潜在的结合位点,提示E2F7基因可能受到miR-27的转录后表达调控。目前胰腺导管腺癌中两者间的相互作用机制尚不明确,有学者在成肌细胞发现miR-27能够结合并抑制E2F7的表达,进而抑制细胞的增殖[8]。
综上所述,胰腺导管腺癌组织中miR-27表达降低,E2F7基因和蛋白表达升高,miR-27与E2F7基因表达呈明显负相关,且miR-27、E2F7基因的表达与胰腺导管腺癌患者的肿瘤TNM分期及淋巴结转移有关,癌组织中miR-27低表达及E2F7基因高表达的患者预后较差,两者有望成为新的胰腺导管腺癌分子标志物,但两者的作用机制及临床价值有待深入研究。
