鸡柔嫩艾美耳球虫HP基因的真核表达及其对鸡巨噬细胞凋亡的影响
2021-11-11许中衎王黎霞张榕珍张一弛潘晨帆张建军
许中衎 , 王黎霞,张榕珍,张一弛,芳 卉,潘晨帆,张建军,安 健
(1.北京农学院动物科学技术学院 国家级动物类实验教学示范中心,北京 昌平 102206;2.北京农业职业学院畜牧兽医系,北京 房山 102442)
鸡球虫病是由艾美耳属的单种或多种鸡球虫引起的主要侵袭鸡肠道的全球性寄生虫病,是严重危害我国养禽业的常见疾病之一。经统计,全球养禽业每年因球虫感染造成的经济损失高达20亿美元[1]。细胞凋亡是由基因调控的细胞自主性死亡的过程[2],它对于多细胞生物个体生长发育的正常进行,机体生长发育,自稳平衡的保持,维持组织稳态,抵御外界各种因素的干扰及在胚胎发育、造血、免疫系统的成熟,还有维护正常组织和器官的细胞恒定与生长平衡、乃至机体衰老方面都起着重要的作用[3]。本实验室前期研究发现,柔嫩艾美耳球虫(Eimeriatenella,E.tenella)会抑制宿主细胞的凋亡[4-5]。
HP基因编码的蛋白是由本实验室前期工作发现的一种柔嫩艾美耳球虫的外分泌蛋白,目前尚无该基因及其编码的蛋白的相关功能研究论文的发表。前期对其进行的生物信息学分析发现,该蛋白有望成为重要的潜在药物靶点或疫苗候选抗原。
本试验旨在构建重组真核表达质粒pEGFP-HP,将其转染至细胞内,观察HP基因对细胞凋亡的影响,探究HP基因是否为柔嫩艾美耳球虫促进宿主细胞凋亡的主要作用蛋白。本试验为进一步研究HP基因的生物学功能及其作用机制提供了依据。
1 材料与方法
1.1 试验材料
1.1.1 试验虫株与细胞E.tenellaB4株,由北京农学院病理实验室提供,分离自昌平某鸡场,复壮周期为3个月;HD11细胞,本实验室保存用于鸡球虫研究的贴壁细胞系。
1.1.2 试验动物 1日龄农大3号公雏鸡,将其饲喂于无球虫及其他病原环境中,使用不含抗球虫药的雏鸡饲料,饲喂至14日龄,期间自由采食。
1.1.3 主要试剂 荧光真核表达载体pEGFP-N1,购自上海索莱宝生物科技有限公司;E.coliDH5α感受态细胞,购自北京中美泰和生物技术有限公司;TRIzol试剂,购自美国赛默飞世尔科技公司;2×TaqDNA聚合酶,购自北京康为世纪生物科技有限公司;DNA Marker,购自北京天根生化科技有限公司;反转录试剂盒、质粒提取试剂盒、凝胶回收试剂盒,均购自美国TaKaRa公司;限制性内切酶SacⅠ/EcoR Ⅰ、DNA连接酶,均购自美国NEB公司;无内毒素质粒大量提取试剂盒,购自美国Omega Bio-Tek公司;LipofectamineTM2000 Transfection Reagent,购自美国赛默飞世尔科技公司;DMEM高糖培养基,购自赛默飞世尔科技公司;Annexin V-Alexa Fluor 647/PI 凋亡检测试剂盒,购自北京友谊中联生物科技有限公司。
1.2 方法
1.2.1 引物合成 在NCBI上找到目的基因的mRNA序列,导入DNAMAN软件分析酶切位点,导入Prime 5.0软件中设计HP基因引物上游引物:5′-GGAGCTCATGGCGGATCAGCTTACCGAG-3′(下划线部分为SacI酶切位点);下游引物:5′-CGGAATTCTTACTTCGCAAGCATCATTCCCACGAACTCCTCA-3′(下划线部分为EcoRⅠ酶切位点)。引物送至生工生物工程(上海)股份有限公司进行合成。
1.2.2HP基因的克隆 取柔嫩艾美耳球虫孢子化卵囊按7×104个/只接种于7日龄无球虫鸡,88 h后剖杀取盲肠,刮肠黏膜,匀浆,使裂殖子游离出来,100目网筛过滤匀浆,用洗脱液重悬,过柱收集纯化后的裂殖子。用1 mL TRIzol试剂将得到的裂殖子重悬,按试剂盒说明书提取RNA,利用反转录试剂盒将总RNA反转录成cDNA,以cDNA为模板进行PCR扩增。PCR的反应体系为20 μL:2×TaqDNA聚合酶为10 μL,上、下游引物均为0.5 μL,cDNA模板为2 μL,用ddH20补足至20 μL。PCR反应条件:94 ℃ 2 min;(94 ℃ 30 s、65.5 ℃ 30 s、72 ℃ 90 s)×40个循环;72 ℃ 90 s。PCR产物通过琼脂糖凝胶电泳进行鉴定,后用凝胶回收试剂盒将其回收,-20 ℃保存。
1.2.3 重组荧光真核表达载体pEGFP-HP的构建 用SacI/EcoR I内切酶双酶切真核表达载体pEGFP-N1和HP基因,后用凝胶回收试剂盒将酶切产物回收,将真核表达载体pEGFP-N1和HP基因的酶切产物按1∶3体积比通过DNA连接酶进行连接,接着将连接产物转化入DH5α感受态细胞中,将菌液涂布于卡那霉素抗性LB平板上,37 ℃过夜培养。第2天挑取单菌落接种至LB液体培养基中,37 ℃,150 r/min继续过夜培养,次日取2 μL以上菌液进行菌液PCR鉴定,菌液PCR产物通过琼脂糖凝胶电泳进行鉴定后,用凝胶回收试剂盒将其回收,并用以上菌液提取质粒送至生工生物工程(上海)股份有限公司进行测序鉴定。之后取大量以上菌液用无内毒素质粒大量提取试剂盒提取重组质粒pEGFP-HP,-80 ℃保存。
1.2.4 pEGFP-HP转染HD11细胞 对生长状况好的HD11细胞进行计数,大约2×105个/孔,加至24孔板中,在37 ℃ 5%CO2细胞培养箱中培养12 h,待细胞贴壁生长至80%~90%时可进行细胞转染。转染首先需配制转染复合液,分别配制转染A液和B液,按照质粒(μg)和LipofectamineTM2000(μL)1∶1.5的比例进行配制,各自室温静置5 min后轻轻混匀结合,再室温静置20 min。向HD11细胞中加入转染复合物100 μL/孔,充分混匀,继续放入37 ℃、5%CO2细胞培养箱中培养5 h后,弃掉旧培养液,添加新的培养液继续在37 ℃、5%CO2细胞培养箱中培养36~48 h,用荧光显微镜观察细胞转染情况。此试验分别设置了重组质粒组、空质粒组和对照组,其中对照组中无质粒,不进行质粒转染。
1.2.5 流式细胞术检测细胞凋亡 转染HD11细胞42 h后,利用流式细胞术检测空质粒组、重组质粒组和对照组中细胞凋亡的情况,将细胞中的旧培养液弃去,用预冷的PBS洗3遍,用1×Binding Buffer重悬收集细胞至密度为1×106个/mL,室温避光下向100 μL细胞悬液中加入5 μL Annexin V-Alexa Fluor 647和10 μL PI,轻轻混匀,15 min后用流式细胞仪对细胞的早期凋亡以及晚期凋亡情况进行检测。

2 结果
2.1HP基因克隆的鉴定 琼脂糖凝胶电泳结果显示,扩增片段大小在450 bp(图1),与HP基因的实际大小相一致。结果说明HP基因扩增成功。
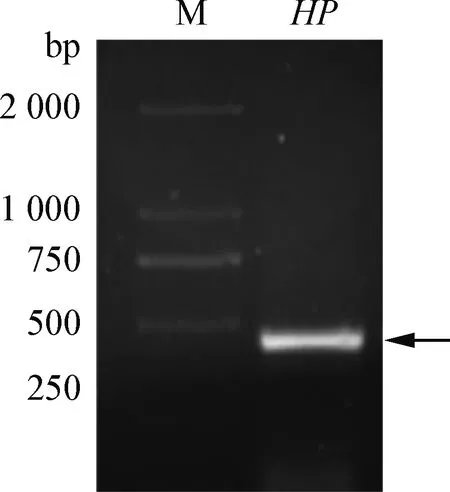
图1 HP 基因的PCR扩增
2.2 重组真核表达载体pEGFP-HP的鉴定 将pEGFP质粒和HP基因用SacI/EcoR I分别进行双酶切,各取5 μL双酶切产物进行连接前的质控(图2),最终按照亮度比较确定连接比例为1∶3。然后将含有pEGFP-HP重组质粒的大肠杆菌菌液作为模板进行PCR鉴定,共挑取8个阳性单菌落,结果显示均出现大小在450 bp的条带(图3)。之后将其进行BLAST分析,证明是HP基因(图4)。结果说明重组荧光真核表达载体pEGFP-HP构建成功。

图2 双酶切产物的电泳分析
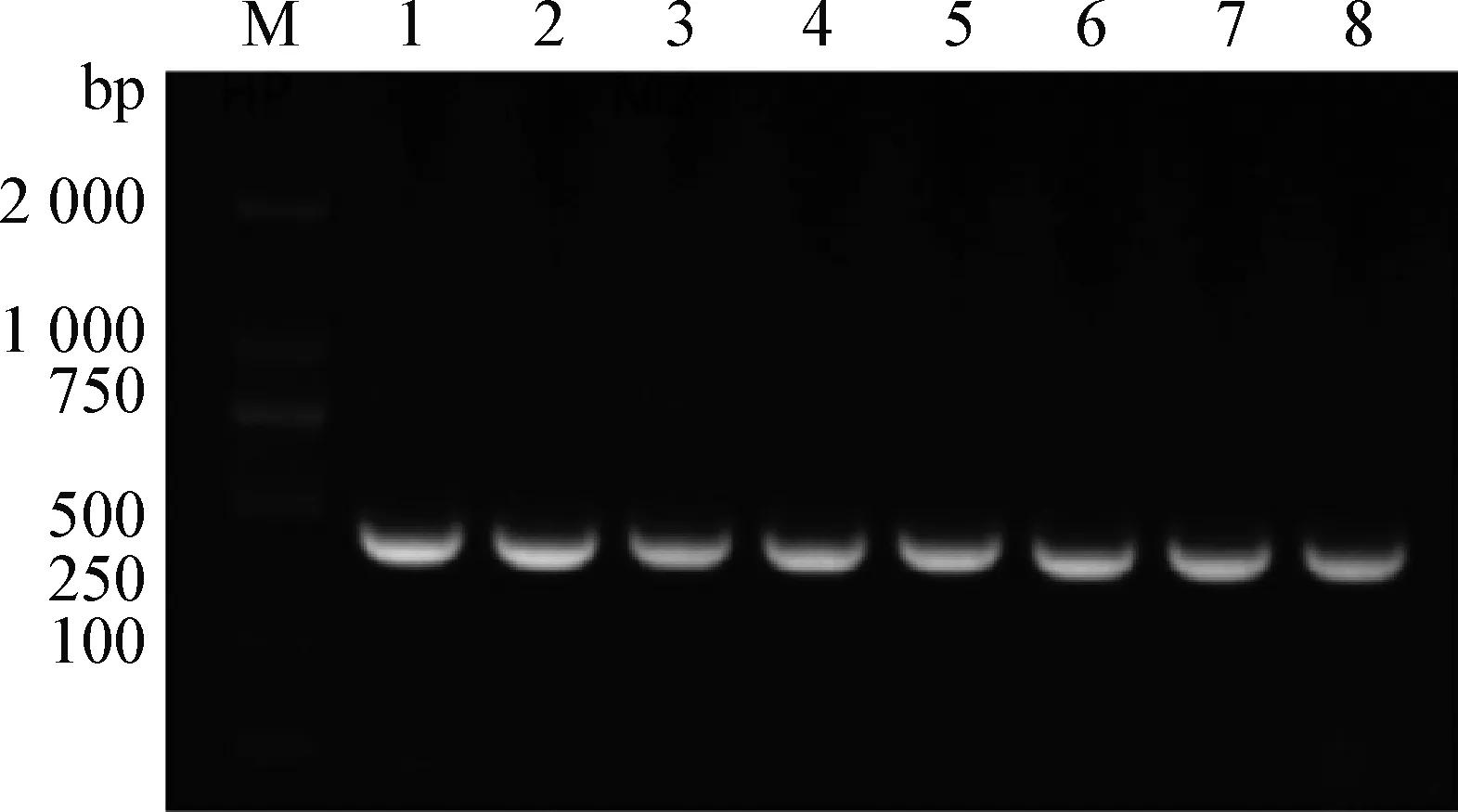
图3 菌液PCR鉴定的电泳分析

图4 测序分析
2.3 转染细胞中HP基因的表达 将pEGFP-HP重组质粒转染至HD11细胞内,待至42 h后在荧光显微镜下观察出现绿色荧光(图5B);pEGFP空质粒组也发现绿色荧光(图5A),而未转染质粒的对照组无荧光(图5C)。结果证明重组质粒pEGFP-HP已转染至细胞内且成功在细胞内进行了表达。

图5 转染42 h后的HD11细胞(400×)
2.4 流式细胞术检测细胞凋亡 流式细胞术检测细胞凋亡结果发现,pEGFP-HP重组质粒组正常细胞占25.77%,早期凋亡细胞占40.21%,晚期凋亡细胞占29.90%,死亡细胞占4.12%;pEGFP空质粒组正常细胞占84.21%,早期凋亡细胞占6.02%,晚期凋亡细胞占4.51%,死亡细胞占5.26%;空白对照组正常细胞占73.28%,早期凋亡细胞占15.27%,晚期凋亡细胞占6.87%,死亡细胞占4.58%(图6)。经分析发现,pEGFP-HP重组质粒组的早期凋亡率极显著高于pEGFP空质粒组和空白对照组(P<0.01)。

图6 流式细胞术检测各组细胞凋亡情况
3 讨论
柔嫩艾美耳球虫感染的鸡轻则仅存在轻微的食欲不振、神经萎靡,重则导致死亡[6],故对柔嫩艾美耳球虫的防治方法的研究迫在眉睫。柔嫩艾美耳球虫是主要侵袭鸡肠道的寄生虫,有研究表明,柔嫩艾美耳球虫会通过影响鸡肠道上皮细胞的细胞凋亡来维持自身良好的寄生环境[7],从而保持自身的持续感染力而不断繁衍存活下去。细胞凋亡是机体为适应环境进行的主动程序性的细胞死亡过程[8],相较于其他细胞死亡方式来说是自卫性质的死亡,具有积极效应。关于球虫和细胞凋亡的研究近几年层出不穷,有研究表明,鸡感染柔嫩艾美耳球虫后,发现宿主细胞的凋亡增多,且第2代裂殖生殖期最多[9];牛柔嫩艾美耳球虫子孢子的感染能够抑制牛胎胃肠细胞(BFGC)和非洲绿猴肾细胞(VERO)的细胞凋亡[10]。以上试验都表明,柔嫩艾美耳球虫的感染会影响宿主细胞的细胞凋亡,但球虫影响细胞凋亡的具体的作用机制还尚不清楚。
HP基因编码的蛋白是由本实验室前期工作通过将柔嫩艾美耳球虫第2代裂殖子与马-达氏牛肾细胞(MDBK)进行无血清间接共培养所得到的一种柔嫩艾美耳球虫的外分泌蛋白,通过对其进行的生物信息学分析预测发现,HP基因的蛋白质二级结构导致其易发生结合反应,不含信号肽,且存在5个潜在的抗原表位,这些特性说明此基因具有重大的体外研究意义。
细胞转染技术是分析外源基因或基因产物功能的一个重要工具[11],能够很直观的得到试验结果。本试验通过将HP基因转染进入宿主细胞内来分析它的功能,在本次试验前,我们分别将HP基因转染了MDBK、鸡成纤维细胞(DF-1)以及HD11等鸡柔嫩艾美耳球虫的宿主细胞,最后发现HD11的转染效率最佳,故本试验最终选择了HD11作为试验细胞。
本试验通过构建HP基因的重组真核表达质粒pEGFP-HP,转染HD11来探讨HP基因的潜在生物学功能及其作用机制。本试验以鸡柔嫩艾美耳球虫HP基因为研究对象,利用RT-PCR及分子克隆技术成功构建了重组真核表达质粒pEGFP-HP,然后将其转染至HD11细胞内,待至42 h后在荧光显微镜下观察看到绿色荧光,随后对其进行细胞凋亡情况的检测,流式细胞术结果显示,pEGFP空质粒组和空白对照组细胞凋亡率差异不大,说明真核表达质粒pEGFP并不会对宿主细胞的细胞凋亡产生影响。pEGFP-HP重组质粒组的早期凋亡细胞占40.21%,晚期凋亡细胞占29.90%,均高于pEGFP空质粒组和空白对照组,且早期凋亡率显著高于pEGFP空质粒组和空白对照组,这说明HP基因的出现导致了宿主细胞的凋亡,且主要诱导宿主细胞的早期凋亡。值得一提的是,本实验室前期试验通过将柔嫩艾美耳球虫第2代裂殖子与MDBK共培养的方式发现,柔嫩艾美耳球虫会抑制MDBK的细胞凋亡,看似这2个结果有矛盾,其实不然,因为有研究表明[12],在感染的不同时间段,柔嫩艾美耳球虫对宿主细胞凋亡的影响也不同,在柔嫩艾美耳球虫感染的早期(24 h以内),宿主细胞的凋亡被抑制,而到感染的中后期(24~48 h,48~120 h),宿主细胞的凋亡又发生了促进,这也说明HP基因在转染宿主细胞的中期诱导了细胞凋亡;又或许HP基因在感染期间都起到了诱导宿主细胞凋亡的作用,这可以说明柔嫩艾美耳球虫参与影响宿主细胞凋亡的蛋白各自发挥着不同的作用,其最终目的都是为了更好的生长发育、繁衍后代。因为转染细胞36~48 h后的外源基因才能转入细胞内,且效果最佳,而此时都属于感染中期,故关于不同时间段的研究还具有局限性,还需要做进一步的探究,本试验结果表明,柔嫩艾美耳球虫HP基因与宿主细胞凋亡有关,且在其感染中期会诱导宿主细胞的凋亡,其中还会显著诱导宿主细胞的早期凋亡(P<0.01)。本次试验也将HP基因从此命名为柔嫩艾美耳球虫凋亡诱导基因(IA)。
