不同生长环境三叶青中总黄酮提取工艺及含量比较
2021-11-11李春华王诚远何倌发陈俊抚州市食品药品检验所江西抚州344000江西共青江中食疗科技有限公司江西共青城3300
★ 李春华 王诚远 何倌发 陈俊(.抚州市食品药品检验所 江西 抚州 344000;.江西共青江中食疗科技有限公司 江西 共青城 3300)
黄酮类化合物是植物在生长过程中产生的代谢产物,广泛存在于各类植物中,具有抗氧化[1]、抗病毒[2]、抗癌等多种生物活性,三叶青黄酮对肺癌细胞具有抑制作用[3],可诱导胃癌细胞凋亡[4],还具有抑制肝癌细胞和乳腺癌细胞增殖的作用,且效果在一定范围内依赖剂量[5-6]。
三叶青又名蛇附子、金线吊葫芦等[7]。在江西、浙江、福建等地民间有着广泛的应用,近些年江西省的玉山、万载、分宜、黎川等地已开始大量种植三叶青,目前急需建立江西产三叶青质量控制方法,为三叶青种植栽培及质量控制提供参考依据。三叶青经提取后常以紫外-可见分光光度计测定提取溶液中总黄酮含量[8-12],这类方法误差较大。
本实验建立了三叶青黄酮的最优提取工艺,并运用高效液相色谱串联质谱法同时测定提取溶液中原花青素B1、紫云英苷、儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷等6种黄酮类活性成分的含量。进一步比较了10批来源于江西、浙江、云南等地的三叶青中的总黄酮含量,以期为三叶青的开发利用和质量控制提供参考。
1 仪器与材料
1.1 仪器 Nexera X2 LC-30A 超高效液相色谱(日本岛津公司);TRIPLE QUAD 5500三重四级杆质谱(美国 AB SCIEX 公司);UV-2550紫外 - 可见分光光度计(日本岛津公司);BP-211D天平(德国赛多利斯公司);DZKW-S-4电热恒温水浴锅(北京市永光明医疗仪器有限公司)。
1.2 材料 原花青素B1对照品(批号:Y-078 -180404;含量:95.0 %)、紫云英苷对照品(批号:Z-020-181205;含量:98.0 %)均购自成都瑞芬思生物科技有限公司;儿茶素对照品(批号:110877 - 201102;含量:94.4 %)、芦丁对照品(批号:100080-201610;含量:91.9 %)、异槲皮苷对照品(批号:111809-201804;含量:97.2 %)、山柰酚-3- O-芸香糖苷对照品(批号:112007-201602;含量:90.8 %)均购自中国食品药品检定研究院;乙腈为色谱纯(德国Merck公司),水为Milli-Q超纯水(美国 Millipore 公司)、其他试剂为分析纯。
第一批样品(S1)为三叶青药材(批号:20180309,产地:云南省石屏县),第二批样品(S2)为三叶青饮片(批号:20180309,产地:云南省石屏县)。其余8批样品(样品S3至S10)于 2018年在江西省的分宜、玉山、万载、黎川、资溪和浙江省的衢州等地采集,经江西省药品检验检测研究院袁桂平主任中药师鉴定为为葡萄科崖爬藤属植物三叶崖爬藤(Tetrastigma hemsleyanum Diels et.Gilg)。见表1。
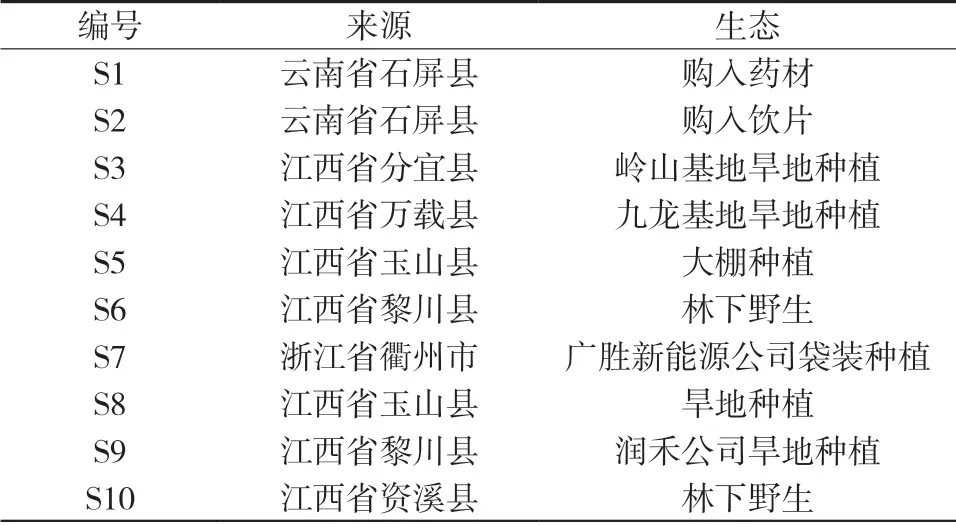
表1 三叶青样品来源
2 方法
2.1 样品溶液的制备 取三叶青药材粉碎,过60目筛,精密称取约0.5 g,置于磨口三角瓶中,精密加入不同浓度的甲醇溶液,水浴回流提取,称定重量,放冷,再称定重量,用60 %甲醇补足减失重量,摇匀,滤过,取续滤液适量加60 %甲醇稀释25倍,摇匀,0.22 μm滤膜过滤,即得供试品溶液。
2.2 单因素考察设计 按2.1项方法水浴回流提取,选取甲醇浓度(水,40 %甲醇、60 %甲醇、80 %甲醇、100 %甲醇),提取温度(80 ℃、90 ℃、100 ℃),提取时间(30 min、45 min 、60 min、90 min)等因素进行试验。
2.3 正交试验设计 在单因素试验考察的条件下,采用L9(34)正交试验表,甲醇浓度、提取温度、提取时间3因素,每个因素选取3水平。见表 2。
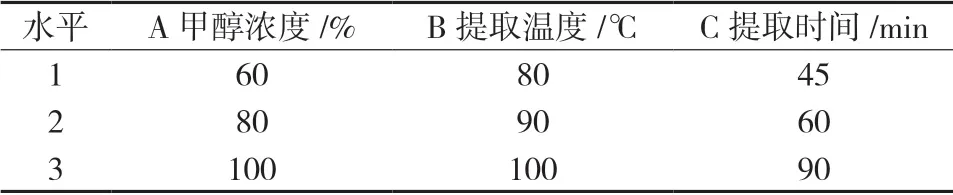
表2 因素水平
2.4 对照品溶液的制备 分别精密称取原花青素B1、儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、紫云英苷对照品适量,加入甲醇溶解并稀释至刻度,分别制成质量浓度分别为0.094 6、0.099 3、0.102 2、0.098 0、0.097 0、0.099 2 mg·mL-1的对照品储备液。标准曲线用对照品溶液由60 %甲醇稀释储备液而成。
2.5 色谱条件 色谱柱:Waters ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);流动相:乙腈(A)- 0.1%甲酸水溶液(B),梯度洗脱(0~0.5min:8 % A→10 % A;0.5~2.5 min:10 % A→15 % A;2.5~3.5 min:15 % A→18 %A ;3.5~6.5 min:18 % A→20 % A;6.5~8.0 min:20 % A→22 % A;8.0~10 min:22 % A→40 % A;10~11 min:40 % A→60 % A;11~12 min:60 % A→60 % A;12~13 min:60 % A→8 % A;13~15 min:8 % A→8 % A);流速:0.25 mL·min-1;柱温:40 ℃;进样量:1 μL。
2.6 质谱条件 离子源:电喷雾离子源,MRM进行定量分析;采用负离子检测模式;离子喷雾电压(IS)为4 500 V;离子源温度为550 ℃;雾化气(N2)压力为55 units;辅助气(N2)压力为55 units;气帘气(N2)压力为35 units。接口加热,全程通入氮气。MRM模式定量。监测成分离子对,解簇电压(DP)和碰撞能量(CE)见表3。混合对照品及三叶青样品的总离子流图。见图1。
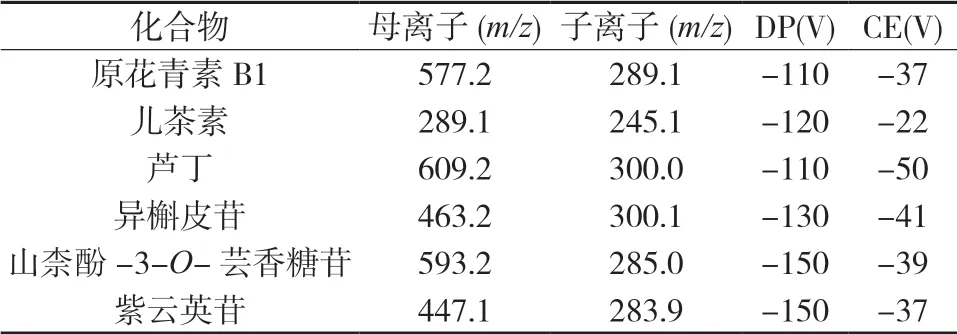
表3 三叶青中6种成分的质谱参数
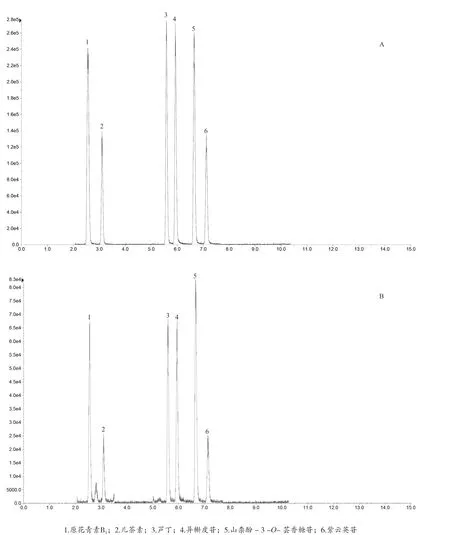
图1 混合对照品溶液(A)及三叶青供试品溶液(B)的总离子流图
3 结果与分析
3.1 线性关系 分别精密量取各对照品储备液适量,用60 %甲醇稀释制得系列浓度的混合对照品溶液。依法测定峰面积,以质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,计算回归方程。线性关系见表4。
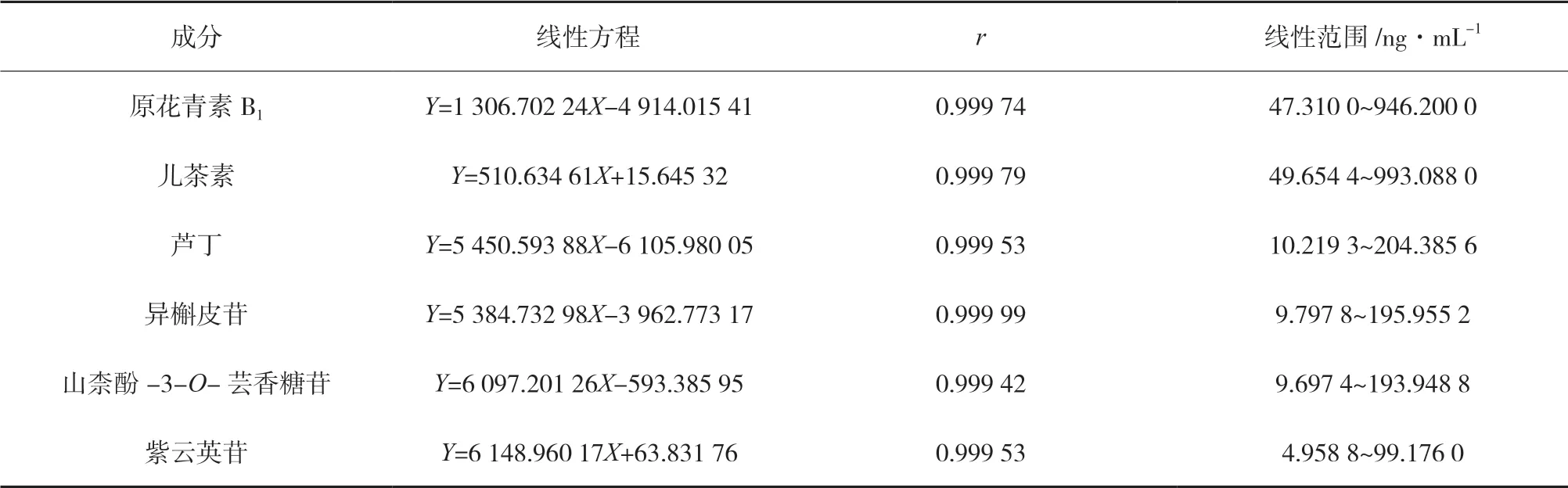
表4 6种成分回归方程和线性关系
3.2 单因素试验
3.2.1 加热回流提取溶剂的考察 取同一批三叶青供试品(S1)5份,各取约0.5 g,精密称定,置于磨口三角瓶中,分别精密加入不同浓度的甲醇溶液,称定重量,100 ℃加热回流60 min,放冷,再称定重量,分别用对应溶剂补足减失重量,摇匀,滤过,取续滤液适量加对应溶剂稀释25倍,摇匀,0.22 μm滤膜过滤,按“2.5”“2.6”项测定,计算原花青素B1、儿茶素、芦丁、异槲皮苷、山柰酚-3-O- 芸香糖苷、紫云英苷含量,结果见表5。由表中的数据可知,60 %的甲醇提取的黄酮总量最高,40 %甲醇提取的效果与水提取的效果无明显差别,而随着甲醇浓度的提高,其黄酮总量反而呈下降趋势。
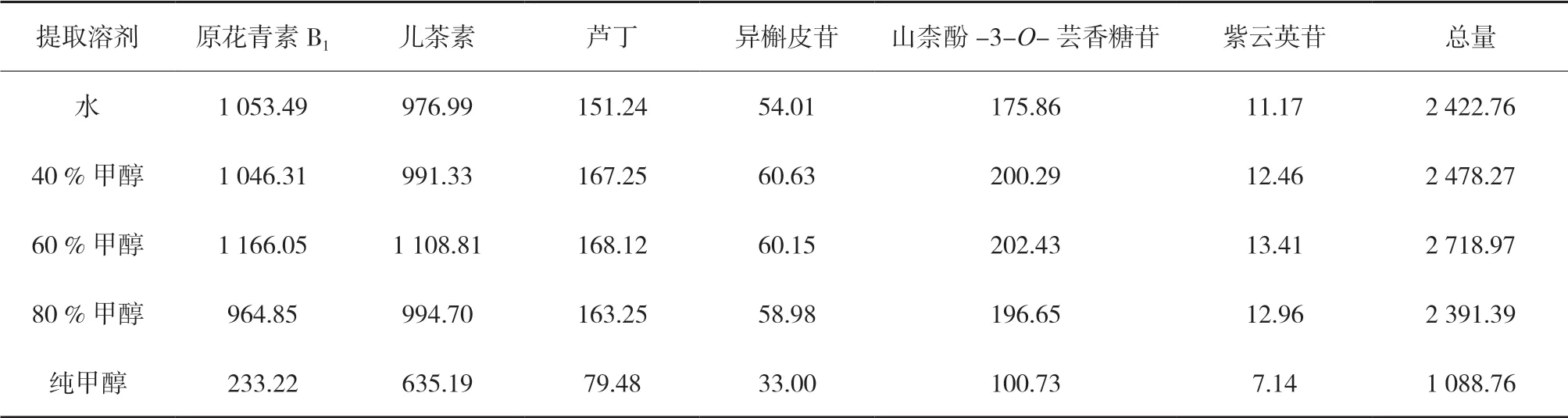
表5 甲醇浓度对6种成分含量的影响(n=2) μg/g
3.2.2 加热回流提取时间的考察 取同一批三叶青供试品(S1)4份,各取约0.5 g,精密称定,置于磨口三角瓶中,分别精密加入60 %甲醇50 mL,称定重量,100 ℃水浴中分别按表6的时间加热回流,放冷,再称定重量,分别用60 %甲醇补足减失重量,摇匀,滤过,取续滤液适量加60 %甲醇稀释25倍,摇匀,0.22 μm滤膜过滤,按“2.5”“2.6”项测定,计算原花青素B1、儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、紫云英苷含量,结果见表6。由表6可知,60 %的甲醇提取60 min,其黄酮含量最高。
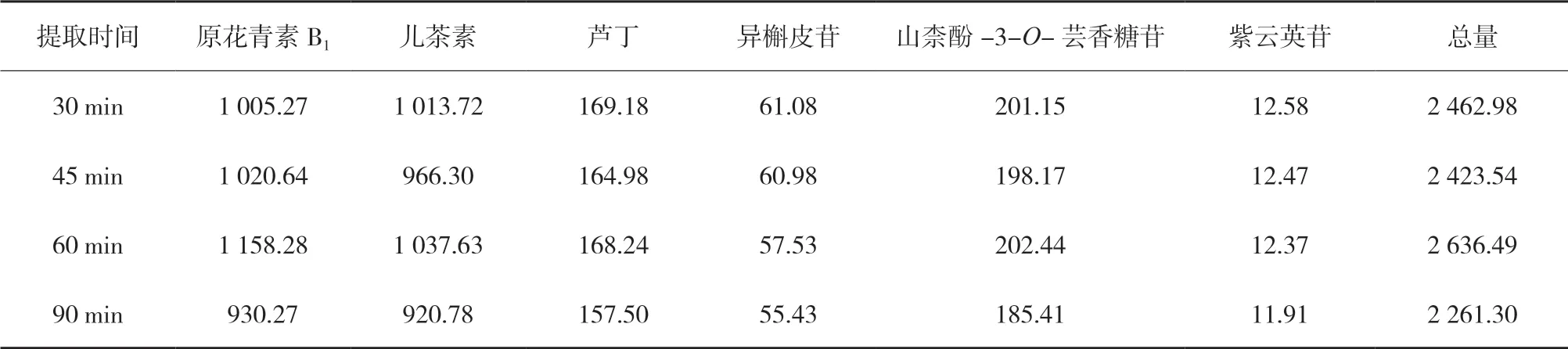
表6 水浴时间对6种成分含量的影响(n=2) μg/g
3.2.3 加热回流提取温度考察 取同一批三叶青供试品(S1)3份,各取约0.5 g,精密称定,置于磨口三角瓶中,分别精密加入60 %甲醇50 mL,称定重量,分别按表7的温度加热回流60 min,放冷,再称定重量,分别用60 %甲醇补足减失重量,摇匀,滤过,取续滤液适量,加60 %甲醇稀释25倍,摇匀,0.22 μm滤膜过滤,按“2.5”“2.6”项方法测定,计算原花青素B1、儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、紫云英苷含量,考察结果见表7。由表7中可以看出,当提取温度为100 ℃时,其黄酮含量最高。
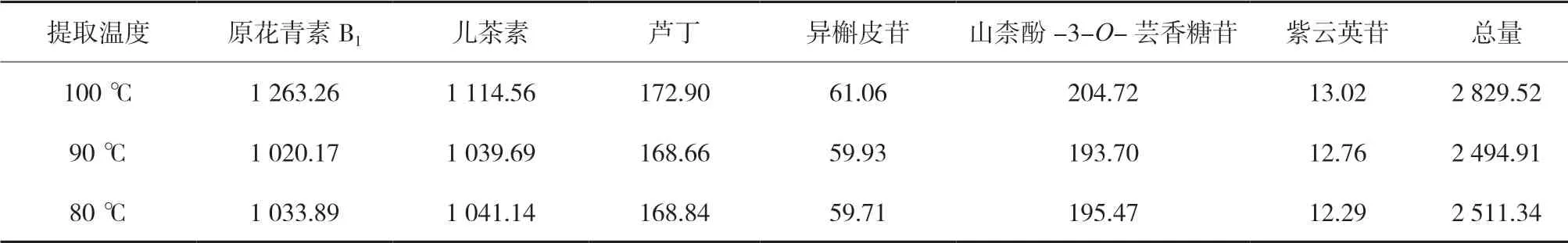
表7 水浴温度对6种成分含量的影响(n=2) μg/g
3.3 正交试验 精密称取三叶青样品(S1)9份,每份0.5 g,按照表 3的试验条件制备三叶青供试品溶液,按照“2.5”“2.6”项方法测定,计算三叶青中黄酮成分的含量并计算方差分析(D 因素误差分析),结果见表8和表9。结果可知,考察的因素中,甲醇浓度对提取三叶青活性成分有显著影响,提取时间和提取温度影响不显著。根据单因素及正交试验结果,确定提取三叶青有效成分的较优工艺:60 %甲醇溶液,80 ℃水浴提取45 min。
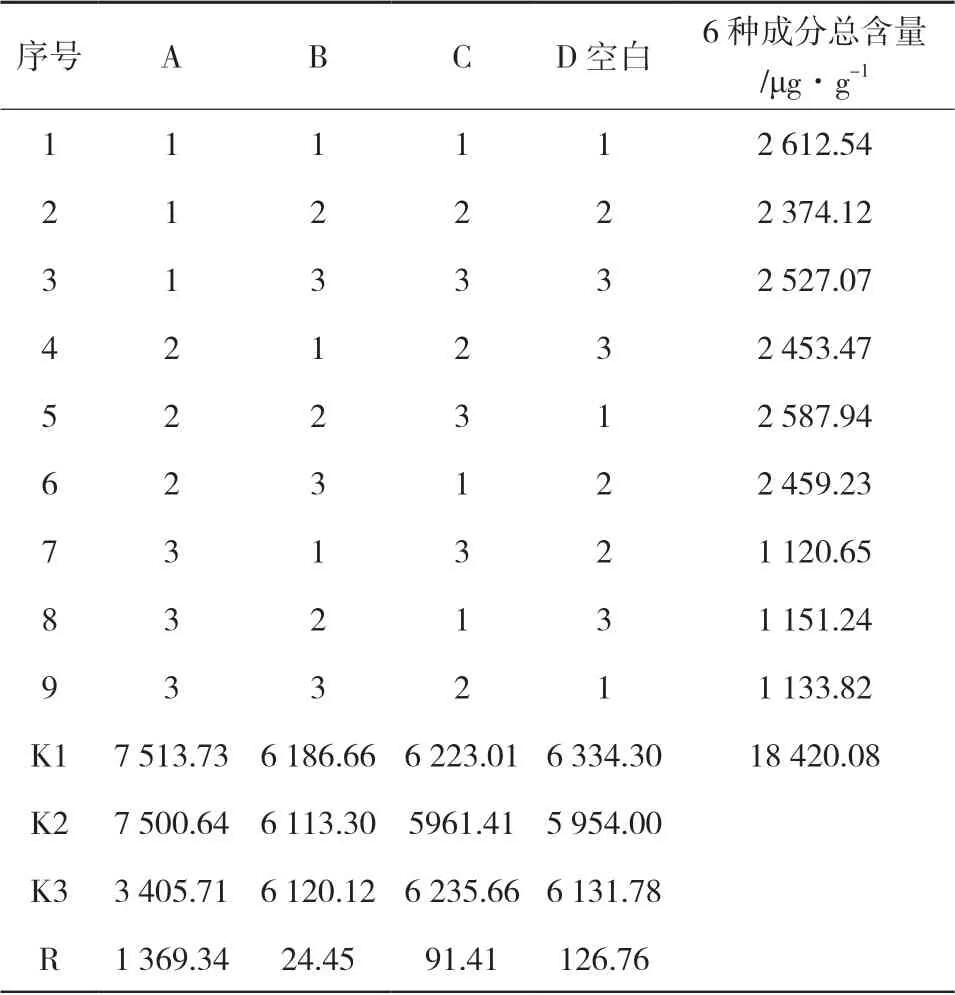
表8 正交试验表和结果
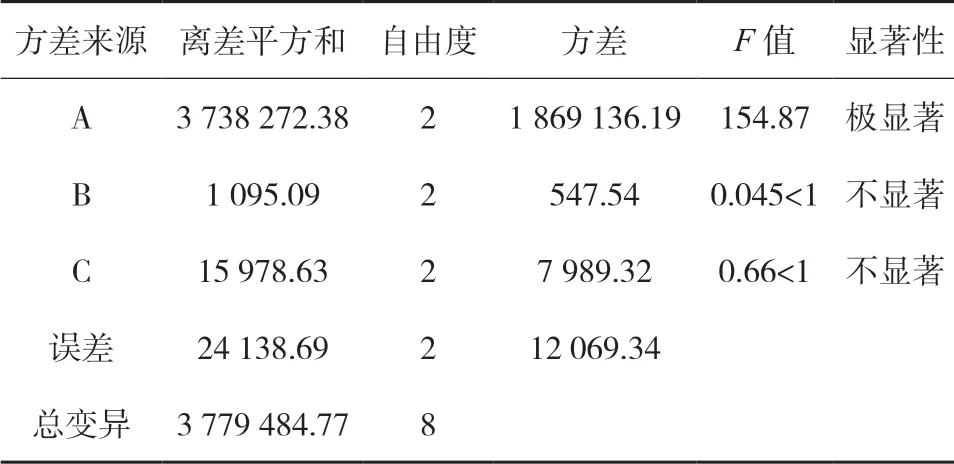
表9 方差分析表
3.4 不同产地三叶青样品中黄酮活性成分含量 精密称取10批样品各2份,按照最佳提取工艺方法进行水浴回流提取,按“2.5”“2.6”项下条件进行测定,计算原花青素B1、儿茶素、芦丁、异槲皮苷、山柰酚-3-O-芸香糖苷、紫云英苷含量,并计算总黄酮的含量,其结果见表10。
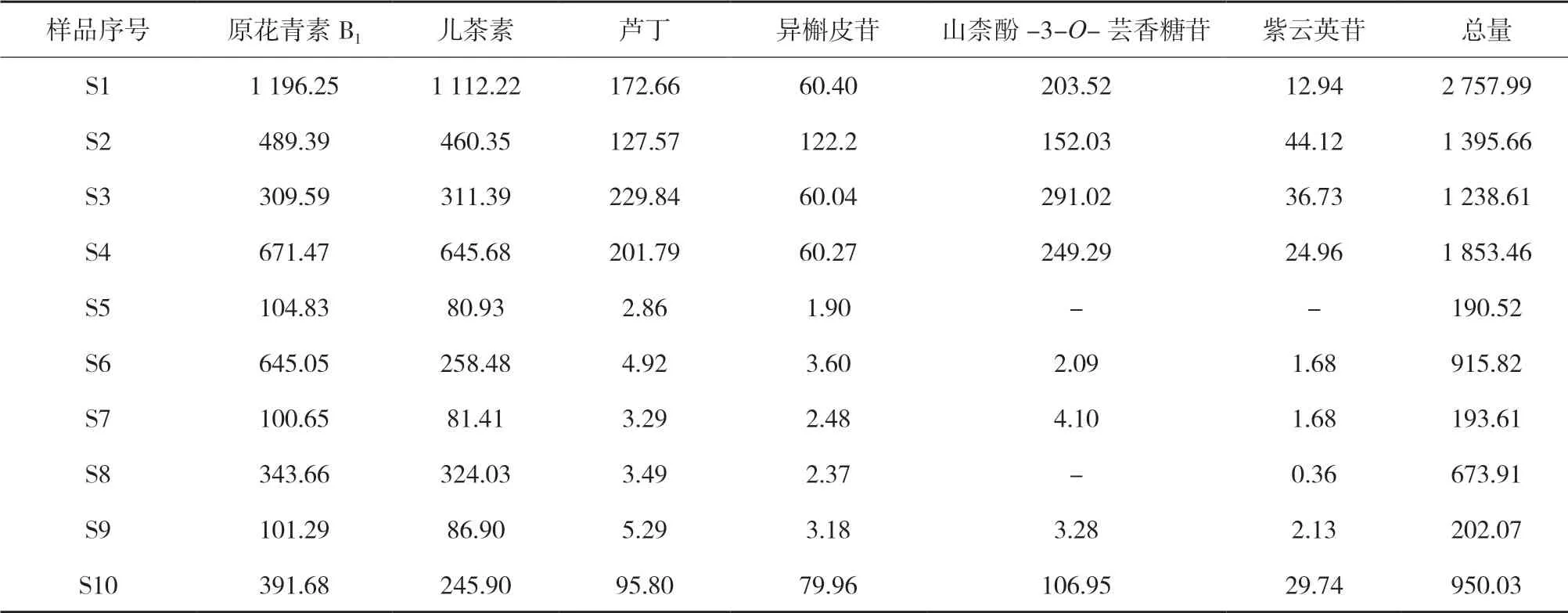
表10 三叶青6种活性成分含量 μg/g
4 讨论
本实验通过单因素试验和正交试验,确定三叶青中活性成分的较佳提取工艺为以60 %甲醇,80 ℃水浴提取45 min。采取超高效液相色谱串联质谱法同时测定6种活性成分的含量,并以其总量计算黄酮含量。该提取方法操作简单,测定方法较方便和稳定,为三叶青的开发利用和质量控制提供了一定的参考。
各产地的三叶青总黄酮含量存在明显差异,云南产三叶青药材以2 757.99 μg/g为最高,万载来源次之,为1 853.46 μg/g,玉山大棚种植、浙江衢州和江西黎川旱地种植的三叶青黄酮含量最低,分别为190.52、193.61、202.07 μg/g。但是,同在玉山收集的样品,含量也差异极大,大棚种植和旱地种植的三叶青黄酮含量分别为190.52 μg/g和673.91 μg/g。此推测黄酮含量的差异可能与种植基地三叶青引种来源不一致以及各自的不同生态环境有关。
据文献报道,不同产地三叶青样品中黄酮含量差异悬殊,不同种源三叶崖爬藤的表型性状存在变异,三叶崖爬藤块茎中总黄酮也存在变异[13]。自然环境的时空异质性会导致不同的选择压力,处于不同环境的种源则可能在次生代谢产物方面产生分化[13-14]。不同种质之间三叶青进行统一人工栽培后,产量、有效成分并不相同[15],同时三叶青块茎总黄酮含量随着生长年限的增长而不断上升[16]。这些都为三叶青药材的种植及质量控制提供一定的参考。
