不同品系小鼠侵袭性真菌感染动物模型的构建*
2021-11-06王迪黄劲姚昌昊王梅竹程敏郭鑫瑶廖万清康颖倩
王迪, 黄劲, 姚昌昊, 王梅竹, 程敏, 郭鑫瑶, 廖万清, 康颖倩,7***
(1.贵州医科大学 基础医学院 微生物学教研室, 贵州 贵阳 550025; 2.贵州省微生物与人类健康关系研究人才基地 & 贵州省普通高校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.贵州医科大学 环境污染与疾病监控教育部重点实验室, 贵州 贵阳 550025; 4.贵州医科大学 基础医学院 生物化学与分子生物学教研室, 贵州 贵阳 550025; 5.海军军医大学长征医院 皮肤科, 上海 200003; 6.上海市医学真菌分子生物学重点实验室, 上海 200003; 7.贵州省烟草科学研究院, 贵州 贵阳 550009)
侵袭性真菌感染是指2个或2个以上的器官或组织受到真菌侵犯所引起的感染性疾病,占所有真菌感染性疾病的90%以上,包括念珠菌病、隐球菌病和毛孢子菌病在内的多种严重真菌病[1]。艾滋病(acquired immunodeficiency syndrome,AIDS)患者或接受抗癌治疗、血液干细胞替换及器官移植的患者是侵袭性真菌感染的高危人群,特别是对于有潜在的严重疾病如糖尿病、血液病及放化疗、服用免疫抑制药物及留置医疗设备患者,由于破坏了先天和适应性免疫反应,从而为机会性病原体的感染创造了机会,使得侵袭性真菌感染的发病率显著增加[2-6]。由于侵袭性真菌感染通常情况下累及多个器官,加之全新的、有效的抗真菌药物的缺乏及对侵袭性真菌感染的临床认识缺乏等原因,侵袭性真菌感染的死亡率一直居高不下,已成为西方国家乃至全世界发病和死亡的重要原因[7]。动物模型是研究多种感染性疾病发病机理的有力工具,可以模拟宿主的免疫干扰和人类真菌病的组织特异性特征,并且可以避开一些伦理问题直接研究病原体对动物体内组织或器官的作用,具有体外试验不可比拟的优势[8-11],其中小鼠模型因其成本低、易于处理、技术可行性以及其丰富使用经验而特别受到关注[12]。同时,侵袭性真菌的静脉感染具有良好的特征性和可重复性,酵母可迅速传播到整个宿主体内,已经成为目前最为常用的构建动物模型的感染途径[13]。本研究通过选择临床发病率最高的侵袭性酵母菌白念珠菌、新生隐球菌分别感染不同品系的小鼠,从动物品系选择、剂量选择及模型评价等多个方面对侵袭性酵母感染小鼠模型建立过程进行逐一描述及研究,力求获得稳定可靠的侵袭性真菌感染动物研究模型,为真菌发病机理、定量毒力、分析抗真菌药物功效真菌疫苗开发以及侵袭性真菌感染的治疗等各方面研究提供最基础的科学依据。
1 材料与方法
1.1 材料
1.1.1菌株来源 白念珠菌菌株ATCC10231T(白念珠菌标准菌株)、GYWu27菌株(临床AIDS病人来源)、GYF76菌株[临床外阴阴道念珠菌病(vulvovaginal candidiasis,VVC)病人来源]及N110菌株(健康人来源),新生隐球菌标准菌株H99T菌株。所用实验菌株均由贵州医科大学微生物教研室提供,实验菌株经过生理生化等鉴定。
1.1.2实验动物 4~6 周龄无特定病原体级(specific pathogen free,SPF)Balb/c小鼠80只,4~6 周龄SPF级昆明(kunming,KM)小鼠80只,体质量18~22 g,购于贵州医科大学实验动物中心[SCXK(黔)2018-0001]。
1.1.3主要试剂与仪器 酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium, YPD)和沙氏葡萄糖琼脂培养基(sabouraud agar medium,SDA;美国BD),高压蒸汽灭菌器(日本Tomy Kogyo Co.Lid),制冰机(日本SANYO),Thermo 17R小型台式高速离心机和HH-B11恒温培养箱(上海跃进)。
1.2 实验方法
1.2.1菌液配制 复苏原代保存菌种,解冻后分别传于SDA、YPD培养基上,37 ℃培养48 h;挑取单个菌落传代于相应的液体培养基中,振荡培养,使白念珠菌、新生隐球菌处于对数生长期,将培养物离心洗涤2次,重悬于无菌盐水中,通过分光光度法及细胞计数板调整菌液浓度至所需浓度[14]。
1.2.2筛选侵袭性真菌感染的最适浓度 所有小鼠先进行一周适应性喂养,保持温度22~26 ℃、湿度50%~70%、光照12 h明暗交替环境条件,自由进水进食,待一般状态稳定后进行实验;分别取KM小鼠和Balb/c小鼠各30只,随机均分为5组、每组6只,注射浓度分别为1×106、1×107、1×108、1×109及1×1010CFU/L白念珠菌ATCC10231T菌株,观察14 d内小鼠的死亡速率、确定侵袭性真菌感染的最适浓度。
1.2.3实验分组与造模 分别取KM小鼠和Balb/c小鼠各50只,均用苦味酸进行标记,并按照随机双盲法分为GYWu27组、GYF76组、N110组、H99T组、生理盐水(Saline)组,每组KM小鼠和Balb/c小鼠各10只。采用1 mL注射器吸取配制好的“1.2.2”项下筛选的最适菌液浓度,经各组小鼠侧尾静脉注射感染实验小鼠。注射当日称量每只小鼠体质量,根据体质量确定接种剂量,按照0.1 mL菌液/10 g小鼠[15-16];Saline组小鼠根据0.1 mL Saline/10 g小鼠注射生理盐水。
1.2.4一般状态、体质量及生存情况 观察各组小鼠注射菌液或生理盐水后30 d内的一般状态和体质量,同时记录90 d内的生存状况。
1.2.5靶器官载菌量检测 对死亡的GYWu27组、GYF76组、N110组、H99T组小鼠及定期分批处死的Saline组小鼠进行解剖,采集GYWu27组、GYF76组、N110组、Saline组小鼠的肾脏,采集H99T组、Saline组小鼠的脑组织,分别加含0.05%氯霉素的PBS缓冲液1 mL,用微型组织细胞破碎仪匀浆;组织匀浆后,按适当比例进行稀释,将稀释后液体接种到含0.05%氯霉素SDA平板中,37 ℃培养48 h后,计数真菌菌落数。
1.2.6分离菌株鉴定 取“1.2.5”项下采集到的小鼠肾脏、脑组织匀浆液,分别涂布于SDA、YPD一次性平板上,37 ℃培养48 h;如培养结果阳性,重新鉴定菌株。
1.2.7病理组织学检测 对死亡GYWu27组、GYF76组、N110组及H99T组小鼠进行解剖,采集GYWu27组、GYF76组、N110组KM小鼠和Balb/c小鼠的肾脏、肝脏,采集H99T组KM小鼠和Balb/c小鼠的肾脏、肝脏、脑组织,10%多聚甲醛溶液固定过夜,石蜡包埋、切片、苏木精-伊红染色(hematoxylin-eosin staining,HE),普通光学显微镜下观察。
1.3 统计学分析

2 结果
2.1 侵袭性真菌感染最适浓度的筛选
结果表明,1×106和1×107CFU/L ATCC10231T组KM小鼠和Balb/c小鼠感染至第14天时均无死亡,观察周期延长至30 d仍未见死亡;1×1010CFU/L ATCC10231T组Balb/c小鼠组感染第1天即开始死亡,1×1010CFU/L ATCC10231T组KM小鼠感染第2天出现死亡,至第14天时2种品系小鼠均全部死亡。综合表1中各菌液浓度的小鼠死亡情况,侵袭性真菌感染动物模型Balb/c小鼠ATCC10231T最适感染浓度为1×108CFU/L,KM小鼠ATCC10231T最适感染浓度为1×109CFU/L。
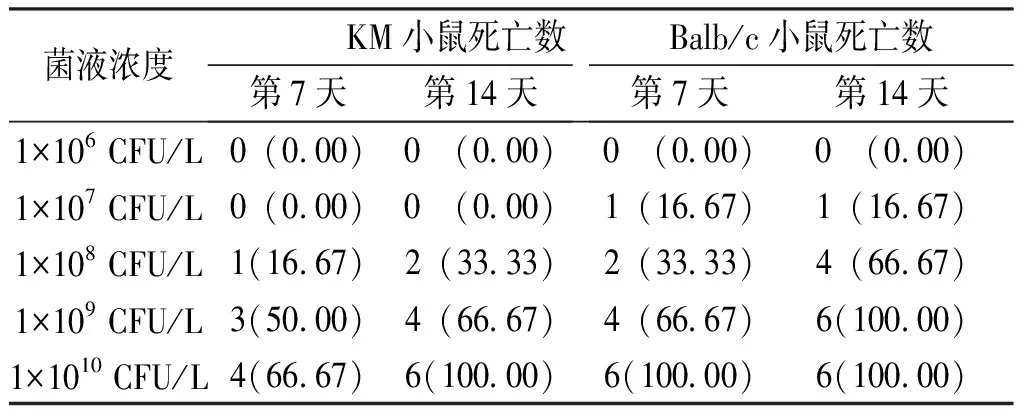
表1 不同浓度ATCC10231T感染KM小鼠和Balb/c小鼠后不同时间的死亡情况[n(%)]Tab.1 Death of KM mice and Balb/c mice infected with ATCC10231T at different concentrations at different times[n(%)]
2.2 一般状态和体质量变化
注射菌液第1天各处理组KM小鼠和Balb/c小鼠的状态良好,被毛光滑柔顺,活动状态良好;注射第3天,小鼠表现为安静少动、消瘦、饮食量下降、皮毛欠光滑等现象,GYWu27组、GYF76组、N110组、H99T组小鼠开始出现嗜睡、皮肤黏膜青紫、站立不稳、行动明显迟缓等表现;感染第20天,H99T组Balb/c小鼠一般状态不断变差,被毛不光滑,食欲下降,呈现濒死状态。感染第4天,GYWu27组、GYF76组、N110组、H99T组KM小鼠和Balb/c小鼠体质量持续增加,感染第7天均下降;至感染20~24 d,小鼠体质量再次缓慢回升;Saline组两种系小鼠的体质量则一直不断增加;GYWu27组、GYF76组、N110组及H99T组两种系小鼠同时点体质量分别与Saline组比较,差异均有统计学意义(P<0.05)。见表2。
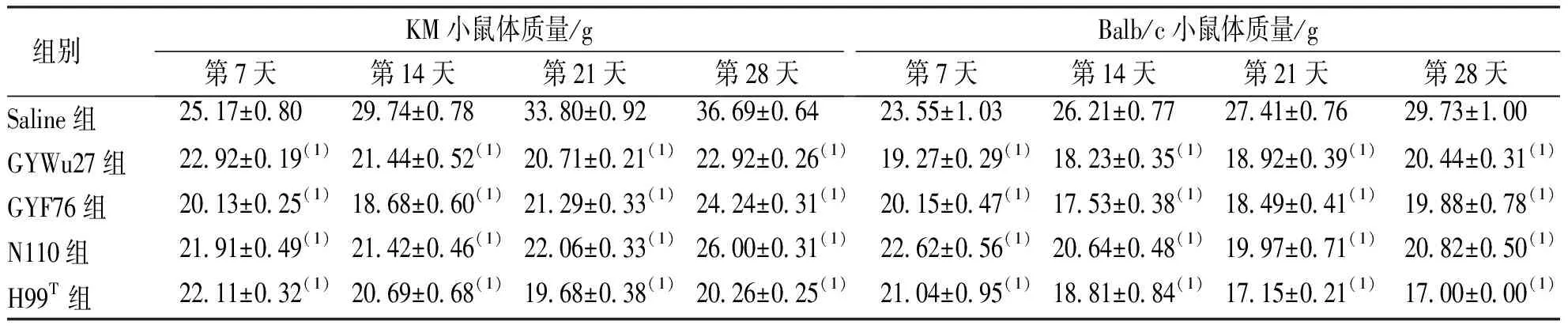
表2 白念珠菌和新生隐球菌感染后 KM和Balb/c小鼠的体质量变化Tab.2 Changes of body weight in KM mice and Balb/c mice infected with C. albicans and C. neoformans
2.3 生存情况
生存情况结果显示,Saline组KM和Balb/c小鼠均无死亡;对于KM小鼠,GYWu27组小鼠70 d内全部死亡,GYF76组小鼠80 d内全部死亡,N110组90 d生存率20%,H99T组小鼠46 d内全部死亡;对于Balb/c小鼠,GYWu27组、GYF76组、N110组、H99T组比较,log-rank检验结果显示各组小鼠生存曲线间差异无统计学意义(P>0.05)。见图1。因此可认为不同真菌感染对不同品系小鼠生存情况有影响。
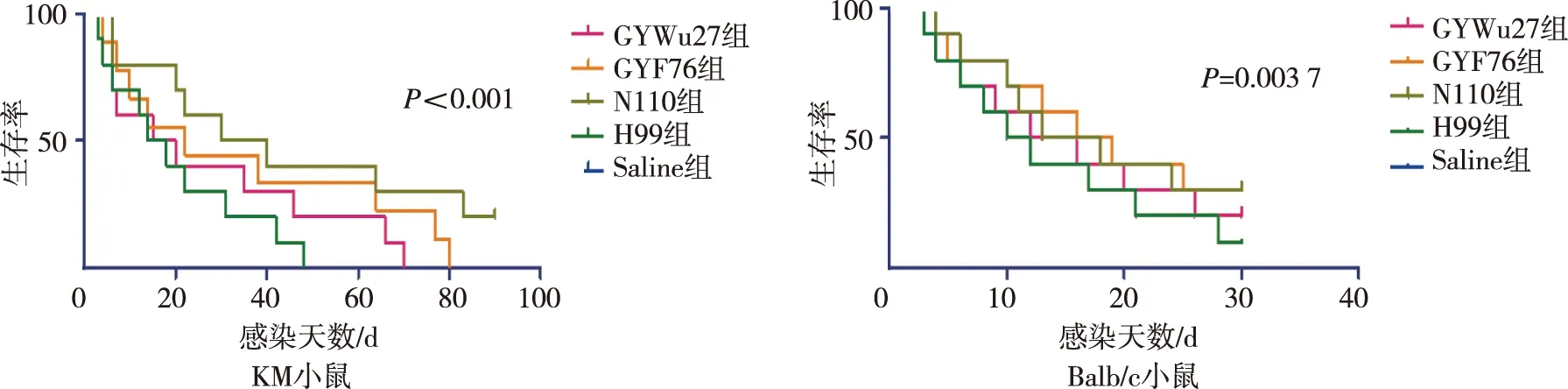
图1 白念珠菌和新生隐球菌感染KM小鼠和Balb/c小鼠的生存曲线Fig.1 Survival curves of KM mice and Balb/c mice infected with C. albicans and C. neoformans from different sources
2.4 GYF76和H99T组小鼠分离菌株的鉴定
GYF76和H99T组小鼠分离菌株的鉴定结果显示,GYF76组体外及KM小鼠感染分离菌株在SDA培养基上37 ℃培养48 h,可见白色圆形酵母样菌落生长、表面光滑湿润,CHRO Margar培养基上分离前后菌株均呈中等绿色;H99T组体外及Balb/c小鼠感染分离菌株在YPD培养基上为乳白色酵母型菌落,感染前后分离菌株墨汁染色镜下均呈圆形或椭圆形,外周有宽厚的荚膜,折光性强不易着色。见图2和图3。

图2 白念珠菌GYF76感染KM小鼠前、后分离菌株的菌落特征(肉眼观)Fig.2 Colony characteristics of GYF76 strain isolated before and after infection of KM mice(naked eye view)
2.5 靶器官菌种负荷
Saline组KM及Balb/c小鼠的肾脏、脑组织全程未分离培养出菌株,GYWu27组、GYF76组、N110组KM及Balb/c小鼠肾脏皆检测出白念珠菌;N110组Balb/c小鼠的真菌负荷量高于KM小鼠(P<0.05),但其他各组小鼠间靶器官菌种负荷量差异无统计学意义(P>0.05);H99T组KM及Balb/c小鼠脑组织也检测出新生隐球菌。见图4。
2.6 病理组织学
H99T菌株感染后,不同品系小鼠肾脏均有大量炎症细胞浸润,脑组织脑实质透明变性、局部皮层下见真菌感染灶、炎症细胞浸润及大量出血坏死,肝脏组织见部分肝小叶结构破坏、中央静脉及汇管区周边可见大量真菌聚集、炎症细胞浸润以及纤维化形成、肝血窦可见陈旧性出血(图5);GYF76菌株感染后,不同品系小鼠肾脏均表现为慢性炎症、以大量中性粒细胞和巨噬细为主的炎性细胞浸润、部分肾小球坏死、肾盂见大量真菌,肝组织肝中央静脉及汇管区等境界清楚、肝血窦适度充血、局部脂肪变性及大部分组织无明显异常(图6)。提示H99T菌株和GYF76菌株感染后KM小鼠和Balb/c小鼠两种不同品系小鼠的肾脏、脑组织、肝脏组织病理变化特征基本相同。
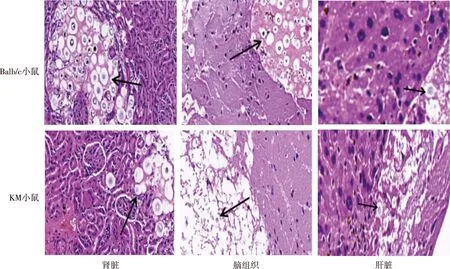
注:箭头所示为真菌感染灶。图5 新生隐球菌H99T感染后KM小鼠和Balb/c小鼠肾脏、脑组织及肝脏组织的病理学特征(HE,×400)Fig.5 Pathological changes in internal organs of the mice infected with C. neoformans H99T(HE,×400)
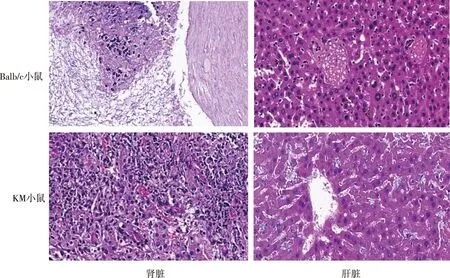
图6 GYF76菌株感染KM小鼠和Balb/c小鼠肾脏、肝脏组织的病理学特征(HE,×400)Fig.6 Pathological changes in internal organs of the mice infected with C. albicans GYF76 (HE,×400)
3 讨论
根据真菌感染部位的不同,可分为浅表真菌感染模型和深部真菌感染模型,多脏器感染时又被称为侵袭性真菌感染模型[17-20]。现有真菌物种中约300种可导致人类疾病,但是因真菌病导致死亡的病例中最常见病原体是念珠菌、曲霉菌及隐球菌[21-23]。所以,本研究采用了占首位的白念珠菌及隐球菌病的主要病原体新生隐球菌为主要研究对象。有研究已证明小鼠与人类疾病过程和宿主免疫反应的相似性,因此小鼠这类啮齿类动物是研究念珠菌和隐球菌发病机理的理想选择[24-25]。其实,影响动物模型构建过程中感染易感性的因素不仅包括小鼠品系,还包括接种菌株、接种物浓度及接种方法等[26]。人类在出生后不久就被白念珠菌定殖,念珠菌病最常见是内源性的[24]。不同与人类,小鼠通常不会被念珠菌定居,因此必须进行实验性感染,在相同免疫条件下筛选侵袭性真菌感染的最适浓度,避免动物快速死亡或持续存活情况发生,达到较为理想的死亡率[27-28]。本研究侵袭性真菌感染小鼠选用的是侧尾静脉注射方式,即由侧尾静脉向小鼠体内注射真菌,并将其注入血液中;小鼠静脉内注射真菌后,人为造成了菌血症,感染可迅速在全身传播,真菌在进入血液后数小时内侵入肾脏、脑组织、肝脏等多个器官,这也较为符合临床上侵袭性真菌播散感染的情况。
静脉注射真菌感染小鼠过程中,菌细胞黏附在宿主表皮或内皮细胞的表面,侵入宿主细胞,逃避免疫系统,在宿主环境中生存和繁殖,然后扩散到新组织,其死亡原因主要取决于真菌的败血症,但死亡率也会取决于小鼠的品系[29]。本研究中白念珠菌感染组AIDS来源GYWu27组死亡率最高,其次为VVC来源GYF76组、健康人来源N110组,说明念珠菌病的持续程度因不同的临床分离株而异,在系统感染小鼠模型中比较相同的品系或分离株时,毒力差异也很明显;研究表明白念珠菌感染不同品系小鼠的靶器官真菌负荷量Balb/c小鼠高于KM小鼠,感染期间真菌对宿主的损害也反映了宿主的免疫状态,因为相较于Balb/c小鼠,KM小鼠自身具有繁殖率和成活率高特点,所以相同条件下自身的抗病力和适应性更强。在该模型中,不同真菌菌株导致了不同的真菌负荷量,但真菌感染在大多数器官中得到控制,但白念珠菌在肾脏中及新生隐球菌在大脑中引起严重的疾病,并伴有免疫浸润的增加。
真菌感染时,组织反应的类型取决于机体与病原体之间的相互关系[29]。本研究表明侵袭性真菌感染动物模型感染后分离菌株真菌学培养结果皆为阳性,经鉴定确定为实验接种的病原菌。处死小鼠取组织标本发现,不同病原菌感染小鼠的组织病变集中位置和程度并不相同,侵袭性隐球菌感染小鼠病变集中于脑组织,其中可见大量炎性细胞浸润和真菌感染病灶,侵袭性念珠菌感染小鼠病变集中在肾脏,以慢性炎症为主。已有报道表明肾是小鼠白念珠菌侵袭性感染的靶器官[30],这与本研究的结果一致,但不同品系小鼠之间的脏器病理变化基本相同。
临床侵袭性真菌感染的主要问题之一是由于表现的非特异性症状导致感染的诊断困难,进一步导致了有效抗真菌治疗的延误,所以侵袭性真菌感染动物模型对于了解疾病的发生和发展及宿主与真菌之间复杂的相互作用至关重要。这些模型消除了经常从人类患者身上获取有问题的组织样本的麻烦,不仅是阐明真菌病分子和细胞发病机理的强大工具,还可以对新型抗真菌药、免疫调节剂及潜在研制的疫苗等进行体内的评估。而本研究采用静脉感染方式、以1×108CFU/L白念珠菌和1×109CFU/L新生隐球菌分别感染Balb/c小鼠和KM小鼠,可构建稳定的侵袭性真菌感染动物研究模型,为后续研究提供基础。
