菌丝特异性基因和Candidalysin对白念珠菌培养特性及致病性的影响*
2021-11-06王迪黄劲姚昌昊王梅竹程敏郭鑫瑶廖万清康颖倩
王迪, 黄劲, 姚昌昊, 王梅竹, 程敏, 郭鑫瑶, 廖万清, 康颖倩,7***
(1.贵州医科大学 基础医学院 微生物学教研室, 贵州 贵阳 550025; 2.贵州省微生物与人类健康关系研究人才基地 & 贵州省普通高校病原生物学特色重点实验室, 贵州 贵阳 550025; 3.贵州医科大学环境污染与疾病监控教育部重点实验室, 贵州 贵阳 550025; 4.贵州医科大学 基础医学院 生物化学与分子生物学教研室, 贵州 贵阳 550025; 5.海军军医大学长征医院 皮肤科, 上海 200003; 6.上海市医学真菌分子生物学重点实验室, 上海 200003; 7.贵州省烟草科学研究院, 贵州 贵阳 550009)
随着人类对真菌学认识的发展,真菌对人类健康的影响越来越明显[1]。由于免疫缺陷宿主数量的增加和抗真菌耐药性的增加,真菌感染已成为医院的重要问题,其死亡率和治疗的经济成本不断上升[2]。在真菌种类中,念珠菌是真菌病最常见的原因,其中白念珠菌(Candidaalbicans)由于较强的黏附能力比其他念珠菌更容易被发现[3]。如今,白念珠菌被认为是人类的主要真菌病原体,它是一种常见于口腔、肠道及阴道黏膜健康菌群中的真菌,是最常见的真菌感染之一[4-6],其感染可能是表面感染或全身感染,在免疫功能低下的患者中尤为常见, 在这些患者的发病率和死亡率均很高[7-8]。除了由于持续或严重念珠菌感染而导致的疾病外,据报道越来越多的疾病也显示出与念珠菌感染有关[9-10]。因此,白念珠菌在促进急性或慢性感染过程中的作用值得考虑,尤其是在其分泌由菌丝特异性基因(hypha-specific gene,ECE1)编码的毒素Candidalysin的情况下[11]。白念珠菌本身具有不同的形态,能在酵母、假菌丝及菌丝状态间进行转换,其发病机理特征之一就是菌丝态的产生,Candidalysin就是首个从人类真菌病原体中分离出来的溶细胞肽毒素[12]。白念珠菌ECE1基因编码的菌丝特异性蛋白是激活宿主表皮细胞应答反应所必需的[13],其中Candidalysin是念珠菌菌丝在侵袭过程中分泌,它能够不断积累并攻击宿主细胞膜,可以诱导p38-丝裂原活化蛋白激酶/C-Fos的激活和丝裂原活化蛋白激酶磷酸酶(mitogen activated protein kinase phosphatase 1,MKP1)的磷酸化信号,导致细胞膜通透性增加,直接驱动上皮损伤、激活上皮免疫和吞噬细胞吸引[13-14];这种毒素在真菌感染期间触发先天抗真菌免疫中起着重要作用,是白念珠菌黏膜感染至关重要的菌丝毒力因子[15-16],但ECE1基因及Candidalysin在白念珠菌全身感染中的作用有待进一步探索。鉴于白念珠菌作为威胁生命的真菌病原体的重要性,本研究拟利用白念珠菌感染Balb/c小鼠的慢性感染模型来研究白念珠菌菌株及各种遗传突变株中ECE1基因和Candidalysin对白念珠菌培养特性及致病性的影响。
1 材料与方法
1.1 材料
1.1.1白念珠菌实验菌株ece1Δ/Δ菌株(ECE1基因敲除菌株)、ece1Δ/Δ+ECE1菌株(ECE1基因敲除回补菌株)、BWP17菌株(CiP30质粒转化的亲本菌株)及M2174菌株(Candidalysin毒素敲除菌株),所有实验菌株均由英国伦敦国王学院Julian R.Naglik教授赠送。
1.1.2实验动物 4~6周龄无特定病原体级(specific pathogen free,SPF)Balb/c雌性小鼠70只,体质量18~20 g,购于贵州医科大学实验动物中心[SCXK(黔)2018-0001];实验开始前1周将小鼠饲养于小鼠笼具,自由进食和饮水,以利于适应后续实验环境。
1.1.3主要试剂和仪器 沙氏葡萄糖琼脂培养基(sabouraud’s glucose agar,SDA)及念珠菌显色培养基(法国科玛嘉CHROMagar),10%牛血清白蛋白、Spider培养基、甲醛、氯化钠、葡萄糖、三丁酸甘油酯琼脂基础及三丁酸甘油酯(北京索莱宝),引物(上海生工生物);微量可调加样器(法国Gilson),超低温冰箱(日本SANYO),手提式压力蒸气灭菌器(上海博迅),数显隔水式培养箱(杭州蓝天仪器),生物安全柜(青岛海尔),光学显微镜(日本Nikon),紫外分光光度计(上海元析)。
1.2 实验方法
1.2.1菌种复苏及菌液制备 将选取的ece1Δ/Δ菌株、ece1Δ/Δ+ECE1菌株、BWP17菌株、M2174菌株复苏解冻后传于SDA培养基上,37 ℃培养48 h,观察菌落特征。挑取SDA培养基中各菌株的单个菌落,转接至CHROMagar Candida培养基及50 mL沙氏液体培养基中,培养24~48 h观察;利用紫外分光光度计用生理盐水(Saline)将菌液浓度调整至2×108CFU/L,保存备用。
1.2.2胞外水解酶活力检测 制备牛血清白蛋白平板[17]、卵黄琼脂平板[18]及三丁酸甘油酯平板[19],将菌株接种至平板上并置于37 ℃恒温培养箱培养;培养5 d,观察各平板上菌落的沉淀圈或透明圈;以Pz值[Pz=菌落直径/(菌落直径+圈层直径)]表示水解酶的表达水平,并测量菌落直径和菌落加圈层的总直径,Pz值≤0.59表示水解酶高表达,0.60≤Pz值≤0.79表示水解酶中等表达,0.80≤Pz值<1.00表示水解酶低表达,Pz值=1表示不产此水解酶[20-21]。
1.2.3菌丝诱导实验 挑取“1.2.1”项下复苏培养的白念珠菌单个菌落重悬于Spider液体培养基中,并用紫外分光光度计调整菌悬液浓度至1×109个/L,加12 孔板、1 mL/孔,37 ℃培养3 h,于倒置显微镜下观察拍照;高倍镜下选取3个不同的视野,计数100个孢子中形成菌丝相的孢子数[22]。
1.2.4实验动物标记及分组 取70只实验小鼠用苦味酸进行标记,随机双盲法均分为BWP17组、ece1Δ/Δ组、ece1Δ/Δ+ECE1组、M2174组及Saline(阴性对照)组,14只/组,将“1.2.1”项下已经配制好浓度为2×108CFU/L的菌液和生理盐水通过侧尾静脉注射入Balb/c小鼠体内,注射0.2 mL/只,正常饲养。
1.2.5小鼠体质量、死亡情况及病理学特征评价 观察注射后30 d内各组Balb/c小鼠的体质量变化;观察注射后90 d内的各组小鼠死亡情况,对各组死亡小鼠及Saline组断颈处死小鼠采集心脏、肝脏、脾脏、肺脏、肾脏组织制作切片进行苏木精-伊红染色( hematoxylin-eosin staining,HE),镜下观察其病理学特征[23]。
1.3 统计学分析

2 结果
2.1 菌落特征
白念珠菌菌株及各种遗传突变株在SDA培养基上的菌落特征无明显差异,均表现为菌落较大,直径约1~2 mm,光滑湿润,呈奶油状圆形分布;感染小鼠的各组白念珠菌在CHROMagar Candida培养基上的菌落颜色显示为浅绿色到深绿色,ece1Δ/Δ+ECE1菌株菌落为深绿色,BWP17菌株和ece1Δ/Δ菌株的菌落为中等绿色,M2174菌株的菌落为浅绿色。见图1。
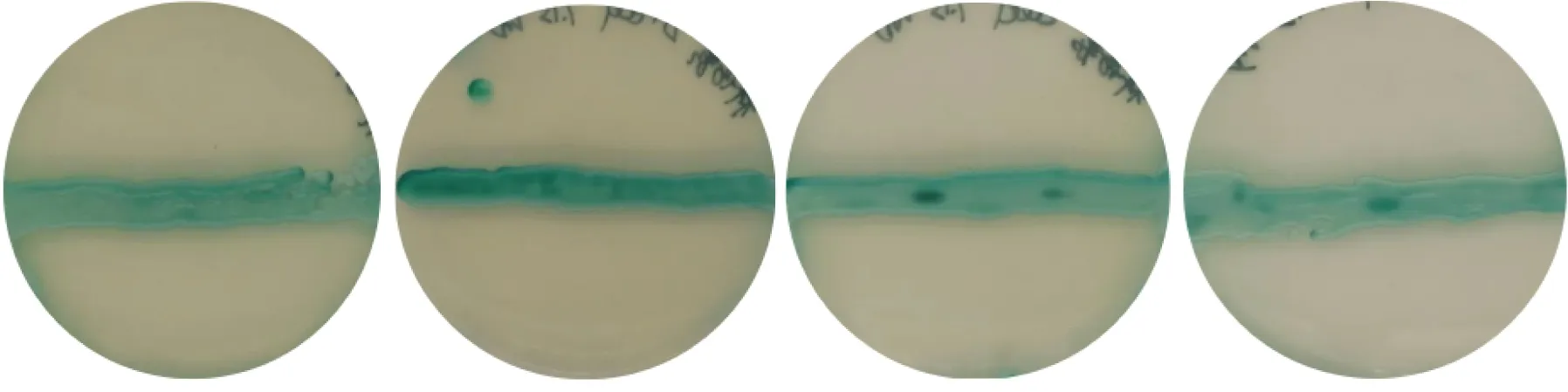
ece1Δ/Δ菌株 ece1Δ/Δ+ECE1菌株 BWP17菌株 M2174菌株图1 各组白念珠菌在CHROMagar Candida培养基上的菌落特征(肉眼观)Fig.1 Colony characteristics of C. albicans in CHROMagar Candida culture medium(naked-eye view)
2.2 胞外水解酶检测
胞外水解酶检测结果表明,除M2174菌株外,白念珠菌其余菌株体外培养第5天水解酶均为蛋白酶(secreted aspartyl proteinase,SAP)活力阳性、高表达,且表现为ece1Δ/ΔECE1菌株、BWP17菌株SAP的Pz值分别低于ece1Δ/Δ菌株(P<0.05);4种白念珠菌菌株均表现为磷脂酶(phospholipase,PL)活力阳性、高表达,脂肪酶(lipase,Lip)活力阴性,但各组间PL和Lip的Pz值比较、差异均无统计学意义(P>0.05)。见表1。
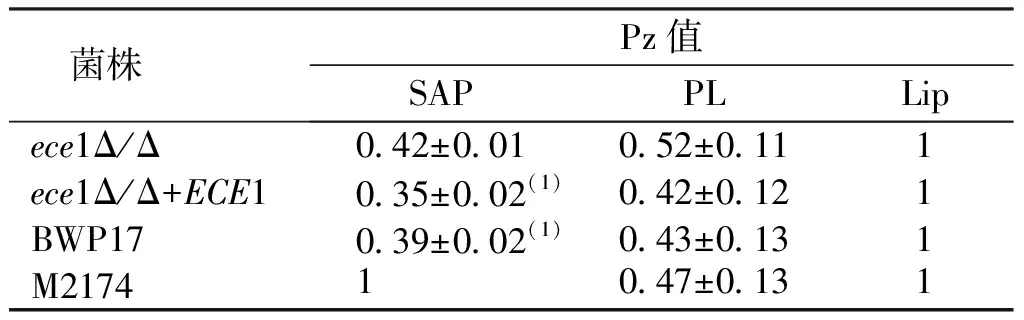
表1 各种白念珠菌SAP、PL及Lip活力Tab.1 SAP, PL, and Lip activities of C. albicans strains in different groups
2.3 菌丝形成能力
4种白念珠菌菌株的菌丝形成能力不同,差异有统计学意义(P<0.05);菌丝形成能力最强的是ece1Δ/Δ+ECE1菌株,其次为BWP17菌株和M2174菌株,最弱的是ece1Δ/Δ菌株。见表2和图2。

表2 各种白念珠菌菌株的菌丝形成能力Tab.2 Hyphal formation ability of C. albicans
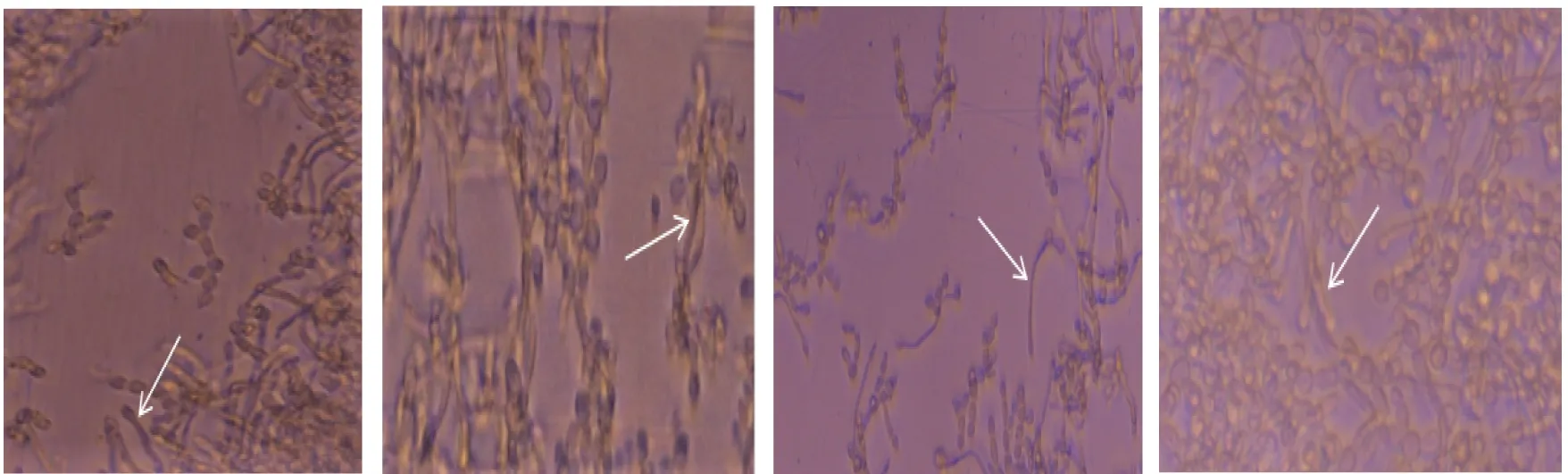
ece1Δ/Δ菌株 ece1Δ/Δ+ECE1菌株 BWP17菌株 M2174菌株注:白色箭头所示为白念珠菌菌丝体。图2 Spider液体培养基中各种白念珠菌的菌丝生长情况(光镜,×400)Fig.2 Mycelia growths of C. albicans in Spider liquid culture medium(light microscopy,×400)
2.4 小鼠体质量变化
BWP17组、ece1Δ/Δ+ECE1组在菌液注射感染24 d后小鼠体质量出现小幅缓慢回升,Saline组的小鼠30 d内的体质量一直在增加;第7、14、21及28天各观察时间点内各菌株感染组与Saline组相比,体质量均有降低(P<0.05)。见表3。
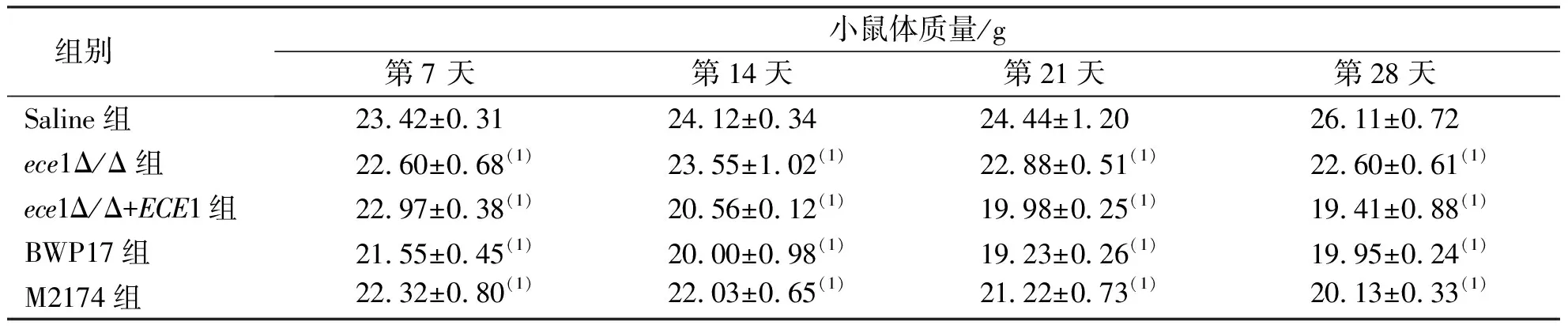
表3 感染后30 d内各组小鼠的体质量变化Tab.3 Changes of body mass in 30 days in mice infected with C. albicans from different groups
2.5 生存曲线
各组小鼠感染白念珠菌后第5天陆续出现死亡,第28天时死亡率为21.43%~57.14%,第90天时死亡率为78.57%~100.00%;采用Kaplan-Meier法绘制生存曲线,并采用log-rank检验显示各组小鼠生存情况比较,差异有统计学意义(P<0.001)。见图3。
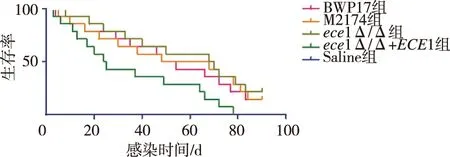
图3 各组小鼠白念珠菌感染后90 d内的生存曲线Fig.3 Survival curves covering 90 d after mice were infected with C. albicans in different groups
2.6 病理学特征
HE染色结果显示,ece1Δ/Δ组、ece1Δ/Δ+ECE1组、BWP17组及M2174组小鼠心脏、肺脏及脾脏未见明显异常,肝脏呈慢性炎症表现、局部肝血窦有轻微扩张充血;ece1Δ/Δ组小鼠肾实质为慢性炎症表现、肾盂见大量真菌菌丝,ece1Δ/Δ+ECE1组小鼠肾实质见大量慢性炎症细胞浸润、间质可见出血,M2174组小鼠肾脏见大量炎症细胞浸润、部分肾小球崩解、局部间质内出血、肾盂内见大量中性粒细胞浸润,BWP17组小鼠肾实质慢性炎症、局部肾小球崩解、部分肾小管内可见脓肿。见图4。
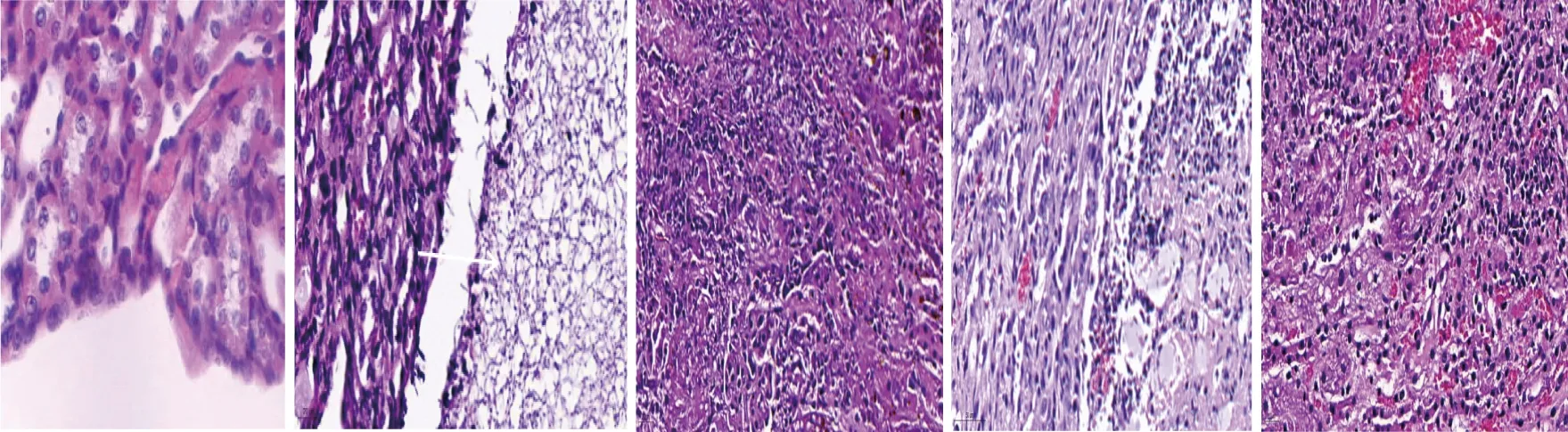
Saline组 ece1Δ/Δ组 ece1Δ/Δ+ECE1组 BWP17组 M2174组图4 各组小鼠肾脏组织的HE染色结果(400×)Fig.4 HE staining results of mouse kidney tissue in different groups(400×)
3 讨论
在白念珠菌的毒力因子中,酵母相到菌丝相的形态转化是非常重要的一种,菌丝体为造成该生物体毒力的主要因素之一,无菌丝相的白念珠菌突变体是没有毒力的[4]。转变为菌丝形态的白念珠菌则更易侵袭宿主组织,从而获取更为丰富的营养物质,Candidalysin就是最近新发现的这样一种白念珠菌肽毒素[1]。它可以促进真菌获取营养物质,并侵入深部组织,已成为关键的菌丝相关毒力决定因素[1]。本研究中通过菌丝形成能力的检测也发现ece1Δ/Δ+ECE1基因敲除回补菌株的菌丝形成能力最强,缺乏编码Candidalysin肽毒素的ECE1基因的突变ece1Δ/Δ菌株在一般情况下毒性较低,相对应的ece1Δ/Δ基因敲除菌株的菌丝形成能力则最弱,感染小鼠的白念珠菌菌株及各种遗传突变株的菌丝形成能力之间存在着明显差异。
白念珠菌为适应宿主的环境条件,演化出了多种机制,其中包括了白念珠菌的形态转变、分泌胞外水解酶等,分泌型水解酶是白念珠菌重要的致病因素,分泌型天冬氨酸蛋白酶、磷脂酶及脂肪酶等能够介导白念珠菌入侵宿主,并逃避宿主抗真菌的感染免疫,在白念珠菌致病中起了关键作用[24-25]。本研究表明,感染小鼠的各白念珠菌菌株及各种遗传突变株之间胞外水解酶活力存在不同程度的差异,ece1Δ/Δ+ECE1组和BWP17组菌株蛋白酶活力强,但M2174组菌株蛋白酶活力为阴性,说明Candidalysin分泌的缺失影响了白念珠菌蛋白酶的活力表达,白念珠菌内源基因ECE1的存在对白念珠菌胞外水解酶的表达也发挥了正向促进作用。本研究采用尾静脉感染是血源性感染的方式,磷脂酶作为血源性感染的重要毒力因子,实验中4组白念珠菌血源性感染的磷脂酶表达也都为高表达,同时胞外水解酶活力的表达水平差异也引起了感染小鼠的差异性死亡。
利用小鼠尾静脉注射的方式感染Balb/c小鼠,在实验过程中,各组小鼠在感染后体质量大多出现了不同程度的下降,此时处于真菌的急性感染期,加之采用了尾静脉注射的有创操作,影响了小鼠的生长状态;后期小鼠体质量缓慢回升,说明白念珠菌感染激活了小鼠自身的免疫系统,进入了慢性感染阶段,体质量有所回升。在白念珠菌系统感染小鼠后,感染3 d后小鼠就出现了死亡情况,有创操作恢复不良引起了小鼠死亡,1周后小鼠继续死亡,白念珠菌的急性感染发挥了作用。在感染过程中BWP17野生菌株组、ece1Δ/Δ+ECE1基因敲除回补菌株组小鼠体质量下降较快,但ece1Δ/Δ基因敲除菌株组的小鼠体质量仍在缓慢上升,直至15 d以后才出现缓慢下降。研究发现随着病程的进展,4种不同组别白念珠菌死亡率从高到低依次为ece1Δ/Δ+ECE1基因敲除回补菌株组、M2174基因敲除菌株组、BWP17野生菌株组、ece1Δ/Δ基因敲除菌株组。由于ECE1基因是白念珠菌菌丝生长或质膜完整性所必需的,是上皮损伤和菌丝发育之间的“关键环节”[4]。ece1Δ/Δ菌株作为ECE1基因敲除菌株,影响了白念珠菌的菌丝发育,而在小鼠系统性感染中,菌丝形成缺陷的白念珠菌突变体,其毒力减弱,小鼠死亡率降低,说明ECE1基因及编码的Candidalysin增强了白念珠菌对小鼠的致病能力。ECE1基因编码一个含271个氨基酸的前体蛋白,该蛋白可以被Kex8p酶切割成8个较小的肽(ece1-Ⅰ~ece1-Ⅶ),Candidalysin就是由其前体蛋白通过真菌酶促处理而产生并从菌丝中分泌的Ece1-Ⅲ活性肽[1]。M2174菌株作为Candidalysin肽毒素敲除菌株,除不产生Candidalysin外,其他7个较小的肽依旧可以产生[15],说明在白念珠菌感染小鼠过程中,除Candidalysin发挥了毒力作用以外,另外的7种相关分泌肽同样也有相应的协同毒力作用。
肾脏作为白念珠菌系统性感染动物模型的靶器官,在本研究中各组小鼠肾脏的病变情况最为明显,肾盂、肾盏扩张,内见大量白念珠菌菌丝,其他心肝脾肺等病变情况较轻,主要都是以引起感染器官的慢性炎症为主。白念珠菌菌株及各种遗传突变株引起的慢性炎症考虑与Candidalysin在感染过程中可以诱导许多炎症细胞因子有关,如白细胞介素-1α(interleukin-1α,IL-1α)/β、白细胞介素-6(interleukin-6,IL-6)及IL-17等;在真菌毒素的作用下,IL-1α/β、IL-6及IL-17等发挥协同作用,进一步增强促炎信号,建立前馈激活环,加重了感染的严重性,最终促进了宿主对小鼠和人类的真菌炎症反应[26-27]。
综上,白念珠菌虽然对于环境具有高度的适应能力,但在白念珠菌感染小鼠过程中,ECE1基因及编码的Candidalysin肽毒素发挥了重要的毒力作用。通过了解宿主与白念珠菌之间潜在的病原或防御相互作用机制,可以更好地探讨在病原体感染过程中发挥重要因素的毒力因子[28]。一旦揭示了潜在的分子机制,就有可能开发出各种治疗策略,以防止由白念珠菌感染引起的组织损伤和死亡。
