人MAPK3基因原核表达载体的构建及鉴定*
2021-11-06石松薛殿婷张培石静孙达权
石松, 薛殿婷, 张培, 石静**, 孙达权**
(1.黔东南苗族侗族自治州人民医院 重症医学科, 贵州 凯里 556000; 2.贵州医科大学 基础医学院 生化与分子生物学教研室, 贵州 贵阳 550025)
人丝裂原激活蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)又叫细胞外信号调节激酶1(extracellular signal-regulatedkinase 1,ERK1),是由第16号染色体p11.2处的MAPK3基因编码,是大鼠肉瘤原癌蛋白(rat sarcoma proto-oncoprotein,Ras)-快速加速纤维肉瘤激酶(rapidly accelerated fibrosarcoma kinase,Raf)-丝裂原活化蛋白激酶的激酶(mitogen-activated protein kinase kinase,MEK)-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的关键成员之一[1-3]。有研究表明,丝裂原活化蛋白激酶1/3(mitogen-activated protein kinase 1/3,MAPK1/3)与细胞的生长增殖、自噬存活及迁移等功能密切相关[4-8];同时,MAPK1/3也参与多种病理进程,许多原癌基因编码的蛋白可通过ERK/MAPK信号通路实现相应的细胞学效应,而ERK/MAPK信号通路的持续激活可以加速诱发肿瘤发生、发展和恶化[9-13]。目前,虽然有许多文献描述了MAPK1/3在肝癌等多种肿瘤中的作用,但单独研究MAPK3对肝癌作用的文献不多。本研究克隆了人MAPK3基因的蛋白编码区、构建原核表达载体、用IPTG诱导MAPK3在细菌中表达,并用Sepharose 4B纯化MAPK3蛋白,为后续研究MAPK3的生物学功能奠定基础。
1 材料与方法
1.1 实验材料
1.1.1细胞和血清来源 正常人肝细胞系HL-7702细胞购自中科院上海细胞库,新生牛血清购自杭州四季青。
1.1.2主要试剂和仪器 固体粉末细胞培养基RPMI-1640(美国Gibco),TRIzol(美国Invitrogen),mRNA反转录试剂盒、高保真Taq DNA polymerase、3′末端加脱氧核糖腺苷酸(deoxyriboadenosine,A)试剂盒、脱氧核糖胸苷酸-脱氧核糖腺苷酸(deoxythymidylate-deoxyriboadenosine,T-A)克隆试剂盒、大肠杆菌RY13株的第一种限制性内切酶(escherichia coli RY13Ⅰ,EcoR Ⅰ)、黄单胞菌的第一种限制性内切酶(Xanthomonas holcicola Ⅰ,XhoⅠ)、T4 DNA ligase及DNA纯化回收试剂盒(大连宝生物),谷胱甘肽硫转移酶(glutathione S-transferase,GST)标签抗体(南京巴傲得生物),Glutathione Sepharose 4B树脂(美国Pharmacia),质粒小量抽提试剂盒和感受态细菌(北京天根生物),pGEX-4t-1保存于本实验室,引物合成和DNA测序委托上海生工完成。聚合酶链式反应仪(polymerase chain reaction machine,PCR仪)(美国伯乐),DYCP-32B琼脂糖凝胶水平电泳仪、DYCZ-24DH蛋白垂直电泳仪及DYCZ-40G转印电泳仪(北京六一)。
1.2 实验方法
1.2.1细胞培养 人肝细胞HL-7702置于含10%新生牛血清的RPMI-1640培养液在37 ℃、5% CO2培养箱中培养。
1.2.2总RNA抽提与反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR) 细胞在直径6 cm的培养皿中培养融合至70%时,弃培养液,灭菌的磷酸盐缓冲液(phosphate buffer saline,PBS)清洗贴壁细胞3次,取TRIzol 1mL按说明书抽提细胞内总RNA,对抽提的RNA进行浓度定量和琼脂糖凝胶电泳检测。取总RNA 4 μg,按反转录试剂盒说明书配制反应体系,42 ℃反应60 min,将mRNA反转录成cDNA。按NCBI GenBank中人MAPK3基因序列(NM_002746)设计引物,上游引物为5′-TGAATTCATGGCGGCGGCGGCGGCTCAGGGGG-3′,下游引物为5′-TCTCGAGCTAGGGGGCCTCCAGCACTCCGGGC-3′。为方便构建目的DNA质粒,本研究在上游引物的5′末端插入EcoR Ⅰ酶切位点,在下游引物的5′末端插入XhoⅠ酶切位点。以cDNA为模板,按说明书加入上和下游引物、dNTPs及高保真DNA聚合酶,按94 ℃预变性3 min,94 ℃、30 s,56 ℃、30 s,72 ℃、1.5 min,循环31次;72 ℃、10 min的反应条件扩增人MAPK3基因中的蛋白编码区DNA片段。
1.2.3T-A克隆与DNA测序鉴定 取1%琼脂糖凝胶电泳分离PCR产物,胶回收试剂盒回收目的DNA片段。回收的DNA片段用加“A”试剂盒根据说明书配制反应液,65 ℃加“A”,产物与TA克隆载体pMD18-T于16 ℃连接120 min。连接产物用热激法导入感受态细菌DH5α,氨苄青霉素琼脂糖平板培养基筛选培养。当单克隆菌落形成后,挑取菌落进行扩大培养,用质粒小量抽提试剂盒抽提质粒,获得的质粒用EcoR Ⅰ/XhoⅠ进行双酶切,1%琼脂糖凝胶电泳鉴定,条带大小与预期一致的质粒进行DNA送样测序,测序结果正确的质粒命名为pMD18-T-MAPK3GST。
1.2.4重组原核表达质粒pGEX-MAPK3GST的构建 用EcoR Ⅰ/XhoⅠ对pMD18T-MAPK3GST和原核表达载体pGEX-4t-1分别进行双酶切,从前者质粒中获取MAPK3GST目的DNA片段,从后者中获取骨架载体,回收的DNA片段用T4 DNA ligase于16 ℃连接120 min;连接产物用热激法导入感受态细菌DH5α中;含有氨苄青霉素的Luria-Bertani(LB)固体培养板筛选培养,挑取单克隆菌落扩大培养,抽提质粒和双酶切鉴定,通过DNA测序进行再次验证,所需重组质粒命名为pGEX-MAPK3GST。
1.2.5原核诱导表达GST-MAPK3融合蛋白 纯化的原核表达质粒pGEX-MAPK3GST转化感受态Rosetta细菌,含氨苄青霉素的LB固体培养基筛选培养,挑取菌落并扩大培养;取菌液1 mL置于200 mL LB 培养基中,200 r/min于37 ℃摇菌至450 nm波长的光密度(λ=450 nm optical density,OD450 nm)为0.4,摇床温度调至21 ℃,加10 mmol/L异丙基-β-D-硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)诱导GST-MAPK3融合蛋白表达2 h。
1.2.6十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)与考马斯亮蓝染色 取诱导前/后的菌体和蛋白等样品进行制样。菌体中加入含有1%Triton X-100的PBS 1 mL,并加入终浓度1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF);用匀浆器反复匀浆,4 ℃、12 000 r/min离心10 min,取上清液和沉淀加入SDS上样缓冲液,100 ℃煮沸5 min,瞬时离心。蛋白样品直接加入SDS上样缓冲液制样,样品进行SDS-PAGE,当电泳结束后剥离变性胶、固定液固定后用0.25%(W/V)的考马斯亮蓝R-250室温染色2 h、用脱色液脱去背景色。
1.2.7蛋白免疫印迹 样品经SDS-PAGE后,用1×转膜缓冲液(CAPS/L 2.2 g,10%甲醇,NaOH调节pH值至10.5)对变性胶室温平衡30 min,冰浴中用500 mA转印45 min;转印结束后剥离聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),利用三羟甲基氨基甲烷溶液配制的氯化钠和吐温20溶液(tris-buffered saline and tween 20,TBST)配制的5%BSA于37 ℃封闭30 min;TBST清洗3次,10 min/次;TBST稀释的一抗4 ℃孵育过夜,TBST清洗3次,10 min/次;用TBST稀释的辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗于室温孵育2 h,TBST清洗3次、10 min/次;电化学发光液(electrochemiluminescence,ECL)进行显色反应。
1.2.8蛋白纯化和鉴定 1 mmol/L IPTG于20 ℃诱导4 h,4 ℃ 12 000 r/min 离心10 min,收集菌体;加含1mmol/L PMSF的PBS后,冰浴超声破碎(超声功率为300 W,5 s/次、间隔5 s、超声50次);菌体破碎,液体转入50 mL离心管中,4 ℃ 下7 500 r/min离心15 min,分别取上清和沉淀;分别用变性胶上样缓冲液制样进行SDS-PAGE,电泳结束后进行考马斯亮蓝R-250染色和蛋白免疫印迹实验;确定目的蛋白在上清蛋白液中后,将上清蛋白液与Glutathione Sepharose 4B琼脂糖凝胶于4 ℃杂交60 min、1 000 r/min离心15 s、收集琼脂糖凝胶,PBS清洗3次、10 min/次,10 mmol/L谷胱甘肽洗脱液于室温摇床上孵育30 min,4 ℃下1 000 r/min离心15 s,收集洗脱液,制备样品进行SDS-PAGE,考马斯亮蓝R-250染色和蛋白免疫印迹验证。
2 结果
2.1 人MAPK3基因编码区克隆及其原核表达质粒pGEX-MAPK3GST构建
首先通过RT-PCR获得人靶基因MAPK3的蛋白编码区DNA片段,其长度为1.2 kb,利用T-A克隆将目的基因插入pMD18-T中,构建了含有靶基因的pMD18-T-MAPK3GST;DNA测序结果证明pMD18-T-MAPK3GST正是所需质粒,MAPK3基因蛋白编码区无任何点突变;用限制性核酸内切酶双酶切原核表达质粒pGEX-4t-1和pMD18-T-MAPK3GST,重组后获得pGEX-MAPK3GST,酶切鉴定证实该质粒与预期结果一致;DNA测序结果显示人MAPK3蛋白编码区正确插入了原核表达载体中,成功构建了原核表达质粒pGEX-MAPK3GST。见图1。
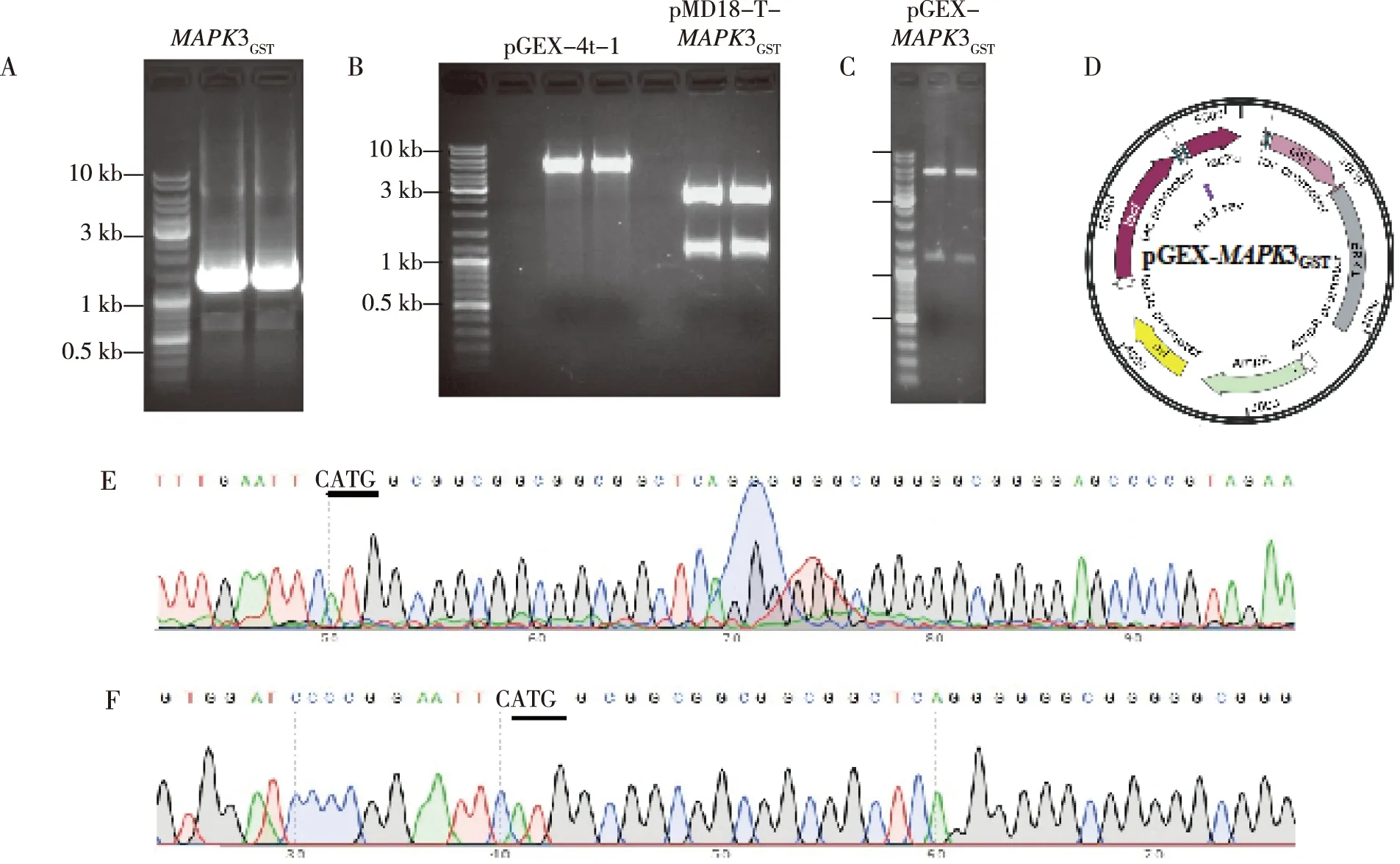
注:A为RT-PCR扩增MAPK3基因的蛋白编码区,B为EcoR Ⅰ/Xho Ⅰ双酶切原核表达质粒pGEX-4t-1和pMD18-T-MAPK3GST,C为EcoR Ⅰ/Xho Ⅰ双酶切重组原核表达质粒pGEX- MAPK3GST,D为pGEX- MAPK3GST质粒图谱,E为pMD18-T-MAPK3GST DNA测序,F为pGEX- MAPK3GST DNA测序。图1 人MAPK3基因克隆及其原核表达载体pGEX-MAPK3GST构建Fig.1 Cloning of human MAPK3 gene and construction of its prokaryotic expression plasmid pGEX-MAPK3GST
2.2 MAPK3融合蛋白表达、纯化及鉴定
将重组的原核表达质粒pGEX-MAPK3GST导入Rosetta细菌(DE3)中,用IPTG诱导GST-MAPK3融合蛋白表达。结果如图2所示,当细菌被诱导后在70 kDa之上出现了大量的蛋白;破碎菌体后,分别对上清液和沉淀进行变性胶电泳和考马斯亮蓝染色,发现诱导蛋白同时出现在上清和沉淀中;用Glutathione Sepharose 4B琼脂糖凝胶与上清液杂交,获得的蛋白液进行变性胶电泳和考马斯亮蓝染色,在70 kDa之上出现了单一的蛋白条带;蛋白免疫印迹结果显示,该目的条带正是GST-MAPK3融合蛋白。
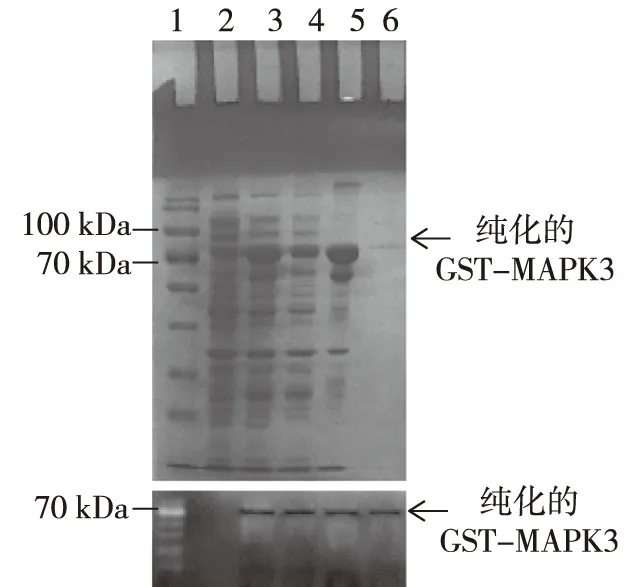
注:1为Thermo Scientific PageRuler Pierce 26616,2为未诱导的细菌,3为IPTG诱导的细菌,4为菌体破碎后的上清液,5为菌体破碎后的沉淀物,6为纯化的GST-MAPK3融合蛋白。图2 融合蛋白GST-MAPK3的考马斯亮蓝染色及蛋白免疫印迹分析Fig.2 Coomassie bright blue staining and Western blot of the purified fusion protein GST-MAPK3
3 讨论
MAPK家族成员较多,如p38MAPK、JNK等,且不断有新成员加入,这些成员参与了真核细胞的重要信号转导和网络调控,影响多种细胞的生长、增殖、分化、迁移、凋亡及炎症等生理[14]。不同的MAPK具有相似的作用,也存在各自特异的生物学功能[15]。在这些成员中,由于MAPK3与MAPK1在蛋白质一级结构上具有85%的相似性,因此具有诸多类似的生物学功能,两者也通常被归为一类并写成MAPK1/3或者ERK1/2[14-15]。尽管如此,两者之间蛋白结构和生物学功能仍有差异,与分子量42 kDa的MAPK1相比,MAPK3的N-末端多了一段特有的氨基酸序列,使其分子量比MAPK1多出了2 kDa,导致胞质中磷酸化活化的MAPK3入核速度低于MAPK1,因此细胞核内MAPK3整体磷酸化水平低于MAPK1的磷酸化水平,使MAPK3携带细胞增殖信号的能力下降[15]。此外,MAPK3还有许多不同于MAPK1的特异生物学功能,能够诱导脂肪细胞分化、引起肥胖[16];能诱导破骨细胞,形成和保护N-甲基-D-天冬氨酸诱导的视网膜损伤[17]。因此,除了研究MAPK1/3的共同生物学功能外,非常有必要单独研究MAPK3的生物学功能。为研究MAPK3蛋白在肝脏生理条件下和病理过程中的生物学功能,首先需要获得MAPK3蛋白。为此本课题组通过TRIzol法从人肝细胞中抽提获得总RNA,以此总RNA为模板通过RT-PCR体外扩增获得人MAPK3基因的蛋白编码区,利用DNA测序技术验证体外扩增获得的cDNA片段正是人MAPK3基因的蛋白编码区,且未发生任何突变;随后将该cDNA片段通过限制性核酸内切酶EcoR Ⅰ/XhoⅠ插入到原核表达载体pGEX-4t-1中,构建重组原核表达质粒pGEX-MAPK3GST;将重组质粒用热激法导入细菌Rosetta中,利用IPTG诱导宿主细菌表达可溶性融合蛋白GST-MAPK3,菌体破碎和高速离心获取含有GST-MAPK3的蛋白混合液,再利用GST标签的特性通过Glutathione Sepharose 4B琼脂糖凝胶亲和层析纯化GST-MAPK3,用考马斯亮蓝法和蛋白免疫印迹法分别验证蛋白纯度及蛋白特异性,最终获得较纯的MAPK3蛋白,为下一步研究MAPK3的生物学功能奠定了基础。
本研究利用了一种常用的、体外有效获取基因片段的技术方法RT-PCR来获取人MAPK3基因蛋白编码区,该技术始于1985年,现已成为当前分子生物学领域应用最广和最热门的一项技术[17-19]。该技术的广泛普及得益于多种性能的Taq DNA聚合酶的开发和创新[20-22]。本研究利用了一种莫罗尼鼠白血病病毒(moloney murine leukemia virus,MMLV)来源、通过基因改造的可抑制RNA高级结构和错配延伸的反转录酶及高保真长链扩增DNA聚合酶,单次实验就实现了从人肝细胞总RNA中获得了MAPK3基因蛋白编码区。
原核表达是一种大量、快速制备目的蛋白的有效方法,与真核表达和体外无细胞翻译系统相比,其具有目的蛋白表达量多、蛋白制备和纯化程序简单及原材料经济等优点,是有效获取目的蛋白的重要方式之一[23-24]。本研究通过重组原核表达质粒pGEX-MAPK3GST在细菌中大量诱导表达融合蛋白GST-MAPK3,并利用融合蛋白中的GST标签增加目的表达蛋白的水溶性,使原核表达的蛋白不容易形成包涵体,使目的蛋白在自然条件下正确折叠;同时,利用GST标签蛋白与Glutathione Sepharose 4B具有亲和力的特性,通过亲和层析从细菌蛋白混合液中分离纯化MAPK3目的蛋白。
研究表明,MAPK1/3能够促进细胞中角蛋白18(cytokeration 18,CK18)再表达,而表达的CK18可能会反向作用于MAPK1/3,影响其激酶活性,从而反馈性调控细胞生理和细胞活动;另一方面,蛋白激酶C(protein kinase C epsilon,PKC)活性可以调控MAPK1/3的活性[25],而PKC与CK18的磷酸化具有密切联系,本研究成功克隆人MAPK3基因并获得MAPK3蛋白,可用于体外研究MAPK3对CK18的磷酸化作用。因此,在获得了纯化的MAPK3融合蛋白的基础上,为后续研究MAPK3、PKCε及CK18之间的关系奠定了基础。
