PNU介导Seipin调控BV2细胞降解Aβ寡聚体的机制研究*
2021-11-06张捷何军熊浪陈道慧彭宁黎婷婷任真奎禹文峰吴昌学
张捷, 何军, 熊浪, 陈道慧, 彭宁, 黎婷婷, 任真奎,2, 禹文峰, 吴昌学
(1.贵州省第二人民医院 检验科, 贵州 贵阳 550004; 2.贵州医科大学 分子生物学重点实验室, 贵州 贵阳 550004)
阿尔茨海默病(AD)是一种好发于中老年人的痴呆性疾病,其病理表现为细胞外β-淀粉样蛋白(amyloid-β,Aβ)聚集形成的老年斑块(senile plaque,SP)、细胞内高磷酸化的tau蛋白组成神经纤维结节(intracellular neurofibrillary tangles,NFTs)、神经元坏死或功能失活及突触受损等[1-2]。已知AD的病理机制有大脑神经元Aβ的异常聚集、神经炎症、氧化应激和自噬功能失调等[3-4]。随着对AD发病机制研究的不断深入,科学家提出有效抑制大脑内Aβ的异常聚集,可能是治疗AD的一个有效靶点[5-6],但其疗效也一直存在争议。因此,寻找有效的小分子化合物或药物调控清除脑内Aβ寡聚体对AD的治疗具有一定的意义。PNU是α7烟碱型乙酰胆碱受体的激动剂,研究认为PNU在AD的动物模型、急性肺损伤模型及LPS诱导的神经炎症模型等皆有保护作用,但是其确切的分子机制尚不清楚[7-8]。本课题组的前期研究发现,PNU能够激活PI3K / Akt / mTOR自噬信号通路,且伴随着Aβ水平的降低[9]。Seipin是一个定位于内质网上的多次跨膜蛋白,对脂滴的形态具有重要调控作用[10-11],其突变导致2型先天脂肪营养不良;Seipin在中枢神经系统中高表达,在AD和缺血性脑卒中细胞、动物模型中均有研究报道[12]。研究发现Seipin可以调控细胞的自噬水平,并在Seipin N88S / S90L突变体转基因小鼠中亦检测到自噬的激活,突变体细胞内免疫荧光显示自噬标志物微管相关蛋白1轻链3 (LC3)的亚细胞位置与突变的Seipin蛋白高度重叠[13-14],提示Seipin与自噬存在联系。因此,本研究拟用Aβ处理的BV2小胶质细胞(简称BV2细胞)模型探讨PNU对BV2细胞Seipin蛋白表达、自噬功能,并探讨分析二者之间相互调控的分子机制。
1 材料与方法
1.1 主要材料与试剂
BV2细胞购于中科院上海细胞库,PNU282987和Aβ药物购自Sigma公司,LC3和Beclin-1抗体购自美国CST公司,Aβ抗体购自Gentex公司,Seipin抗体购自美国Abcam公司。Seipin shRNA慢病毒及阴性对照慢病毒购自上海吉凯基因生物公司,RNAi靶序列为GTAGAACTCTACTCTGACTAT,阴性对照插入序列为TTCTCCGAACGTGTCACGT。
1.2 研究方法
1.2.1BV2细胞的培养 将购买的BV2细胞冻存管放入之前预热好的37 ℃恒温水浴锅中融化,避免慢融;将管内的细胞悬液转入含完全培养基的15 mL离心管中,1 000 r/min离心5 min;丢弃上清液,再加入培养基重悬细胞,之后接种于培养瓶中,轻轻摇动培养瓶使细胞较散在地铺于培养瓶底面,培养瓶置于5 % CO2、37 ℃的培养箱中进行培养;根据镜下细胞状态更换细胞培养基。
1.2.2CCK8法筛选Aβ最适造模浓度 Aβ作为诱导AD体外模型的药物,用CCK-8法检测不同浓度Aβ(0、0.1、1、5、10及30 μmol/L)对BV2细胞的损伤作用,参照实验室前期实验所使用的方法筛选Aβ最适浓度,处理24 h。
1.2.3病毒感染实验 用Seipin shRNA慢病毒及阴性对照慢病毒感染BV2细胞,参照实验室前期实验所使用的方法,培养观察细胞荧光,获得阴性对照细胞与Seipin低表达细胞。
1.2.4细胞分组 根据1.2.2获得的造模浓度,将细胞分为正常组(未做任何处理)和Aβ组(Aβ孵育24 h),采用Western Blot检测Aβ处理24 h细胞的Seipin蛋白表达水平。为了探索PNU对Aβ的抑制作用,将细胞分组为Aβ组(Aβ处理24 h)和Aβ+PNU组(5 μmol/L PNU处理细胞18 h、再加入Aβ孵育24 h),观察Aβ的表达情况;为了探索PNU对Seipin及自噬的影响,设置正常组(未做任何处理)与PNU组(5 μmol/L PNU处理细胞18 h),观察Seipin以及LC3和Beclin-1的表达情况;为了验证慢病毒对Seipin的敲低效果,设置阴性对照组(非靶向性慢病毒)和si-Seipin组(靶向Seipin 的siRNA慢病毒),用Western blot检测Seipin表达水平;为了探索Seipin在PNU激活自噬及抑制Aβ过程中的重要性,设置阴性对照+Aβ组、阴性对照+Aβ+PNU组、si-Seipin+Aβ+PNU组,采用Western blot检测Aβ和LC3的表达水平。
1.2.5Western Blot检测蛋白表达水平 将上述各组细胞提取的蛋白样品与适量5×Buffer混匀,沸水变性10 min,室温冷却备用;用12% SDS-PAGE凝胶以40 mA电流进行电泳,PVDF膜在冰浴中转膜2 h,封闭液室温封闭1 h, TBST洗涤2次,5 min/次;将实验所用一抗4 ℃孵育过夜,之后TBST洗涤3次,5 min/次;再以相应二抗室温孵育2 h,TBST洗涤3次,10 min/次,用ECL发光液进行显色。用曝光仪获取图像结果,并用ImageJ计算灰度值,总蛋白以β-actin 为内部参照进行统计学分析。
1.3 统计学分析

2 结果
2.1 CCK8法筛选Aβ最适造模浓度
用不同浓度的Aβ处理BV2细胞,CCK8结果显示:随着Aβ浓度的增加,细胞存活率逐渐降低。与0 μmol/L相比,细胞经10 μmol/L的Aβ处理后其细胞存活率显著下降30%;而在其他浓度下细胞受损较轻或较严重,均不适于诱导AD细胞模型来进行相关研究观察。因此,选择浓度为10 μmol/L Aβ作为建模浓度(图1)。
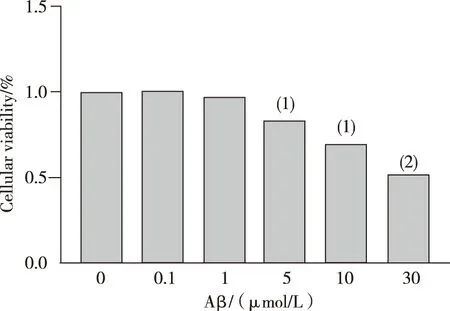
注:与0 μmol/L比较,(1)P<0.05,(2)P<0.01。图1 不同浓度Aβ处理的细胞存活率Fig.1 The survival rate of cells treated with different concentrations of Aβ
2.2 Aβ处理后BV2细胞中Seipin蛋白水平
在Aβ诱导的BV2细胞模型检测Seipin蛋白的表达,结果显示,经Aβ处理后BV2细胞中Seipin蛋白表达水平降低,差异有统计学意义(P<0.05)。见图2。

注:(1)与正常组比较, P<0.05。图2 各组BV2细胞中Seipin蛋白表达Fig.2 The expression of Seipin in each group
2.3 Aβ作用BV2细胞经PNU处理后Aβ表达
为了验证PNU能抑制Aβ表达,BV2细胞经PNU处理18 h后,再用Aβ处理24 h;结果显示,与Aβ组比较,PNU能够减少Aβ的水平,差异有统计学意义(P<0.05)。见图3。
2.4 BV2细胞经PNU处理后Seipin表达
为了探索PNU对Seipin表达的影响,在BV2细胞中加入PNU处理。结果显示,与正常组比较,PUN组BV2细胞中Seipin蛋白表达增加,差异有统计学意义(P<0.05)。见图4。

注:(1)与Aβ组比较, P<0.05。图3 PNU处理后各组BV2细胞Aβ蛋白表达Fig.3 The expression of Aβ treated by PNU in each group

注:(1)与正常组比较,P<0.05。图4 PNU处理后各组BV2细胞中Seipin蛋白表达Fig.4 The expression of Seipin treated by PNU in each group
2.5 BV2细胞经PNU处理后自噬相关蛋白表达
结果显示,与正常组比较,PNU组BV2细胞自噬相关蛋白LC3和Beclin-1表达增加,差异有统计学意义(P<0.05)。见图5。
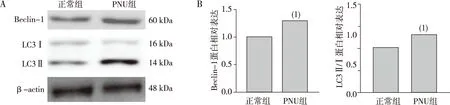
注:(1)与正常组比较, P<0.05。图5 PNU处理后各组BV2细胞中LC3和Beclin-1蛋白表达Fig.5 The expression of LC3 and Beclin-1 treated by PNU in each group
2.6 Seipin低表达细胞的鉴定
为了探索si-Seipin慢病毒对Seipin表达的影响,BV2细胞经si-Seipin慢病毒处理后,检测到Seipin蛋白表达降低(P<0.05)。见图6。

注:(1)与NC组比较, P<0.05。图6 si-Seipin慢病毒对BV2细胞中Seipin表达的影响Fig.6 The effect of si-Seipin lentivirus on Seipin expression
2.7 低表达Seipin后LC3和Aβ的表达
结果显示,与NC+Aβ组相比较,NC+Aβ+PNU组BV2细胞中Aβ明显降低、LC3-Ⅱ明显升高(P<0.01);与NC+Aβ+PNU组比较,si-Seipin-Aβ+PNU组BV2细胞中Aβ明显升高、LC3-Ⅱ明显降低(P<0.01)。见图7。
3 讨论
痴呆类神经退行性疾病的特征是神经系统的进行性损害,例如导致认知能力下降的脆弱神经元群体的选择性丧失。尽管每年都有报道全世界有数以百万计的人受到影响,但仍然没有药物能够阻止该疾病的过程或减慢疾病的进展。AD患者的神经元死亡与大脑内聚集的错误折叠蛋白Aβ有关[15-17]。机体有两种主要的降解途径——泛素-蛋白酶体系统和自噬-溶酶体途径,可以清除细胞中不需要的或错误折叠的蛋白质,以防止其积累并维持细胞的功能[18-19]。随着年龄的增长,蛋白酶体的降解和自噬功能显著降低,因此,脑内大量的、具有神经毒性的Aβ和tau蛋白聚集体异常蓄积[20]。自噬是AD病理机制中研究的热点内容之一,PNU作为其常用的研究药物,也发现与自噬的调节密切相关,但是其具体的调控机制尚未完全清楚[21]。近年来,Seipin蛋白在神经系统疾病中的研究越来越多,被发现与细胞内一些功能密切相关,参与内质网应激通路的调控[22]。其次,报道也提出Seipin与自噬调控有关,此外,小胶质细胞是神经系统驻留的免疫细胞,具有吞噬、清除脑内异常代谢废物或蓄积物质的功能[23-24]。探讨PNU增强BV2细胞自噬途径介导Aβ寡聚体的清除机制,对AD的有效治疗具有重要意义。

注:(1)与NC+Aβ+PNU组比较,P<0.01;(2)与NC+Aβ组比较,P<0.01。图7 各处理组Aβ和LC3蛋白表达水平Fig.7 The expression of Aβ and LC3 in each group
本研究中,BV2细胞用浓度为10 μmol/L的Aβ寡聚体处理构建AD细胞模型。经Aβ造模后细胞Seipin蛋白水平下降,在病理状态下Seipin蛋白表达降低,提示Aβ抑制了BV细胞Seipin蛋白的表达。PNU处理能够使细胞内Aβ蛋白减少,证明PNU通过降低Aβ发挥一定的神经保护作用。以上结果与之前研究报道一致[9]。为了阐明PNU的作用机制,在单独加PNU处理的情况下,Seipin蛋白增加,自噬蛋白LC3和Beclin-1也增加。与之前PNU处理后能改善AD小鼠的学习记忆功能,Aβ聚集形成的斑块减少,并发现了自噬溶酶体的存在,及Beclin-1表达增加的研究结果具有一致性[25]。本研究发现Seipin蛋白水平在PNU的处理下能够上调,且在Aβ单独处理下Seipin蛋白水平降低,此外,PNU能促进Aβ的降解,据此,推测PNU发挥神经保护作用的机制可能是上调Seipin蛋白,进而增强Seipin蛋白介导的自噬并降解Aβ寡聚体。为了进一步论证以上猜测,本研究进一步对BV2细胞进行慢病毒感染实验敲低Seipin蛋白,再将该细胞与未干扰的细胞均进行Aβ和PNU处理,结果显示Seipin缺少后与正常细胞相比其Aβ升高,LC3-Ⅱ降低,提示PNU的保护效应一定程度上依赖于Seipin的存在。
综上所述,Aβ处理BV2细胞后Seipin降低,PNU能够抑制Aβ的表达,PNU上调Seipin增强自噬降解Aβ是该效应的可能机制。
