低剂量暴露下呋喃唑酮在大菱鲆体内的 迁移规律及预测
2021-11-05邢丽红孙伟红李沂光彭吉星李兆新翟毓秀
邢丽红,孙伟红,*,李沂光,彭吉星,李兆新,翟毓秀,*
(1.农业农村部水产品质量安全检测与评价重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.青岛海洋科学与技术试点国家实验室,山东 青岛 266237;3.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
食品安全问题目前已成为人们关注的一个重要主题。由于抗生素在畜牧业和水产养殖中广泛使用,相当一部分抗生素进入环境中,造成环境抗生素残留以及耐药细菌的传播,最终危害人体健康[1-3]。越来越多的学者开始关注抗生素的环境污染、环境生态毒性及其耐药性[4-6], 并建立了一系列用于监测水体[7-9]、饲料[10-17]和沉积物[18-20]等复杂基质中抗生素残留的高灵敏度检测方法。欧盟为收集和快速发布监测数据,建立了食品和饲料快速预警系统以保障消费者食用安全[21-22]。
呋喃唑酮是人工合成的具有5-硝基结构的广谱抗菌药物,在水产养殖中曾用来预防和治疗革兰氏细菌引起的肠胃道疾病[23],是最常见的一种硝基呋喃类药物。该类药物还具有促生长作用[24],因此曾作为饲料添加剂在畜牧业和水产养殖中广泛使用[1,8,13,24]。硝基呋喃类药物半衰期很短,在动物体内代谢迅速,而与蛋白结合的代谢产物在生物体内则能长期稳定残留[22],并具有显著的致畸、致癌和诱导机体产生突变的作用[17,23]。 出于安全性考虑,欧盟、美国和日韩等发达国家先后颁布了禁止使用该类兽药的规定[1]。我国于2002年明令禁止在食用动物上使用硝基呋喃类药物,并规定在动物源性食品中不得检出。近年来我国加大了食品安全的监控和执法力度,特别是对渔用投入品的生产、销售和使用进行了有效监督和管理,但仍在少量水产品中发现了痕量硝基呋喃类代谢物残留。开展水产品中痕量药物残留的来源、迁移规律和风险预测等方面的研究,可以减少养殖过程的风险隐患,为保障水产品的食用安全提供参考。
动物体内残留的痕量硝基呋喃代谢物,可能源于养殖环境中被污染的饲料或水体。Mccracken等[25]研究发现,在鸡饲料中当呋喃唑酮以30 μg/kg剂量(0.01%治疗剂量)连续投喂12 d时,肝脏和肌肉中的呋喃唑酮代谢物3-氨基-2-噁唑烷基酮(3-amino-2-oxazolidinone,AOZ)残留量分别为(1.1±0.2)μg/kg和(0.33±0.03)μg/kg,说明鸡肉中残留的硝基呋喃类代谢物可能来源于日常饮食或环境污染。Jakiul等[26]为了确定冻虾生产过程中禁用药物硝基呋喃和氯霉素的来源途径,对投入品包括饲料、饲料添加剂、饲料成分、沉积物和水样等进行检测,结果表明使用受到抗生素污染的饲料或饲料原料及养殖水体,会导致抗生素在虾体内残留。同样,Conti等[27]也在饲料和食用该饲料的鱼体内检测到呋喃唑酮和呋喃它酮代谢物残留。Rizala等[28]开展动物饲料中硝基呋喃类、硝基咪唑类和四环素类3 类抗生素残留评估,发现饲料中存在一定程度的抗生素污染。上述研究证明养殖环境中存在硝基呋喃等抗生素的污染来源,并导致鸡、虾、鱼等体内的药物残留,但是还不清楚生物体内抗生素残留量与环境受污染程度的相关关系及可能带来的风险。
大菱鲆(Scophthalmus maximus)是我国北方重要的海水鱼养殖品种,硝基呋喃药残事件曾经对大菱鲆产业造成毁灭性打击。本实验选取大菱鲆作为研究对象,开展饲料中低剂量呋喃唑酮药物在其体内的富集传递规律研究,确定生物富集系数(bioaccumulation factor,BCF)、预测呋喃唑酮污染水平对大菱鲆体内AOZ残留量的影响,研究结果将有助于评价养殖环节中呋喃唑酮的带入风险,同时也为大菱鲆的食用安全和合理执法提供依据。
1 材料与方法
1.1 材料与试剂
大菱鲆、制作饲料用鱼粉等原料购自海阳市黄海水产有限公司。
呋喃唑酮(纯度>98%) 上海阿达玛斯试剂有限公司;AOZ、AOZ-D4标准品 德国Witega公司; 甲醇、乙酸乙酯、二甲亚砜、乙酸铵、2-硝基苯甲醛(均为色谱纯) 德国Merck公司;盐酸、磷酸氢二钾(均为优级纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
LC20液相色谱仪 日本岛津公司;5500液相色谱-质谱联用仪(配有电喷雾离子源) 美国AB SCIEX 公司;分析天平(感量0.01 g) 德国赛多利斯集团;高速离心机(6 000 r/min) 美国Thermo Fisher公司;微量高速离心机(14 000 r/min) 德国Sigma公司;涡旋混合器 美国Talboys公司;Gradient A10 Mill-Q超纯水仪 美国Millipore公司;N-EVAP 112氮气吹干仪 美国Organomation公司;IS-RDS3恒温振荡器 美国精骐有限公司。
1.3 方法
1.3.1 呋喃唑酮饲料制作
将饲料按照大菱鲆配料比例充分混合均匀,在饲料中分别以添加量0.5、1.5 mg/kg和5.0 mg/kg添加呋喃唑酮,充分搅拌混合均匀后,用制料机制成颗粒饲料,-20 ℃冷冻保存。
1.3.2 养殖实验
1.3.2.1 实验动物
实验前随机挑选健康、活泼、平均体质量为(500±50)g的大菱鲆,在2.5 t圆形养殖缸中暂养2 周后用于实验。实验前检测表明,大菱鲆各组织和养殖实验海水及饲料中均无呋喃唑酮及其代谢物残留。驯养期间饲喂不含呋喃唑酮的饲料。海水经砂滤,无污染,实验过程中24 h不间断充气,水温(16±2)℃,pH 8,溶解氧7.5 mg/L,总硬度8 DH。
1.3.2.2 实验给药及采样
实验前将大菱鲆随机分为对照组和实验组,分别编号,称量,记录。对照组投喂不添加呋喃唑酮的饲料。实验组设低、中、高3 个添加水平,呋喃唑酮添加量分别为0.5、1.5 mg/kg和5.0 mg/kg。实验组每日投喂含有呋喃唑酮的饲料,日投喂量为体质量的1%,每日投喂2 次,上午和下午各一次。整个实验过程采用循环海水养殖。分别于投喂饲料后的0、5、10、15、20、25 d和30 d采集大菱鲆样品。每次采样时,随机采集6 尾鱼,用空白海水冲洗干净体表,分别取肌肉、皮、鳃、肝脏、肾脏、脾脏组织,于-20 ℃冷冻保存。
1.3.3 样品处理
按照农业部783号公告-1-2006进行样品前处理并作适当改进。
称取2 g样品于50 mL聚丙烯离心管中,准确加入50 μL内标溶液,涡旋混合50 s,再加入5 mL 0.2 mol/L盐酸溶液和0.15 mL 0.05 mol/L 2-硝基苯甲醛溶液,涡旋混合50 s后,置于恒温振荡器中37 ℃避光振荡16 h。取出离心管冷却至室温,加入1.0 mol/L磷酸氢二钾溶液,调节pH 7.0~7.5,加入乙酸乙酯8 mL,涡旋振荡1 min,8 000 r/min离心5 min,取上层清液转移至10 mL离心管中,于40 ℃氮气吹干。准确加入5%甲醇溶液1.0 mL,充分涡旋振荡溶解残留物,再将溶液转移至1.5 mL离心管中,10 000 r/min离心10 min,取下层清液过0.22 μm滤膜,供液相色谱-串联质谱分析。
1.3.4 样品测定
液相色谱条件:色谱柱:Waters XBridge C18柱(150 mm×2.1 mm,3.5 μm);流速:0.35 mL/min;柱温:35 ℃;进样量:10 µL;流动相:A为0.002 mol/L乙酸铵溶液,B为甲醇;梯度洗脱程序见表1。

表1 流动相梯度洗脱程序Table 1 Mobile phase gradient elution procedure
质谱条件:离子化模式:电喷雾离子源,正离子模式;喷雾电压5 500 V;离子源温度550 ℃;碰撞气Medium;气帘气压力30 psi;雾化器压力35 psi;辅助加热气压力35 psi;去簇电压80 V;射入电压10 V;碰撞室射出电压10 V;扫描模式:多反应选择监测,选择反应监测母离子、子离子和碰撞能量见表2。

表2 选择反应监测母离子、子离子和碰撞能量Table 2 Mother ion, daughter ion and collision energy in selective reaction monitoring mode
1.4 数据处理
若实验结束时鱼体中药物含量变化已基本达到平衡,此时鱼体对药物的BCF按式(1)计算:

式中:Cfs为平衡时鱼体药物含量/(μg/kg);Cws为平衡时饲料中药物含量/(mg/kg)。
若实验结束时,鱼体中药物含量未达到平衡,用BCF30d表示。
采用MetaLab软件进行数据拟合并建模,BCF的计算每个时间点6 个平行样品,以±s表示,相关系数R的显著性差异通过查阅相关系数显著性检验表进行分析。
2 结果与分析
2.1 大菱鲆组织中AOZ残留量与饲料添加量关系
在低剂量暴露条件下(0.05%~0.5%治疗剂量),连续投喂含呋喃唑酮的饲料30 d,在大菱鲆肌肉、皮、肝脏、肾脏、鳃和脾各组织中均能检测到呋喃唑酮代谢物AOZ残留。以呋喃唑酮添加量为自变量x,以AOZ残留量为因变量y进行线性回归分析,结果表明,大菱鲆各组织中AOZ的残留量与呋喃唑酮添加量具有良好的线性关系。查阅相关系数显著性检验表[29]可知,当n=6时,0.811≤R<0.917表示 0.01<P≤0.05,显著相关,R≥0.917时表示P≤0.01,极显著相关。由表3可知,各组织中线性方程相关系数均大于0.917,达到极显著水平,即随着饲料中呋喃唑酮添加量的增大,大菱鲆各组织中AOZ残留量随之增大,呈显著正相关。线性方程斜率越大,表明相应组织中AOZ的残留量越高。我国农业部783号公告-1-2006规定了硝基呋喃类代谢物检出限为0.25 μg/kg,定量限为0.5 μg/kg。当呋喃唑酮添加量为0.5 mg/kg时,连续暴露5 d,可食组织肌肉中AOZ即可检出(0.44 μg/kg), 连续暴露30 d时,肌肉组织中AOZ残留量即达到 0.68 μg/kg,饲料在受到低剂量呋喃唑酮污染或低剂量违禁添加的情况下,呋喃唑酮代谢物AOZ在大菱鲆体内存在蓄积的风险。
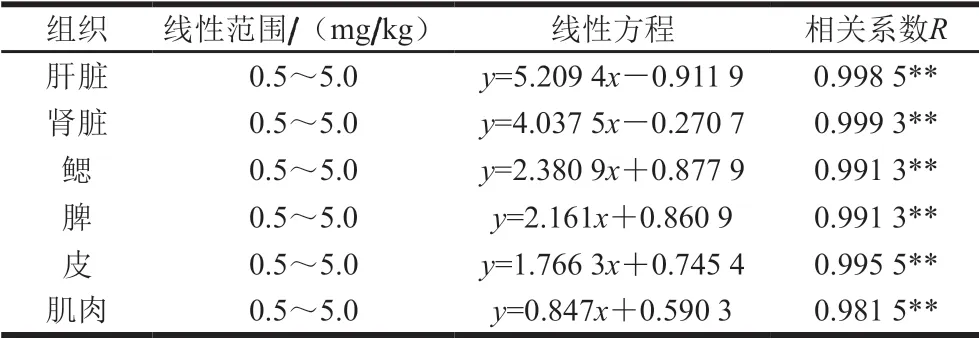
表3 大菱鲆各组织中AOZ残留量与饲料中呋喃唑酮添加量线性方程Table 3 Linear equations between AOZ residue in various tissues of turbot and dose of furazolidone added to feed
Mccracken等[25]为了证明鸡肉中残留的硝基呋喃类代谢物可能来源于日常饮食或环境污染,按照3 000 μg/kg剂量饲喂鸡12 d后,将这些鸡转移,在鸡舍不做清洁的情况下,重新放入体内不含硝基呋喃类代谢物的鸡,并摄食不含硝基呋喃的饲料和水,24 h后在其肌肉和肝脏中分别检测到AOZ残留,残留量分别为(0.13±0.04)μg/kg 和(0.01±0.03)μg/kg。Mccracken等[25]此前研究还发现,将猪置于曾受过药物治疗但未清洁彻底的猪圈中暴露2 h,可明显检测到AOZ残留。Jakiul等[26]对160 份饲料和饲料成分中的硝基呋喃类代谢物进行检测发现,11 份虾饲料和10 份鱼饲料中检出了硝基呋喃类代谢物,虾制品中硝基呋喃类抗生素污染来源于两方面:1)受污染的饲料和饲料成分;2)在混养过程中使用禽类粪便肥水,而这些禽类从开始养殖时便滥用抗生素。Conti等[27]对同一个养殖场的30 份饲料和食用该饲料的鱼体采用酶联免疫吸附剂测定试剂盒对其抗生素含量进行测定,结果在饲料中检出包含硝基呋喃类代谢物AOZ和AMOZ在内的7 类抗生素残留,肌肉中AOZ和AMOZ的平均含量分别为0.09 μg/kg和0.29 μg/kg。在水源和饲料等受低剂量抗生素污染的条件下,硝基呋喃类药物在动物体内存在蓄积的风险。
2.2 AOZ残留量-时间曲线图(Ci-Ti)
在饲料中分别添加0.5、1.5 mg/kg和5.0 mg/kg呋喃唑酮药物,其标示性代谢物AOZ在大菱鲆肌肉、皮、肝脏、脾、肾脏和鳃中的残留量随时间变化的Ci-Ti见图1。
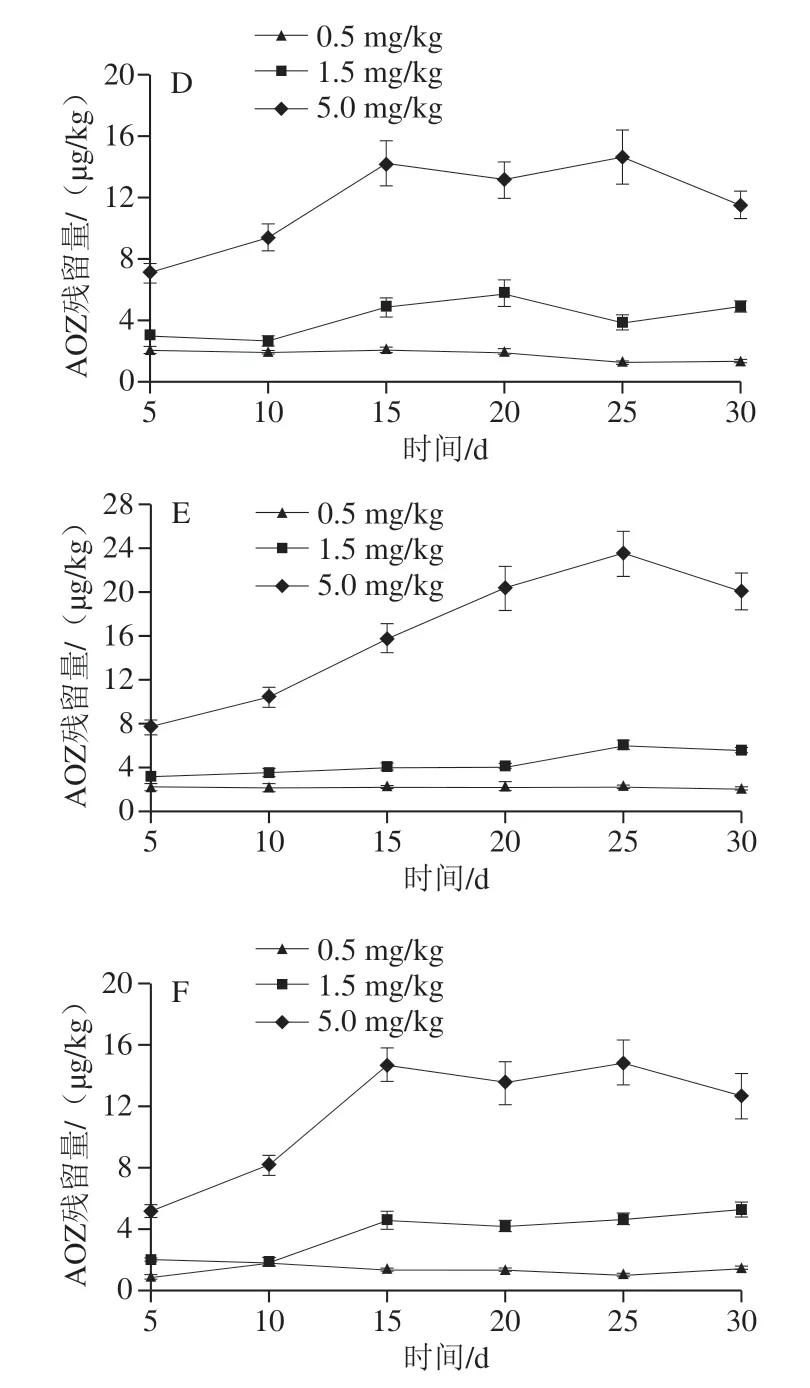
图1 大菱鲆各组织中AOZ残留量随时间变化曲线Fig. 1 Changes in AOZ residue in tissues with feeding time

由图1可以看出,随着呋喃唑酮添加量的升高和暴露时间的延长,AOZ在大菱鲆各组织中的残留量逐渐增加并趋于稳定。当饲料中呋喃唑酮添加量为0.5 mg/kg时,AOZ在肌肉、皮和肝脏中达到稳态富集的时间均为15 d,在脾中5 d达到稳态富集,在肾脏和鳃中10 d达到稳态富集。添加量为1.5 mg/kg时,AOZ在肌肉、皮、肝脏、脾、肾脏和鳃中均15 d达到稳态富集,但在脾中出现一定程度波动变化。添加量为5.0 mg/kg时,AOZ在肌肉、皮、肝脏、肾中25 d达到富集平衡,脾和鳃中15 d达到富集平衡,并在之后出现一定程度的波动上升和下降,30 d时AOZ残留量在各组织中略有下降,可能是由于AOZ在体内达到富集平衡后,消除速率大于代谢速率,因而AOZ残留量出现一定程度下降。
在饲料中添加不同水平的呋喃唑酮药物,AOZ在大菱鲆不同组织中达到稳态富集的时间各不相同,且AOZ在同一组织中的残留量也有差异。对于同一组织而言,在饲料中随着呋喃唑酮添加量的增大,AOZ在各组织中的残留量相应增大,在饲料中达到稳态富集的时间也越长。
2.3 AOZ在大菱鲆各组织中的分布特征
大菱鲆食用含有呋喃唑酮的饲料后,在体内快速代谢,在很短时间内即可转化成代谢产物AOZ,并以蛋白结合态形式稳定存在。AOZ在大菱鲆各组织中的残留量见图2。

图2 不同富集时间下AOZ在大菱鲆各组织中的分布Fig. 2 Distribution of AOZ in various tissues of turbot at different enrichement times
随着饲料中呋喃唑酮添加量的增加,其代谢物AOZ在大菱鲆各组织中的残留量也相应增加,其分布呈相似的规律,AOZ残留量由大到小依次为肝脏>肾脏>脾> 鳃>皮>肌肉,AOZ在肝脏组织中的残留量最高,在肌肉中最低。鱼皮中AOZ的残留量略高于肌肉组织,鳃丝中AOZ残留量约是肌肉的2~3 倍,而肝脏中AOZ残留量是肌肉的4~6 倍,肾脏中AOZ残留量略低于肝脏,脾脏和鳃中AOZ残留量较为接近。肝脏、脾、肾脏和鳃是参与代谢的重要组织器官,因此也是AOZ残留量较高的组织。进入体内的呋喃唑酮药物在生物体内各种酶的作用下,转化为代谢产物,并蓄积在肝脏、肾脏等组织器官中,而后分布到肌肉和皮可食组织中。

2.4 呋喃唑酮在大菱鲆体内生物富集能力
生物富集作用是指污染物从环境中进入生物体内蓄积,进而在食物链中传递与富集的能力。污染物的生物富集作用越强,对生物的污染程度与慢性危害作用越大。通常以BCF度量污染物在生物体内累积的趋势,并作为描述生物对污染物质富集效应的指标。
同一添加水平下,随着富集时间的延长,AOZ在同一组织中的BCF逐渐升高并趋于稳定,药物进入鱼体后,富集过程与代谢过程是并存的,初期富集过程大于代谢过程,在后期富集和代谢过程逐渐达到平衡。但不同组织对AOZ的生物富集能力不同,AOZ在皮组织中的BCF大于在肌肉组织中的BCF,表明AOZ在鱼皮中更容易蓄积,推测可能是鱼皮中蛋白含量高于肌肉组织,而AOZ在体内主要以蛋白结合态形式存在,因而AOZ更容易蓄积在蛋白含量更高的鱼皮组织中。不同添加量下,AOZ在同一组织中的BCF存在差异,大菱鲆体内AOZ的蓄积量随添加量增大而增大,但与饲料中的添加量并不呈等比关系,在低添加水平条件下呋喃唑酮药物在大菱鲆体内的BCF比高添加水平高。AOZ在肌肉和皮中的BCF见图3。

图3 AOZ在大菱鲆肌肉(A)和皮(B)中的BCFFig. 3 Bioconcentration factors of AOZ in the muscle (A) and skin (B) of turbot
李永仁等[30]在研究毛蚶对石油烃的BCF时,发现随水体石油类含量升高,毛蚶对石油烃的BCF减小,且水体石油类含量越高,BCF的减小越缓慢。王晓玲等[31]在研究紫贻贝对重金属镉的生物富集特征时,同样也发现BCF随暴露剂量增加而逐渐减小,均与本实验结果呈相似的规律。随着暴露时间的延长和暴露剂量的升高,大菱鲆蓄积能力受到一定影响,其各组织对呋喃唑酮不能一直维持高蓄积速度,而是具有一定的蓄积平衡点和极限性。BCF随暴露剂量的升高而下降,这可能与大菱鲆自身的代谢机能存在一定关系,即高剂量呋喃唑酮暴露条件下说明大菱鲆要把蓄积到体内的呋喃唑酮排出体外需要更长的时间,而机体为了避免一定程度的损伤,首先要通过自身调控降低体内对呋喃唑酮的蓄积速度。已有研究表明,水生动物在一定程度有机物影响下,可以明显提高自身抗氧化酶等指标的活性降低污染物及其代谢物对其造成的损伤[32]。
越来越多的研究表明,畜牧业和水产养殖业中使用硝基呋喃类药物等抗生素后,会进入土壤、沉积物、地表水等环境中,进而通过水源和饲料对养殖水产品的质量安全产生影响,并进一步对人类的食用安全和健康造成潜在威胁[3,6,26]。Radovnikovic等[22]对爱尔兰成年人、青少年和儿童3 个不同组开展硝基呋喃类代谢物食用安全暴露风险评估,并在其食用的动物源性食品中检出了硝基呋喃类代谢物残留。因此,开展养殖环境和投入品中抗生素污染的风险预警,建立评估模型,用于指导养殖生产实践,对于保障水产品质量安全具有非常重要的意义。
2.5 数据模型分析
采用MetLab软件对呋喃唑酮药物不同添加量、不同富集时间下,AOZ在大菱鲆肌肉组织中的残留量分别进行线性拟合和二次非线性拟合,其中,线性拟合结果见图4,表达式见式(2):

图4 肌肉组织线性拟合结果Fig. 4 Linear fitting result of AOZ residue in muscle

式中:c为肌肉组织中AOZ残留量/(μg/kg);x为饲料中药物添加量/(mg/kg);y为富集时间/d。

二次非线性拟合结果见图5,表达式见式(3):

图5 肌肉组织二次非线性拟合结果Fig. 5 Quadratic nonlinear fitting result of AOZ residue in muscle

式中:c为肌肉组织中AOZ残留量/(μg/kg);x为饲料中药物添加量/(mg/kg);y为富集时间/d。

和方差(sum of squares due to error,SSE)和确定系数R2是评价模型的两个重要指标。其中,SSE是指拟合数据和原始数据对应点误差的平方和,SSE越接近于0,说明模型选择和拟合越好,数据预测越成功。R2是通过数据的变化表征拟合情况,其正常取值范围为0~1,越接近1,表明这个模型对数据拟合越好。
通过比较线性拟合结果和二次非线性拟合结果可知,SSE2<SSE1,因此,采用二次非线性拟合结果建立模型,对数据的拟合度更好,本实验选择二次非线性拟合方式。
欧盟委员会法规Council Regulation No. 2377/90将呋喃唑酮列为A类禁药,规定在食品中不得检出呋喃唑酮,并规定了基准实验室的检出限不大于1.0 μg/kg。日本2006年实施的食品中农业化学品残留“肯定列表制度”,规定硝基呋喃类代谢物的限量要求为1.0 μg/kg。 我国水产品质量安全例行监测(风险监测)(农质发[2021]1号)和产地水产品兽药残留监控计划(农渔发[2021]8号)中硝基呋喃类代谢物的判定限量值为1.0 μg/kg。
当AOZ在肌肉组织中的残留量不小于1.0 μg/kg时,假设富集30 d,采用二次非线性拟合模型计算可知,饲料中的添加量为0.68 mg/kg。即当饲料中呋喃唑酮的添加量不小于0.68 mg/kg时,连续投喂30 d,大菱鲆肌肉组织中AOZ残留量不小于1.0 μg/kg。
采用MetLab软件对呋喃唑酮药物不同添加量、不同富集时间下,AOZ在大菱鲆皮组织中的残留量进行二次非线性拟合(图6),表达式见式(4):

图6 鱼皮组织二次非线性拟合结果Fig. 6 Quadratic nonlinear fitting results of AOZ residue in skin

式中:c为鱼皮组织中AOZ残留量/(μg/kg);x为饲料中药物添加量/(μg/kg);y为富集时间/d。

当AOZ在鱼皮组织中的残留量不小于1.0 μg/kg时,假设富集30 d,采用二次非线性拟合模型计算可知,饲料中的添加量为0.46 mg/kg。即当饲料中呋喃唑酮添加量不小于0.46 mg/kg时,连续投喂30 d,在大菱鲆鱼皮组织中AOZ残留量不小于1.0 μg/kg。
通过模型预测并科学有效地对投入品进行监控,可以减少养殖过程的带入风险,有效保障水产品的食用安全。
3 结 论
本实验选取大菱鲆作为研究对象,在饲料中以远低于治疗剂量(1 g/kg)的水平添加呋喃唑酮,测定大菱鲆体内呋喃唑酮代谢物AOZ残留量,确定饲料添加量与AOZ残留量关系、稳态富集时间、组织分布特征和BCF,并构建判别模型预测饲料中呋喃唑酮的含量。实验结果表明,饲料中低剂量呋喃唑酮药物污染,会导致大菱鲆体内AOZ残留。饲料或饲料原料(如鱼粉)及养殖投入品引入的硝基呋喃类药物污染,可能会造成鱼体内低含量硝基呋喃类代谢物残留。此外,硝基呋喃类药物还具有一定的促生长作用,具有在饲料中长期低添加量添加的潜在风险。目前我国颁布了农业部1486号公告-8-2010和农业部2349号公告-6-2015两项标准用于测定饲料中硝基呋喃类药物残留量,其中1486号公告-8-2010采用高效液相色谱法,其方法检出限为 0.3 mg/kg,定量限为1.0 mg/kg,对于饲料中硝基呋喃类药物低于1.0 mg/kg时,无法准确定量。农业部2349号公告-6-2015采用液相色谱-串联质谱法,其检出限 为0.05 mg/kg,定量限为0.1 mg/kg,相对于高效液相色谱法,采用液相色谱-串联质谱法具有更高的灵敏度,可以更准确监测饲料污染或是饲料中的非法添加。
