海洋红冬孢酵母分泌蛋白的鉴定及其在番茄 采后生物防治中的应用
2021-11-05孙丹丹张晓君路来风乔丽萍王昌禄
孙丹丹,张晓君,路来风,杨 莹,乔丽萍,王昌禄
(食品营养与安全教育部重点实验室,天津科技大学食品科学与工程学院,天津 300457)
生物防治指利用生物物种间的相互关系,以一种或一类生物抑制另一种或另一类生物的方法。利用安全且具有拮抗活性的微生物进行果蔬病害生物控制的方法,被认为采后领域最有希望替代化学杀菌剂的方法之一[1]。研究已经分离和筛选出了上千种拮抗微生物菌株,这些菌株包括了具有拮抗作用的细菌、小型丝状真菌和酵母菌等[2-3],可以有效控制果蔬采后主要病害[4-5]。
利用拮抗微生物防治果蔬采后病害的效果取决于生防制剂的筛选、开发和应用过程[6]。环境中包含众多潜在的生防因子,而一般有效的生防因子制剂需要能够与果蔬建立密切的关系,进而有效抑制病原菌的扩展;通过抑制病原菌发育,使病原菌易于被优势微生物区系攻击或杀死;同时,能够在适当的位点定植并达到足以有效防治的密度,从而发挥对病原菌的控制作用和保护果蔬免受采后病害侵染[1,7]。微生物能在伤口处迅速定植,并且不会引发宿主剧烈的免疫反应是它能作为生防制剂的前提,而目前缺乏关于拮抗微生物与果蔬建立密切关联机制的系统性研究。
海洋红冬孢酵母(Rhodosporidium paludigenumFell & Tallman)作为海洋中存在的一中抗逆性很强的天然真菌,对多种果蔬的多种采后病害具有良好抑制效果,明显抑制链格孢、灰葡萄孢(Botrytis cinerea)、扩展青霉、指状青霉、多毛孢等多种病原微生物在冬枣、番茄、苹果、柑橘、葡萄等果实上引起的病变和腐败[8-9]。前期实验结果发现,营养与空间的竞争和诱导果实抗病等是R. paludigenum生物防治采后病害的主要作用机制[10-11]。R. paludigenum能通过在果实伤口处的快速生长,迅速占据水果伤口表面的空间,并调控果实局部和系统性免疫反应,从而发挥限制致病菌对果实组织营养的目的。
果蔬采后病原菌等死体营养型致病菌在与寄主之间建立寄主关系时会分泌大量的降解酶类,帮助病原菌侵入和定植于果蔬组织,同时降解酶可以分解这些果蔬组织的高分子质量组分,产生病原菌能够代谢的营养[12]。本研究拟参考果蔬采后病原菌与寄主之间建立寄主关系的方式,选取具有优良采后生物防治效果的R. paludigenum为研究对象,通过解析其分泌蛋白信息,探究拮抗微生物与番茄之间建立宿主关系的方式及其中的相关机制,旨在为强化拮抗微生物防治制剂奠定基础。
1 材料与方法
1.1 材料与试剂
实验所用果实均为新鲜(收获时间,1~2 d)的红熟期番茄(Solanum lycopersicum),采摘于天津市东丽经济开发区温室试验果园。选取外观无机械伤口、大小均匀一致的果实进行实验,用0.1%次氯酸钠溶液浸泡消毒1~2 min,用自来水冲洗并在室温下放干后备用。
R. paludigenumFell & Tallman(IMI 394084)分离自中国东海近海海域,并经英国国际微生物所菌种保存和鉴定中心鉴定。将适量活化后的菌种挑入到100 mL番茄液体培养基(番茄果肉25 g,加水定容至100 mL,121 ℃灭菌20 min)中,于200 r/min、28 ℃摇床培养36 h。
病原菌为B. cinerea,分离自腐烂番茄果实表面。挑取适量的霉菌孢子,在马铃薯葡萄糖固体培养基斜面上划线,置于培养箱中,在28 ℃培养7 d后,用接种环在培养好的霉菌试管斜面上刮取适量孢子,转移到适量0.05%吐温-20溶液中,用血球计数板计数调整至1×104spores/mL 待用。
异硫氰酸胍、糜蛋白酶、几丁质、昆布多糖、苹果果胶、Chitin Azure 美国Sigma-Aldrich公司;胰蛋白酶 美国Promega公司;尿素、三羟甲基氨基甲烷、二硫苏 糖醇 美国Bio-Rad公司;胰蛋白酶蛋白酶、天冬氨酸激酶(均为质谱级) 日本和光纯药工业株式会社。
1.2 仪器与设备
Q Exactive UHMR(超高质量数范围)组合型四极杆Orbitrap质谱仪、Easy-nLC 1 000 nL级液相色谱仪 美国 赛默飞世尔科技公司;BX-60荧光显微镜 日本奥林巴斯公司;LS-B50L型立式压力蒸汽灭菌锅 上海华线医用核子仪器有限公司;HYG-IIa型迴转式恒温调速摇床 上海欣蕊自动化设备有限公司;Allegra X-30型台式高速离心机 美国Beckman公司。
1.3 方法
1.3.1R. paludigenum分泌蛋白质谱鉴定与生物信息学分析
R. paludigenum分泌蛋白质谱鉴定实验委托上海中科新生命生物科技有限公司开展,具体实验流程如下:R. paludigenum分泌蛋白经过还原和烷基化处理后,加入胰蛋白酶(质量比1∶50),在37 ℃条件下酶解20 h。蛋白质分装,保存于-80 ℃冰箱。各取样品20 μg(可根据实际情况调整上样量)进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,考马斯亮蓝染色(或者银染),判断样品裂解情况。酶解产物脱盐后冻干,复溶于0.1%三氟乙酸溶液中,-20 ℃保存待用。质谱分析A液为0.1%甲酸溶液,B液为0.1%甲酸-84%乙腈溶液。色谱柱以95% A液平衡后,样品由自动进样器上样至Trap柱。对于复合的样品采用1H梯度。质谱数据采集:每次全扫描后采集20 个碎片图谱(MS2Scan)。采用Bradford方法进行蛋白质定量。
R. paludigenum分泌蛋白质生物信息学分析按照聂燕芳等[13]方法,用Signal P(http://www.cbs.dtu.dk/services/SignalP-4.1/)[14]、WoLF PSORT(https://www.genscript.com/wolf-psort.html)[15]、Target P(http://www.cbs.dtu.dk/services/TargetP-1.1/index.php)[16]、TMHMM(http://www.cbs. dtu.dk/services/TMHMM/)[17]和big-PI Predictor(http://gpcr2.biocomp.unibo.it/predgpi/pred.htm)[18]软件对质谱鉴定得到的拮抗酵母胞外蛋白氨基酸序列进行经典分泌蛋白的预测分析,利用Secretome P(http://www.cbs.dtu.dk/services/SecretomeP/)软件对拮抗酵母非经典分泌蛋白进行分析,将氨基酸序列 NN-score>0.6(人工神经网络算法)的蛋白质定义为非经典分泌蛋白[19]。
1.3.2R. paludigenum分泌蛋白抑菌实验
在马铃薯葡萄糖液体培养基中加入适当浓度B. cinerea孢子悬浮液、R. paludigenum发酵上清液盐析蛋白混合物和番茄空白培养基上清液盐析蛋白混合物,在25 ℃黑暗条件下培养18 h,观察B. cinerea芽管长度和萌发率,以评估R. paludigenum分泌蛋白对B. cinerea发育的影响。
1.3.3 番茄果实采后病理学实验
将R. paludigenum发酵液于9 000×g、4 ℃条件下离心20 min,获得发酵上清液与菌体沉淀物,将收集到的菌体沉淀物用无菌水清洗2 次以充分除去培养基,重新悬浮在pH 6.5磷酸缓冲液中,冰浴超声5 min后,于25 000×g、4 ℃条件下离心20 min,即获得酵母胞内上清液。利用不同饱和度(NH4)2SO4溶液同时对酵母发酵上清液和胞内上清液进行盐析,低温(4 ℃)静置过夜后于8 000×g离心30 min,即分别获得R. paludigenum酵母分泌蛋白和胞内蛋白混合物。
用消过毒的打孔器在每个果实的顶部形成统一大小(5 mm)和尽可能相同的深度(2 mm)的伤口2 个。每个果实第1伤口中加入等量(50 µL)的R. paludigenum酵母分泌蛋白或胞内蛋白,果实第2伤口中加入等量的番茄液体培养基上清液盐析蛋白混合物或无菌水作为对照。在25 ℃恒温恒湿条件下诱导48 h后,在果实表面邻近原伤口5 mm处形成一个新的伤口,接入30 µLB. cinerea病原菌悬液(1×104spores/mL)。在恒温(25 ℃)恒湿条件下贮藏,每天定时记录病害发生情况和病斑直径。
1.3.4 拮抗酵母分泌蛋白中寡聚半乳糖醛酸酶、葡聚糖酶和几丁质酶活性测定
按照卢黄娉[20]方法用二硝基水杨酸法测定拮抗酵母分泌蛋白中葡聚糖酶活性,葡聚糖酶活性以每毫升蛋白溶液每小时产生的葡萄糖质量表示;按照De Los Santos-Romero等[21]方法,用可见分光光度法测定拮抗酵母分泌蛋白中几丁质酶活性,几丁质酶活性以每毫升蛋白溶液每小时OD570nm增加0.01为1 个单位(U);按照Lu Laifeng等[22]方法,用二硝基水杨酸法测定拮抗酵母分泌蛋白中果胶酶活性,果胶酶活性以每毫升蛋白溶液每小时产生的D-半乳糖醛酸的质量表示。利用考马斯亮蓝法(Bradford法)测得蛋白质含量。
1.4 数据处理与分析
采用SPSS/PC ver. II. x软件(Statistical Product and Service Solutions)进行统计分析。当组内比较个数为3 个及3 个以上时,数据采用ANOVA进行Duncan差异分析(P<0.05,差异显著);当组内个数为2 个时,采用独立样品t检验进行平均数分离。每个单独实验中每个处理至少设3 个以上重复,并按照完全随机区组原则进行设计。采用Origin 7.5软件进行作图。
2 结果与分析
2.1 R. paludigenum经典与非经典分泌蛋白鉴定与预测分析
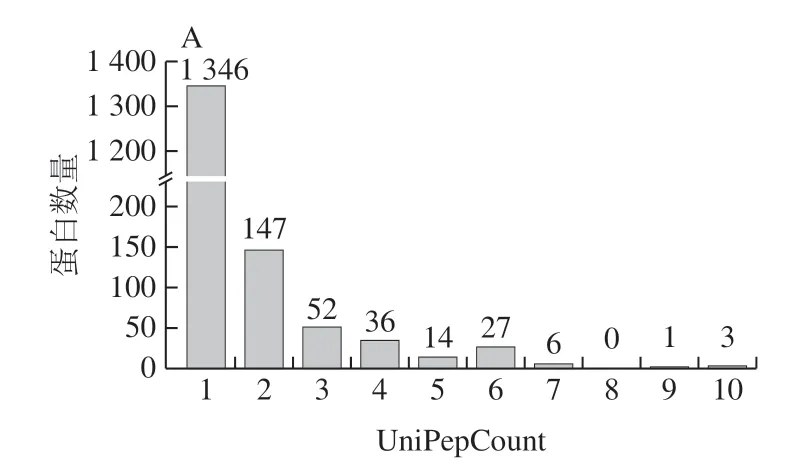
利用QE质谱仪对酵母胞外蛋白混合物进行鉴定 (图1)。选取Uniprot_Rhodotorula_40850_20171211.fasta为对照数据库,脲甲基化为固定修饰,氧化和磷酸化为可变修饰,使用MASCOT等质谱匹配软件对液相色谱-串联质谱结果进行分析,共计获得1 632 条目标蛋白质多肽序列。其中,UniPepCount为1和2的蛋白分别共计1 346 个和147 个,合计占比91.48%(图1A)。80%左右的氨基酸数目占对应目标蛋白质全长比例在5%以内,另有20%左右的蛋白覆盖程度高于5%,即在此样品中该蛋白的峰度可能相对高些,但是没有绝对量化的标准(图1B)。

图1 R. paludigenum发酵上清液蛋白Unique肽段数量分布(A)和 肽段序列覆盖度(B)图Fig. 1 Distribution of the number of unique protein sequences (A) and coverage of peptide sequences (B) in the fermentation supernatant of R. paludigenum
利用UniParc数据库(https://www.uniprot.org/)获取蛋白质一级氨基酸全长序列。参照经典分泌蛋白的4 个特征[13]:1)具有N-端信号肽;2)亚细胞定位为胞外分泌类型,不含有细胞质膜、细胞质及其他亚细胞预测定位信号;3)无跨膜结构域;4)无糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定位点对R. paludigenum发酵上清液中的蛋白混合物进行筛选,除去冗余或者番茄属(Lycopersicon)等其他来源蛋白质。
首先,利用Signal P软件对经质谱鉴定得到的1 632 条蛋白质氨基酸序列进行信号肽预测分析,结果表明有114 个氨基酸序列具有分泌型信号肽,占总数的6.99%。其次,使用WoLF PSORTRU软件对具有信号肽的114 个分泌性蛋白质进行亚细胞定位预测分析,结果表明104 个蛋白质分泌到胞外,属于胞外蛋白类型。利用Target P进一步对 WoLF PSORT预测的104 个分泌蛋白质进行验证分析,得到100 个含有分泌型信号肽的蛋白质,所占比例为 96.2%。结合TMHMM Server对以上100 个含有分泌型信号肽的蛋白质进行跨膜区判断,结果表明有81 个蛋白质没有跨膜螺旋,具有典型分泌蛋白的特征。最后,利用big-PI Predictor软件对上述81 个没有跨膜螺旋的蛋白质进行分析。结果表明58 个蛋白质氨基酸序列不具有GPI锚定位点,具有经典分泌蛋白的特征,另有23 个蛋白质具有GPI 锚定位点,不符合经典分泌蛋白的特征。综合上述不同生物信息学软件的分析结果,发现经质谱鉴定得到的R. paludigenum发酵上清液中有58 个具有经典分泌特征的蛋白质,占比3.56%(表1)。

表1 R. paludigenum经典分泌蛋白序列信息Table 1 Sequence information of classical secretory proteins in R. paludigenum
结合UniParc数据库58 个具有经典分泌特征的R. paludigenum分泌蛋白的人工注释信息,发现40 个已知功能蛋白,18 个未知功能蛋白。碳水化合物酶(carbohydrate-active enzymes,CAZymes)类蛋白是指参与碳水化合物合成和降解的重要酶类,其作为分泌蛋白中的一大类,是植物病原菌侵染过程中突破寄主植物细胞壁的关键因素,主要包括糖基水解酶、糖基转移酶、多糖裂解酶、碳水化合物酯酶、碳水化合物结合模块及辅助模块酶类6 类。本研究结果发现,R. paludigenum分泌蛋白中含有藻胶裂解酶和β-葡萄糖苷酶等18 个CAZymes类蛋白,占比31.0%,其中包括糖基水解酶14 个、多糖裂解酶3 个、碳水化合物酯酶1 个(表2)。

表2 R. paludigenum经典分泌蛋白的功能注释分析Table 2 Functional annotation analysis of classical secretory proteins in R. paludigenum
此外,利用 Secretome P 2.0 Server软件,对R. paludigenum发酵上清液中不具有信号肽的1 518 条氨基酸序列进行了分析。结果表明,有433 个蛋白质氨基酸序列符合非典型分泌蛋白的特征,占目标蛋白质多肽序列总数的26.6%。其中,包括糖苷水解酶26家族蛋白、甲壳素脱乙酰酶和蛋白磷酸聚糖5等蛋白。
2.2 R. paludigenum分泌蛋白对B. cinerea发育的影响
为了研究分泌蛋白在R. paludigenum与B. cinerea互作过程中的功能,本研究将R. paludigenum分泌蛋白混合物与B. cinerea孢子进行共同培养(图2)。结果表明,相对于番茄液体培养基上清液盐析所得的蛋白混合物而言,R. paludigenum分泌蛋白可以有效抑制B. cinerea孢子的发育过程。添加0.1%(体积分数)R. paludigenum分泌蛋白处理组,B. cinerea孢子萌发率为(21.1±2.81)%,较对空白照组降低了31.4%。
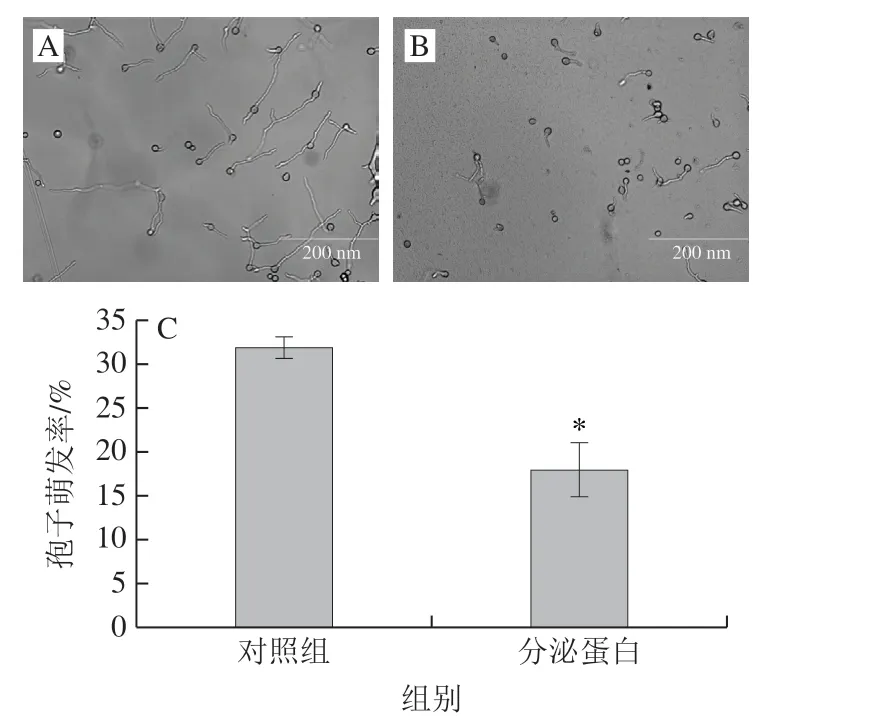
图2 R. paludigenum分泌蛋白对B. cinerea萌发的抑制情况Fig. 2 Inhibition of spore germination of B. cinerea by secretory proteins of antagonistic yeast R. paludigenum
2.3 分泌蛋白在R. paludigenum与番茄建立关联中的作用
微生物区系与宿主之间存在互利共生关系,因此宿主组织往往是潜在生防因子的有效来源。宿主免疫系统可以不间断监测其微生物区系,通过调整抗性反应机制与微生物之间达到微妙平衡。研究结果发现,R. paludigenum分泌蛋白参与介导了微生物区系与宿主之间的动态识别过程,即番茄果实可以有效识别R. paludigenum的分泌蛋白,并作出温和与适当的免疫响应(图3)。R. paludigenum的分泌蛋白处理可以有效降低番茄果实伤口周围组织处灰霉病的发生几率,其病斑直径和发病率分别为4.22 mm和19.4%,较无菌水对照组显著降低了70.5%和30.6%,而较番茄液体培养基上清液(未发酵)盐析蛋白处理组而言分别显著降低了86.7%和72.3%。

图3 R. paludigenum分泌与胞内蛋白对番茄抗病性的影响Fig. 3 Effect of intracellular and extracellular proteins of R. paludigenum on disease resistance of tomato fruits
2.4 不同饱和度(NH4)2SO4盐析对R. paludigenum分泌蛋白诱导番茄抗病性的影响
向R. paludigenum发酵上清液中加入不同质量(NH4)2SO4,使之达到不同的饱和度,沉淀之后分别测定酵母分泌蛋白混合物诱导番茄果实抗灰霉病的能力,结果如图4所示。当(NH4)2SO4饱和度在0%~80%范围内时,R. paludigenum分泌蛋白混合物中能诱导番茄果实抗病的活性蛋白分子较少,其处理组后的果实灰霉病发病率与对照组几乎无显著差别。当(NH4)2SO4饱和度达到90%时,R. paludigenum分泌蛋白混合物中能诱导番茄果实抗病能力显著增加,经90%饱和度盐析所得R. paludigenum分泌蛋白混合物处理后,番茄果实伤口周围组织灰霉病发病率和发病程度受到显著抑制,果实组织发病率仅为49.9%,较对照组降低了50.1%。
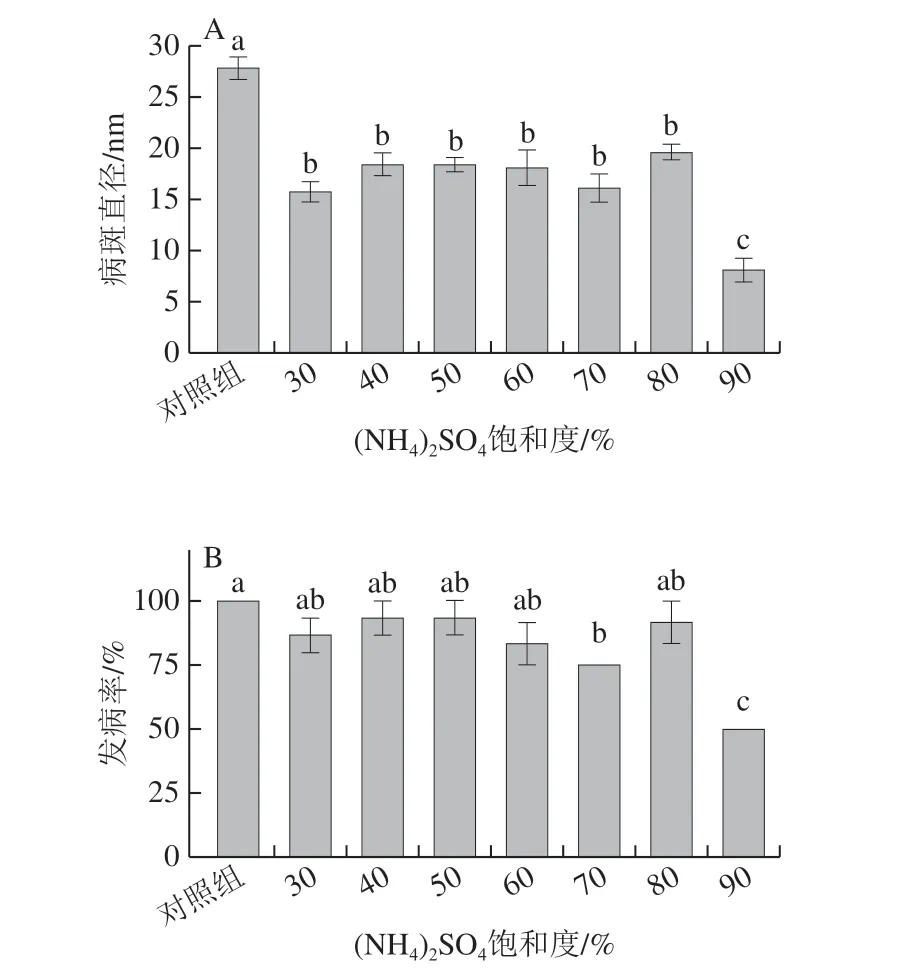
图4 不同饱和度盐析R. paludigenum分泌蛋白对 番茄灰霉病的抑制效果Fig. 4 Inhibitory effect on gray mold of gradient salting-out fractions of secretory proteins of antagonistic yeast R. paludigenum
2.5 R. paludigenum分泌蛋白中3 种CAZymes活性分析
对比分析R. paludigenum与B. cinerea分泌蛋白中葡聚糖酶、几丁质酶和寡聚半乳糖醛酸酶3 种关键的CAZymes活性,结果发现相同体积中B. cinerea葡聚糖酶和寡聚半乳糖醛酸酶活性显著高于拮抗酵母,特别是寡聚半乳糖醛酸酶活性(表3)。B. cinerea分泌蛋白中的寡聚半乳糖醛酸酶活性为1.121 μg/mL,而R. paludigenum分泌蛋白中的寡聚半乳糖醛酸酶活性仅为0.014 μg/mL。因此,R. paludigenum在果实表面和伤口处的定植不会对果实组织细胞壁造成太大的损伤。而R. paludigenum分泌蛋白中的几丁质酶活性为3.867 U,较B. cinerea组高出 14.85 倍,而这可能是R. paludigenum分泌蛋白能够直接抑制B. cinerea发育的原因。

表3 R. paludigenum与B. cinerea分泌蛋白中3 种CAZymes活性比较Table 3 Activities of three CAZymes in R. paludigenum and B. cinereasecretory proteins
3 讨 论
健康的果蔬等植物组织中生活着多种多样但分类学结构不同且具有宿主特异性的微生物群落,它们可以在果蔬等植物组织表面或者组织内部定植[23-25]。微生物之间、微生物与宿主之间的相互合作赋予果蔬宿主的健康优势,包括促进果实品质、成熟衰老、抗逆性和对病原菌的抵抗力等[23]。本研究所用到的R. paludigenum是一种能够防治多种果蔬采后病害的拮抗微生物[8,20]。前期研究表明,R. paludigenum在接种到樱桃番茄伤口后迅速繁殖,24~48 h后樱桃番茄果实伤口处的酵母数量是接种时的50~100 倍;R. paludigenum接种到冬枣伤口后迅速繁殖,24~48 h后冬枣果实伤口处的酵母数量是接种时的50~150 倍,以上两种情况都很好地抑制了采后病原菌链格孢菌的侵染,且不会引起伤口的过敏反应[8]。此外,R. paludigenum还可以定植于柑橘、苹果、梨和番茄等果实表面或者伤口处,并有效防治柑橘果实采后绿霉、酸腐病害,苹果、梨采后青霉病害和樱桃番茄采后黑斑病害等发生[20,26],可以初步证实R. paludigenum能够通过定植过程与果蔬建立互惠互利式的宿主关系。
单独施用拮抗酵母R. paludigenum分泌蛋白可以有效增强伤口周围组织抵抗B. cinerea侵染的能力,同时未引发细胞程序性死亡等宿主剧烈的免疫反应,证明分泌蛋白参与了拮抗酵母R. paludigenum与宿主番茄果实建立密切关联关系的过程。其中,CAZymes类蛋白,例如寡聚半乳糖醛酸酶等糖基水解酶、多糖裂解酶,可能参与了R. paludigenum在果实表面的定植与识别过程,介导其与番茄果实之间建立宿主关系。为使根瘤菌感染豆科植物根,植物需要通过外源寡聚半乳糖醛酸激活结瘤信号通路和NIN转录因子激活果胶裂解酶(LjNPL)对自身的细胞壁进行局部降解,以形成植物侵染点,以便在微生物与植物之间建立关系[27]。同理,糖基水解酶、多糖裂解酶等蛋白可以有助于拮抗酵母局部解聚果胶等果实细胞壁多糖组分,为拮抗酵母在果实表面或者伤口处定植提供定植位点和营养来源。同时,寡聚半乳糖醛酸等微生物定植过程中产生的植物细胞壁多糖酶解组分,可以作为植物损伤相关分子模体被果蔬等宿主识别,激活植保素累积、抗性蛋白响应以及活性氧爆发等防御过程[28]。另外,拟南芥表面受体蛋白AtRLP42也可以直接识别多种真菌果胶酶进而激活植物体对腐生型病原菌Hyaloperonospora arabidopsidis的抗性[29]。值得注意的是,不同微生物分泌蛋白中果胶水解酶与裂解酶的组成与比例会影响所产生寡糖的聚合度和占比等,而因寡糖聚合度不同其诱发的宿主抗性响应也有不同[30]。探究不同微生物糖基水解酶、裂解酶等蛋白酶产生顺序、组成及其酶解产物的种类与功能研究有助于揭示果蔬等宿主识别拮抗微生物和病原微生物的具体机制。
除参与微生物与宿主之间的互作过程外,R. paludigenum分泌蛋白还介导了其与病原菌之间的互作关系。酵母细胞壁主要由葡聚糖、甘露聚糖、蛋白质、几丁质、脂类和无机物(磷酸盐等)构成。其中,几丁质仅出现于出芽痕中,出芽结束后被葡聚糖和甘露糖所覆盖。红酵母属、隐球酵母属、拿逊酵母属等丝状酵母出芽痕较多,细胞壁中几丁质含量相应较高,但远低于采后病原真菌等丝状真菌。采后病原真菌等霉菌细胞壁一般为几丁质组成,有的含有纤维素[31]。由此推论,环境中的高浓度几丁质水解酶会优先限制丝状真菌的细胞壁合成过程,进而抑制其生长繁殖。R. paludigenum分泌蛋白中含有较高浓度的几丁质酶等糖基水解酶,推测参与了抑制B. cinerea孢子的萌发过程,帮助拮抗酵母竞争营养和宿主潜在定植位点,抑制病原菌对寄主的侵入方式等。前期研究发现,在培养基中添加几丁质可以增加R. paludigenum分泌包括几丁质酶和β-1,3-葡聚糖酶在内的胞外水解酶,并显著提高了其对多种果实的采后病原真菌的防治效力[32],侧面印证了以上推论,在培养基中添加几丁质、葡聚糖和果胶等大分子糖类推测适用于多种生防制剂的病害防治功能强化。
4 结 论
本研究发现R. paludigenum通过分泌CAZymes等蛋白质与番茄果实开展互利合作,控制病原微生物在果实伤口等位置的发育,有效保持了采后果蔬的健康状态。其中,R. paludigenum需要通过分泌低浓度的寡聚半乳糖醛酸酶等糖基水解酶、多糖裂解酶等蛋白,在不损伤果实组织的情况下与番茄果实建立宿主关系;同时,通过分泌高浓度的几丁质酶等糖基水解酶,抑制B. cinerea生长与发育。不过,由几丁质水解酶酶解病原真菌细胞壁所产生的寡糖分子进一步引发的宿主免疫响应可能会同时对拮抗微生物和病原微生物的生存造成威胁。随着高通量测序技术的指数式发展,植物(果蔬)微生物组学成为学科热点和交叉前沿。有益微生物及其组合促进植物在各种环境下保持健康状态,深入了解其功能和作用机制,将在采后贮藏保鲜中有着巨大的应用潜力。
