桃主要过敏原蛋白Pru p 3的分离纯化及质谱鉴定
2021-11-05康文瀚张九凯邢冉冉孙秀兰
康文瀚,张九凯,邢冉冉,孙秀兰,陈 颖,
(1.中国检验检疫科学研究院,北京 100176;2.江南大学食品学院,江苏 无锡 214122)
近年来,食物引起的过敏现象受到越来越多的重视。迄今为止全球约有22%~25%的人对食物产生过敏反应,其中儿童发病数量最多,并以每10年2~3 倍的速率不断增加,一些原来不是过敏体质的人也逐渐演变成过敏性体质[1]。
桃(Prunus persica L. Batsch)是我国食物过敏中较常见的致敏食物之一。有研究表明,由进食蔬菜、水果导致的严重变态反应中桃是最常见的致敏食物[2]。桃过敏原蛋白主要分为4 类蛋白家族:病程相关蛋白第10家族(Pru p 1)、类甜蛋白家族(Pru p 2)、非特异性脂质转移蛋白家族(Pru p 3)和抑制蛋白家族(Pru p 4)[3]。
国内外已经围绕桃过敏原进行了不同程度的研究。在地中海地区,由桃引起的过敏现象在水果过敏中的比例最高。在中国,桃过敏在全部食物过敏中位居第二(依次是豆科植物、桃、葵花籽和花生等)[3-4]。桃过敏现象的发生存在明显的地域分布差异,不同国家和地区引起桃过敏的主要过敏原蛋白不同,同时由过敏原蛋白激发的过敏症状也存在差异。比如,在欧洲中部地区,桃过敏主要是由过敏原蛋白Pru p 1和Pru p 2引起,其过敏症状比较轻微,一般仅表现为口腔过敏综合症;而在欧洲南部地中海地区,引起桃过敏的主要过敏原蛋白是 Pru p 3[4],该过敏原蛋白能抵抗胃蛋白酶的消化,产生全身系统性过敏或接触性荨麻疹等严重症状。在中国桃过敏的发生往往伴随着蒿属花粉过敏,其主要过敏原蛋白同样是Pru p 3[5]。
Pru p 3作为桃过敏原蛋白中的主要致敏蛋白,需要进行更深入的研究。而纯化制备大量Pru p 3过敏原蛋白是深入研究的基础,目前报道的蛋白纯化方法主要包括盐析法、等电点沉淀法、有机溶剂沉淀法、离子交换层析法等[6]。其中盐析法、等电点沉淀法及有机溶剂沉淀法虽然操作简单,节约成本,但是蛋白纯化浓度较低,不能有效分离目标蛋白。离子交换层析法对目标蛋白分离效果较好,但实验成本较高,操作复杂[7]。国内外已经围绕着桃过敏原蛋白Pru p 3纯化进行了不同程度的研究。Mori等[8]使用亲和层析预装色谱柱从桃蛋白粗提物中分离出了桃过敏原蛋白Pru p 3,该方法虽然得到的蛋白纯度较高,但是需要大型仪器支撑,操作较为复杂。邓珊等[9]利用多肽合成仪结合固相合成法合成8 条覆盖Pru p 3全部氨基酸序列的肽段,之后将每条肽段之间重叠5 个氨基酸,利用重叠肽段法最后得到桃过敏原蛋白Pru p 3。该方法虽然得到的蛋白纯度较高但是需要大量成本,且需要大量验证实验佐证。翟康乐等[10]利用AKTA avant柱层析对过敏原蛋白Pru p 3进行纯化,以不同紫外吸收波长区分并纯化收集桃过敏原蛋白Pru p 3。该方法虽然得到的目标蛋白纯度较高,但是操作较为复杂,成本较高,且对纯化的目标蛋白浪费较多。因此在节约成本、减少繁琐操作的同时尽可能多地得到纯度较高的目标蛋白是桃过敏原蛋白Pru p 3纯化的关键。
本研究将水蜜桃、油桃、蟠桃及黄桃作为研究对象,以ZipTipC18微量层析柱作为纯化工具一步纯化桃过敏原蛋白Pru p 3,并在筛选出桃过敏原蛋白Pru p 3特征肽段的基础上利用利用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)检测特征肽段的方法对纯化后的桃过敏原蛋白Pru p 3进行定性。旨在建立一种快速高效的过敏原蛋白Pru p 3纯化方法,为开展桃过敏原后续研究提供技术支撑。
1 材料与方法
1.1 材料与试剂
李子、杏、樱桃、草莓购自当地超市,贮存于 -80 ℃冰箱。
水蜜桃(浙江奉化玉露水蜜桃)、油桃(北京瑞光5号油桃)、黄桃(湖南锦绣黄桃)、蟠桃(新疆石河子143蟠桃),于2019年6—10月分别采收于浙江、北京、湖南、新疆,贮存于-80 ℃冰箱。
甲醇、水(均为质谱级) 美国Honeywell公司;甲酸(质谱级) 美国Sigma公司;碳酸氢铵、氯化钠、尿素、硫脲、磷酸氢二钠、磷酸二氢钾、氯化钾、盐酸、乙醇、冰乙酸、稀盐酸、磷酸、异丙醇 国药集团化学试剂有限公司;98%牛血清蛋白、考马斯亮蓝R250、丙烯酰胺、甲叉双丙烯酰胺、Tris碱(pH 8.8)、Tris碱(pH 6.8)、10%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、10%过硫酸铵、四甲基乙二胺、甘氨酸、甘油、Marker、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAA) 美国 Bio-Rad公司。
1.2 仪器与设备
Q-Trap 5500质谱仪 美国AB SCIEX公司;LC-20 XR高效液相色谱系统 日本岛津公司;5920 R型冷冻高速离心机 德国Eppendorf公司;涡旋振荡器 德国IKA公司;UM 5破碎机 德国Stephan公司;R3088旋转蒸发仪、冷冻干燥机 上海申生科技有限公司;1083型恒温振荡水浴 德国GFL公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)仪 美国Bio-Rad公司;ZipTipC18微量层析柱 美国Millipore公司。
1.3 方法
1.3.1 样品前处理
将保存于-80 ℃冰箱中的桃样品取出,去皮,将桃肉及桃皮分别用组织研磨机打磨成浆,平铺于研钵中并加入液氮不断研磨后转入培养皿,之后在冷冻干燥机中冻干3 d。将桃冻干物研磨成粉,过80 目筛,装袋密封保存于干燥器中。
1.3.2 桃过敏原蛋白提取
分别准确称量1 g桃冻干粉粉末加入到4 种提取液中:碳酸氢铵(ammonium bicarbonate,ABC)溶液(50 mmol/L)、磷酸缓冲溶液(10 mmol/L)、低盐(0.1 mol/L)溶液、2% SDS溶液各10 mL)。其中ABC溶液、磷酸缓冲溶液、低盐溶液以0 ℃对桃蛋白进行冰浴提取,提取时间为1 h;SDS溶液以80 ℃对桃蛋白进行热提取,提取时间为1 h。蛋白提取后涡旋振荡,超声30 min(温度不高于37 ℃)后取出,于4 ℃、12 000 r/min 离心15 min,取上清液过0.22 μm聚四氯乙烯膜得到桃蛋白提取液,将过膜后的蛋白提取液以旋干复溶进行浓缩,通过Q-Bit方法测定蛋白质量浓度,确保蛋白质量浓度达到1 μg/μL以上,并于-80 ℃保存备用[11]。
1.3.3 Pru p 3蛋白纯化
以ZipTipC18微量层析柱作为纯化工具对过敏原蛋白Pru p 3进行一步纯化,ZipTipC18微量层析柱首先在乙腈中平衡,然后在Milli-Q级水中与0.1%三氟乙酸(trifluoroacetic acid,TFA)平衡。吸取桃蛋白浓缩提取液,反复抽吸8 次。用0.1% TFA洗涤ZipTipC18微量层析柱,反复抽吸5 次,用4 μL 0.1% TFA-50%乙腈洗脱ZipTipC18微量层析柱吸附的蛋白,将收集的蛋白进行SDS-PAGE分析,进行比较对照,鉴定回收结果。其余于-80 ℃冰箱保存。
1.3.4 SDS-PAGE分析
采用15%分离胶与5%浓缩胶进行桃蛋白SDS-PAGE分析,上样量为20 μL,恒压80 V进行电泳120 min。电泳结束后,染色液染色90 min,脱色液脱色4 h后取胶块进行凝胶成像。
1.3.5 Pru p 3特征肽段筛选
在过敏原网站Allergen Search Results搜索“Pru p 3”,获得该蛋白肽段信息,运用PeptideCutter软件对桃过敏原蛋白Pru p 3进行模拟酶切,将酶切肽段在UniProtkB网站上进行BLAST比对,通过打分获得特征肽段,之后通过Skyline软件获得特征肽段离子对信息[12]。特征肽段筛选原则如下:以7~20 个氨基酸为宜;不含错切或漏切的酶切位点;最好不含甲硫氨酸;具有稳定的物理化学性质;进行定性定量分析时,具有较好的灵敏度和峰形。最终筛选出段响应值较好、灵敏度较高的特征肽段[13]。
1.3.6 LC-MS/MS分析条件
色谱条件:色谱柱使用美国Phenomenex公司的Kinetex C18反相色谱柱(100 mm×2.1 mm,2.6 μm);流动相A为0.1%甲酸-2%乙腈-98%水,流动相B为0.1%甲酸-2%水-98%乙腈;梯度洗脱程序:0.1~0.5 min,98% A、2% B;0.5~25 min,92% A、8% B;25~31 min,78% A、22% B;31~33 min,65% A、35% B;33~36.5 min,20% A、80% B;36.5~39.9 min,98% A、2% B;柱温40 ℃,进样量2 μL,流速0.4 mL/min。
质谱条件:电喷雾电离正离子模式;气帘气压力30 psi;雾化气压力50 psi;辅助气压力50 psi;碰撞气压力6 psi;喷雾电压5 500 V;电喷雾离子源温度550 ℃;扫描方式:多离子反应监测(multiple reaction monitoring,MRM)[14]。
1.3.7 桃蛋白膜上酶切
将桃蛋白提取液从-80 ℃冰箱取出,置于4 ℃冰箱进行解冻。通过Q-Bit进行蛋白浓度测定后进行膜上酶切。加入10 μL IAA,室温条件下避光放置15 min。将处理液全部转移至5 kDa超滤离心管内,12 000 r/min离心10 min后加入50 μL 50 mmol/L ABC溶液,12 000 r/min 离心10 min。之后加入100 μL 50 mmol/L的ABC溶液,12 000 r/min离心10 min,重复3 次。倒掉收集管中的废液,用100 μL 质谱水清洗2 次。膜上各加入100 μL 50 mmol/L的ABC溶液及4 μL 胰蛋白酶溶液,涡旋混匀后用封口膜封住,37 ℃条件下水浴酶切4 h。将酶切后的样品取出,12 000 r/min离心10 min后加入100 μL 25 mmol/L的ABC溶液,12 000 r/min离心5 min,重复2 次[15],合并收集液。
1.3.8 Pru p 3切胶回收鉴定
将SDS-PAGE胶片用刀片割下Pru p 3的条带后水洗胶块2 次,吸走液体。之后对较快胶块脱色处理:加入考染脱色液100 μL(溶液的量视胶块具体大小而定),室温脱色1 h左右,直至胶块颜色完全褪去,吸走液体。水洗胶块,将脱色后的染料洗去,吸走液体。加入50%乙腈溶液让胶块脱水,弃去ACN后再加入100% ACN溶液,直至胶块变白完全脱水,分别吸走液体。加入50 μL 10 mmol/L DTT溶液(溶于25 mmol/L ABC溶液),56 ℃水浴50 min,离心,吸走液体。之后加入50 μL 55 mmol/L IAA溶液(溶于25 mmol/L ABC溶液),避光反应15 min,吸走液体。以100 μL超纯水水洗胶块,将反应剩余液体吸走。加入胰酶5~20 μL(具体视胶块大小而定),让胶块充分吸胀,变透明20 min,再剩余1~3 μL的酶液。37 ℃水浴过夜酶切16 h。-20 ℃冰箱保存待测样品,用于LC-MS/MS-MRM鉴定[16-17]。
1.4 数据统计及分析
每组数据平行测定3 次。运用SPSS 25.0软件对实验数据进行统计分析,数据均值的多重比较采用Duncan法,并进行One-Way ANOVA检验,P<0.05,差异显著。表格由Excel软件绘制。
2 结果与分析
2.1 桃蛋白提取液SDS-PAGE分析
经Q-bit法定量总蛋白质浓度,上述4 种缓冲液的蛋白提取质量浓度分别为0、0.251、0.485 mg/mL和0.845 mg/mL,可以看出,ABC提取液对桃蛋白的提取浓度几乎为0,SDS热提取效果最好,因此选取SDS热提取法对不同样本的桃皮及桃肉中蛋白进行提取,结果如图1所示。桃过敏原蛋白Pru p 3的分子质量为9 kDa,4 种桃类提取液中均含有桃过敏原蛋白Pru p 3,而桃皮中Pru p 3质量浓度高于桃肉,与其他相关报道相符[18-20]。由图1还可以看出,油桃的桃皮中Pru p 3含量较高,而蟠桃桃肉中Pru p 3含量较高。

图1 SDS热提取法对4 种桃蛋白提取SDS-PAGE图Fig. 1 SDS-PAGE electrophoretograms of proteins extracted from four species of P. persica using hot SDS
2.2 桃过敏原蛋白Pru p 3纯化
以ZipTipC18微量层析柱作为纯化工具一步纯化桃过敏原蛋白Pru p 3,将纯化后的蛋白进行SDS-PAGE分析。由图2可以看出,该纯化方法对4 种桃类桃皮及桃肉中的过敏原蛋白Pru p 3的纯化效果明显,由于桃肉中仍然含有部分杂蛋白,因此该方法对桃皮的纯化效果优于桃肉。通过比较条带灰度值,桃皮及桃肉中Pru p 3纯度均在95%以上,因此该纯化方法高效且得率高。

图2 桃过敏原蛋白Pru p 3纯化SDS-PAGE图Fig. 2 SDS-PAGE profiles of purified peach Pru p 3

2.3 Pru p 3特征肽段筛选与验证
图3为Pru p 3的胰蛋白酶酶切肽段信息,由于胰蛋白酶酶切位点为K与R,因此将模拟酶切后的肽段ITCGQVSSALAPCIPYVR、GGGAVPPACCNGIR、NVNNLAR、TTPDR、QAACNCLK、QLSASVPGVNPNNAAALPGK、CGVHIPYK、ISASTNCATVK在UniProtkB网站上进行BLAST比对打分,除ITCGQVSSALAPCIPYVR与CGVHIPYK打分为100 分且只存在于桃中之外(100 分合格),其他肽段均不符合条件(肽段GGGAVPPACCNGIR、QAACNCLK、QLSASVPGVNPNNAAALPGK、ISASTNCATVK得分为100,但其不仅存在于桃中还分别存在于山荆子、豌豆、杏子、李子中,不具备特异性。肽段NVNNLAR、TTPDR得分未到100不合格),因此筛选出肽段ITCGQVSSALAPCIPYVR与CGVHIPYK作为桃过敏原蛋白Pru p 3的特征肽段[21]。表1为特征肽段ITCGQVSSALAPCIPYVR与CGVHIPYK的MRM参数。该参数所提供的母子离子对信息及保留时间等,有助于质谱信号采集。图4为桃过敏原蛋白Pru p 3特征肽段ITCGQVSSALAPCIPYVR与CGVHIPYK提取离子流图。

图3 桃过敏原蛋白Pru p 3胰蛋白酶酶切肽段信息Fig. 3 Trypsin cleavage of peach Pru p 3

表1 桃过敏原蛋白Pru p 3各肽段MRM参数Table 1 MRM parameters of peptides derived from peach Pru p 3

图4 桃过敏原蛋白Pru p 3特征肽段ITCGQVSSALAPCIPYVR与CGVHIPYK提取离子流图Fig. 4 Extracted ion current chromatograms of signature peptides ITCGQVSSALAPCIPYVR and CGVHIPYK from peach Pru p 3
由于桃属于蔷薇科水果,因此以筛选出的肽段ITCGQVSSALAPCIPYVR与CGVHIPYK为特征肽段,对李、杏、樱桃、草莓4 种蔷薇科阴性样品的酶切肽段进行LC-MS/MS分析,提取特征肽段的特征离子对,未发现阴性样品中产生离子流峰响应。由图5可以看出,在保留时间为10 min及12 min时,并没有响应峰出现,说明在李、杏、樱桃、草莓4 种蔷薇科水果中均不存在特征肽段ITCGQVSSALAPCIPYVR与CGVHIPYK,所筛选的肽段为特异性肽段[22-25]。
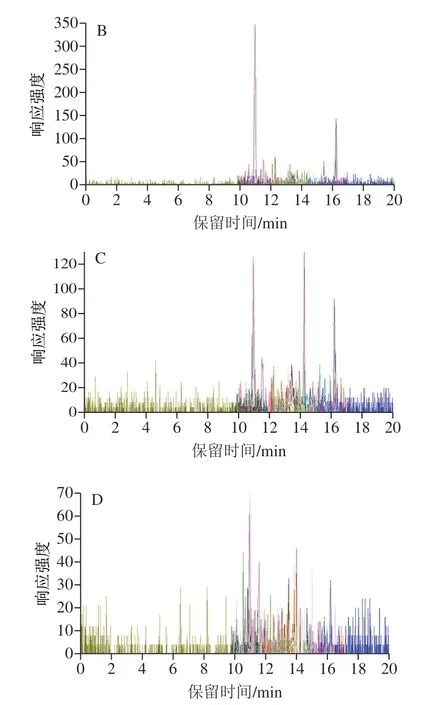
图5 4 种阴性样品蔷薇科水果中Pru p 3特征肽段提取离子流图Fig. 5 Extracted ion current chromatograms of signature peptides from Pru p 3 in negative samples of four Rosaceae fruits
热杀菌是桃汁、桃果脯等桃制品最常用的杀菌方式之一,热加工处理会对某些肽段产生降解作用,因此一条肽段是否具有热稳定性也是衡量其能否作为特征肽段的重要标准[26]。为此对筛选出的特征肽段进行热稳定性实验的考察,将桃蛋白提取液进行煮沸处理,结果发现,经过加热煮沸后的桃蛋白提取液中特征肽段响应值并没有明显变化(图6),因此所筛选的特征肽段具有一定的热稳定性,经过热加工之后不会降解。


图6 热加工条件下桃过敏原蛋白Pru p 3特征肽段ITCGQVSSALAPCIPYVR与CGVHIPYK提取离子流图Fig. 6 Extracted ion current chromatograms of signature peptides ITCGQVSSALAPCIPYVR and CGVHIPYK from boiled and unboiled peach Pru p 3
2.4 桃过敏原蛋白Pru p 3切胶回收鉴定
以之前筛选出的两条肽段ITCGQVSSALAPCIPYVR与CGVHIPYK为特征肽段,通过质谱分析发现Pru p 3进行切胶回收后的酶解液中均能提取出2 条特征肽段的离子对(图7),因此可证明以ZipTipC18微量层析柱作为纯化工具的一步纯化法纯化蛋白为桃过敏原蛋白Pru p 3。

图7 桃过敏原蛋白Pru p 3切胶回收质谱鉴定Fig. 7 Identification of peach Pru p 3 by mass spectrometry
3 讨论与结论
目前桃过敏原蛋白Pru p 3的纯化方法较多,但是不同的纯化方法均存在其弊端,普遍存在着蛋白纯化纯度与操作难易程度呈反比的现状[27]。相比较其他的纯化方法而言,以ZipTipC18微量层析柱为纯化工具一步纯化出的桃过敏原蛋白Pru p 3不仅得率高,而且操作过程简单、节约成本,可以作为一种新型的桃过敏原蛋白Pru p 3的纯化方法。但是由于植物基质中存在几种非蛋白质化合物,如酚、脂、色素和碳水化合物,它们可能干扰蛋白分析过程,因此在进行Pru p3蛋白纯化之前,应用乙醇有效分离脂质和其他疏水物质,防止污染ZipTipC18微量层析柱。Pru p 3属于小分子蛋白,甚至分子质量小于很多肽段,ZipTipC18微量层析柱不仅能对桃过敏原蛋白Pru p 3进行分离纯化,同时同样适用于其他小分子疏水性蛋白的纯化。在Pru p 3纯化过程中发现在虽然桃果皮中Pru p 3的含量远高于果肉,但这种过敏原蛋白仍然存在于果肉当中,这与其他研究相符[28-30]。因此对桃进行去皮处理只能降低桃的致敏性,并不能达到脱敏的目的。
本研究描述了一种简单、高效、经济的提取和纯化方法对桃过敏原蛋白Pru p3进行纯化,并且通过LC-MS/MS-MRM对该方法纯化出的蛋白进行鉴定,结果证明该方法能够有效纯化桃过敏原蛋白Pru p 3,且纯度高达95%以上。
