蛋黄蛋白-植酸静电复合物对蛋黄乳液 物理稳定性的影响
2021-11-05毕雅雯董世建徐明生
刘 晶,毕雅雯,董世建,徐明生,
(1.江西农业大学 江西省农产品加工与质量控制工程实验室,江西 南昌 330045;2.江苏食品药品职业技术学院,江苏 淮安 223023;3.安徽荣达食品有限公司,安徽 宣城 242228)
蛋黄(egg yolk,EY)营养丰富,具有良好的加工特性,是食品生产中常用的原料。EY富含蛋白质、磷脂等表面活性成分,具有在酸性条件形成乳液的特性,在EY酱、调味料及乳饮料中得到应用[1]。但是EY在酸性乳液体系中不稳定,制备的乳液易分层或析油,对产品的外观及保质期易造成不良影响,其限制EY乳液在实际生产中的应用[2]。因此,改善EY在酸性乳液体系的物理稳定性具有重要意义。
研究表明,EY蛋白对乳化性能的贡献高于磷脂[3],改性蛋白质以提升乳液的稳定性成为研究热点。现普遍通过物理法或添加食品成分对EY改性提高乳液物理稳定性。谢云霄[4]超声处理EY以部分聚集EY的低密度脂蛋白(low density lipoprotein,LDL),蛋白质分子界面变得柔软可拉伸,EY乳液的稳定性因此提高。Bao Zhijie等[5]使用蛋白酶对蛋白质定向水解以改善EY的功能性质,使乳液稳定性得以提升。此外,通过食品成分与EY形成复合物,提高EY乳液稳定性也是常用手段[6],如张诗思[7]制备的黄原胶-EY复合物在乳液中形成三维空间网络结构以抑制液滴聚集,并增加乳液黏度限制液滴移动以达到稳定EY乳液的作用;高扬[8]制备的壳聚糖-EY静电复合物在乳液液滴表面提供空间阻力使EY乳液稳定;Yang Xi等[9]通过海藻酸钠-EY不溶性静电复合物制备EY酱,有效改善其黏度及稳定性。
植酸(phytic acid,PA)主要存在于谷物或豆类等植物中,是天然小分子化合物[10-11]。PA有6 个带负电荷的磷酸基团,其与带正电荷的蛋白质静电相互作用形成复合物[12]。如PA与乳清蛋白静电相互作用,二者形成不溶性静电复合物增强乳滴间的空间位阻,提高乳液的物理稳定性[13]。此外,PA可螯合金属离子[14],其固定EY中金属离子以破坏酸性EY中稳定的磷酸钙桥结构而释放更多带正电荷的蛋白质[15],因此形成更多不溶性静电复合物。然而,目前EY蛋白与PA形成静电复合物对酸性EY乳液稳定性的影响尚不清楚。本实验在EY乳液产品的常规环境(pH 3.0)中,研究PA质量分数(0%~0.8%)对EY蛋白及EY乳液物理稳定性的影响。通过分析静电复合物制备EY乳液的乳析指数、黏度、粒径、微观结构及界面性质,以期了解EY-PA影响酸性EY乳液稳定特性的规律,为改善酸性EY乳液类产品的生产及应用提供一定参考。
1 材料与方法
1.1 材料与试剂
鸡蛋市购;大豆油中国益海嘉里金龙鱼粮油食品股份有限公司;PA美国Sigma公司;叠氮化钠 国药集团化学试剂有限公司;Bradford蛋白试剂盒 北京 索莱宝科技有限公司;蛋白上样缓冲液(loading buffer,LB) 美国Thermo Scientific公司。
1.2 仪器与设备
K-355凯氏定氮仪 瑞士Büchi公司;T25高速分散机 德国IKA公司;Zetasizer Nano ZS90电位仪 英国Malvern公司;DHR-1流变仪 美国TA仪器公司;Mastersizer 3000激光粒度分析仪 英国Malvern公司;IX73倒置荧光显微镜 日本奥林巴斯公司。
1.3 方法
1.3.1 混合EY液制备
将新鲜EY液搅拌过筛得均匀EY液,并参照GB 5009.5—2016《食品中蛋白质的测定》[16]中的凯氏定氮法进行蛋白质含量的测定,于4 ℃冰箱备用。PA粉末溶于超纯水中制备质量分数2% PA溶液备用。将EY液、PA溶液和超纯水以不同比例均匀混合,并使用0.1 mol/L HCl、0.1 mol/L NaOH溶液调节pH值至3.0,分别得到均含有质量分数1% EY蛋白的0%、0.012 5%、0.05%、0.2%、0.8% PA溶液。
1.3.2 乳液的制备
将上述制备的混合EY液与大豆油一定质量比混合,再使用分散机在25 ℃、11 000 r/min剪切2 min制成不同乳液。
1.3.3 Zeta电位测定
参考Gao Yang等[2]的方法并略作修改,用超纯水将混合EY液稀释200 倍,使用电位仪测定溶液所带电荷。
1.3.4 溶解度测定
取适量混合EY液于离心管中,于4 ℃、12 000 r/min离心20 min取出上清液。使用Bradford蛋白试剂盒的微孔酶标仪法[4]测上清液蛋白质量浓度(mg/mL)。
1.3.5 乳析指数测定
参考Chen Xing等[17]的方法,取新鲜乳液,以质量分数0.04%叠氮化钠溶液为抗菌剂防止乳液腐败,然后将乳液置于密闭的玻璃瓶中,玻璃瓶放于25 ℃的恒温避光培养箱中,分别于第1、3、5、7、14、21、28天监测乳液,在第7天时拍照记录乳液的外观。按式(1)计算乳析指数:

式中:Hs为不同时间下层清液的高度/cm;Ht为整个乳液的高度/cm。
1.3.6 黏度测定
参考高扬[8]的方法,用流变仪测定乳液黏度。使用铝制平板(直径40 mm,夹具与载物台之间间距1 mm),在室温25 ℃,对2.0 mL乳液进行连续剪切实验,剪切速率范围为0.1~100 s-1,测定样品的黏度在连续剪切条件的变化。
1.3.7 粒径测定
参考唐世涛[18]的方法,并略作修改,使用Mastersizer 3000激光粒度分析仪测定乳液粒径分布。参数设置:大豆油折射率1.470,材料吸收率0.010,分散剂蒸馏水,折射率1.330。取适量乳液加入样品池,直到混合溶液的遮光度达到10%~15%之间。所有测试均在室温进行并重复3 次取平均值。
参考李慧娜[19]的方法并略作修改。使用倒置荧光显微镜观察乳滴的微观结构。使用超纯水适当稀释乳液并用尼罗红染料染色,再用毛细吸管吸取少量乳液于干净的载玻片中央,并轻轻盖上盖玻片。经平衡2 min后进行观察,使用倒置荧光显微镜仪器自带的软件控制摄像机拍照。
1.3.9 界面蛋白吸附量测定
参考高扬[8]的方法,并略作修改,取15 mL乳液于4 ℃、12 000 r/min离心20 min,离心后观察到3 个部分:离心管上层的乳脂层,中层的水相和底部的沉淀物。用注射器小心去除乳脂层以收集水相和沉淀物,再次离心子相以彻底去除乳脂层,重复去除乳脂层3 次,最后收集水相和沉淀物。其中,水相通过0.22 μm滤膜过滤后,使用Bradford蛋白试剂盒测定蛋白质含量;沉淀物用凯氏定氮法测定蛋白质含量。乳液界面吸附蛋白量为每克油吸附的蛋白质量,按式(2)计算界面蛋白吸附量:
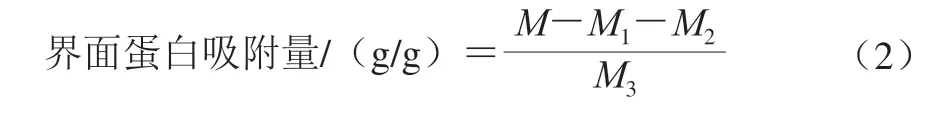
式中:M为乳液的总蛋白质质量/g;M1为中层水相的蛋白质质量/g;M2为底部沉淀物的蛋白质质量/g;M3为乳液油相的质量/g。
1.3.10 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
参考Yang Yuan等[20]的方法,并略作修改。将一定蛋白浓度的稀释液与蛋白LB混匀并沸水浴5 min,于4 ℃、10 000 r/min离心5 min。分离胶和浓缩胶分别为12%和5%,恒压120 V。运用R-250染色,ChemiDoc XRS+凝胶成像仪扫描处理。
1.4 数据统计
所有样品一式3 份并以平均值表示。使用Origin 8.0、Excel 2013软件分析所有数据。使用SPSS 19.0软件进行方差分析,显著性通过Duncan多重比较得出。
针对上述实战需求本文提出了一种基于机器学习的在押人员可穿戴多传感器融合的生命体征监测系统设计方案。在该系统中具体的产品形式包括智能指环、智能手环和智能胸带。其中嵌有血氧采集传感器、体温传感器、血压传感器、心率传感器等,可以实时监测被监管人员的生命体征数据。所采集的生命体征数据通过无线传感网络传输,可以使远程监控中心应用服务能够在快速的与生命体征监测设备进行数据交互,同时具有与PC、手机和PAD 等不同的终端进行交互数据的能力,进而能够将数据通过无线的方式传输至网络云端进行分析处理、可视化展示以及通过机器学习算法和模型对健康状况进行研判。
2 结果与分析
2.1 混合EY液的Zeta电位分析
如图1所示,随着PA质量分数的升高,溶液的Zeta电位呈显著降低的趋势(P<0.05),其原因为pH 3.0时,EY蛋白带净正电荷[21],而PA有6 个带负电荷的磷酸基团,所以PA一般呈负电性[22]。因此,随着PA质量分数的升高,更多带负电荷的PA与带正电荷的EY蛋白静电相互结合,溶液的Zeta电位持续降低,这与Pei Yaqiong等[13]的研究结果一致。Zeta电位的结果表明在pH 3.0时,PA与EY蛋白可发生静电相互作用。
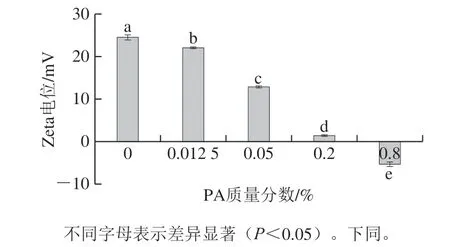
图1 混合EY液的Zeta电位Fig. 1 Zeta potential of EY mixtures
2.2 混合EY液的溶解度分析
如图2所示,pH 3.0时,随着PA质量分数的升高,混合EY液的溶解度呈先下降后上升的趋势,其原因为PA质量分数低于0.2%时,逐渐增多的阴离子PA与带正电荷蛋白质氨基酸残基缓慢结合,不断中和蛋白质的静电排斥力,以聚集蛋白质形成不溶性静电复合物EY-PA;由于复合物含量开始增多,溶解度出现显著性下降趋势 (P<0.05)。而PA质量分数在0.2%~0.8%时,不断增多的阴离子PA提高复合物间的静电排斥力,溶解度开始增加,静电复合物含量减少,此时PA发挥类似离液阴离子的作用[23]。溶解度的结果表明pH 3.0时,带正电荷的EY蛋白与负电荷PA静电结合以形成不溶性复合物EYPA,且静电复合物的含量依赖PA质量分数。
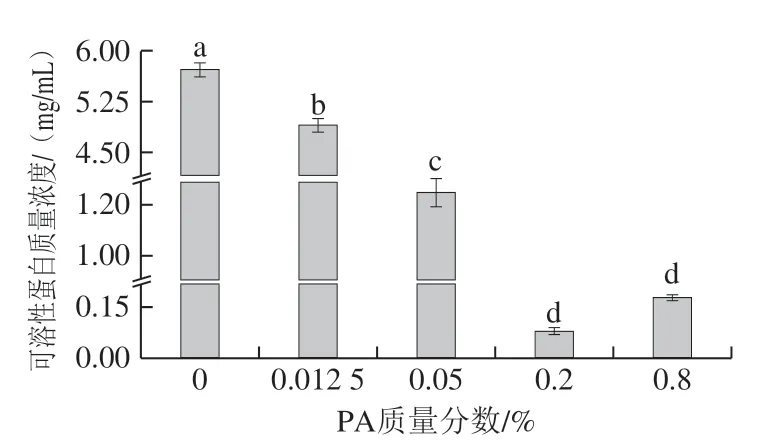
图2 混合EY液的可溶性蛋白质含量Fig. 2 Soluble protein contents in EY mixtures
2.3 混合EY液可溶性蛋白质组成
为了解不同PA质量分数结合EY蛋白的种类及顺序,完善EY蛋白与PA形成复合物的作用机制。采用SDS-PAGE分析混合EY液中可溶性蛋白的组成,并推理已结合的蛋白质种类。EY中LDL、高密度脂蛋白(high density lipoprotein,HDL)、卵黄高磷蛋白(phosvitin,PV)及卵黄球蛋白(livetine,VN)是主要的蛋白质成分。如图3所示,对照组1% EY蛋白泳道主要是LDL(220、110~180、50 kDa)、VN(38~40 kDa)[18,24],其原因为LDL与VN几乎在任意离子强度或pH值的溶液中溶解,而EY中磷酸钙桥的结构稳定,磷酸钙桥仅在高离子浓度或者pH值接近中性时才逐渐被破坏并释放HDL、LDL、PV[24]。因此pH 3.0时,EY中可溶性蛋白成分主要以LDL与VN为主。1% EY-0.012 5% PA的蛋白条带组成和对照组无明显变化,只是部分条带深浅产生变化,表明此时PA已和少量EY蛋白结合,但极低质量分数PA并未改变混合EY液的可溶性蛋白组成。而在0.05% PA的泳道上,LDL与VN条带基本消失,且出现35 kDa HDL、53 kDa HDL、19 kDa LDL、59 kDa PV条带[18,20,25],所以此时LDL、VN分别与PA形成不溶性复合物PA-LDL和PA-VN,且游离PA开始破坏EY磷酸钙桥结构,释放其中可溶性带正电荷的EY蛋白。而PA质量分数在0.2%或0.8%时的混合EY液可溶性蛋白浓度极低,其泳道出现与0.05% PA相同分子质量但颜色较浅的条带,所以增多的PA将磷酸钙桥释放的蛋白质再次静电结合形成EY-PA。SDS-PAGE结果表明pH 3.0时,随着PA质量分数的提高,PA先与EY中可溶性蛋白形成不溶性静电复合物,接着破坏EY磷酸钙桥结构,并与释放的蛋白质再次结合形成更多的不溶性静电复合物EY-PA。
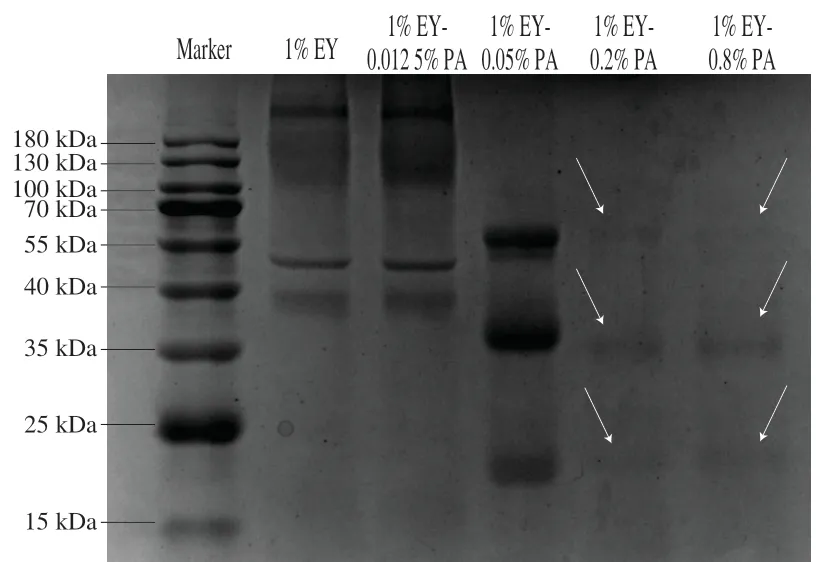
图3 混合EY液的可溶性蛋白组成Fig. 3 SDS-PAGE analysis of soluble protein components in EY mixtures
2.4 不同比例乳液的乳析指数
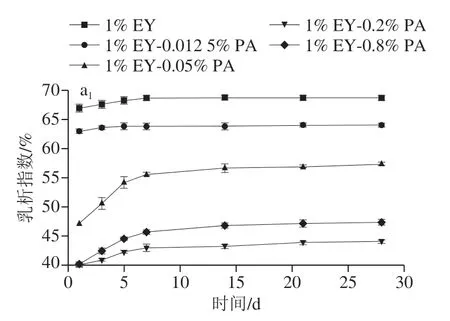
乳液乳析指数是衡量乳液物理稳定性的重要参数,一般乳析指数越大则液滴移动越快,液滴越易聚集,乳液物理稳定性越差[26]。图4a为不同PA质量分数的混合EY液与大豆油混合质量比3∶1时,剪切均质制备的乳液。由图4a1可知,3 组乳液的乳析指数随着贮藏时间延长均呈缓慢上升的趋势,且在第7天后上升速度降低至趋于平缓,因此分析第7天乳液的乳析指数、外观图。 由图4a2、a3可知,随着PA质量分数的升高,复合物EY-PA制备EY乳液的乳脂层较对照组的厚度均增加,乳析指数呈先显著下降再上升的趋势(P<0.05),1% EY-0.2% PA组乳析指数低于其他组别。表明EY-PA制备乳液的液滴间斥力作用强度高于对照组乳液,液滴有规则地分布并紧密堆积使乳脂层加厚[27]。此外,乳液乳析指数变化与对应混合EY液溶解度的变化趋势相似,这说明EY-PA制备的乳液的物理稳定性与不溶性静电复合物含量呈正相关性。乳析指数的结果表明,PA能提高EY乳液物理稳定性,但过高浓度PA破坏乳液稳定,其具体机理需深入研究。
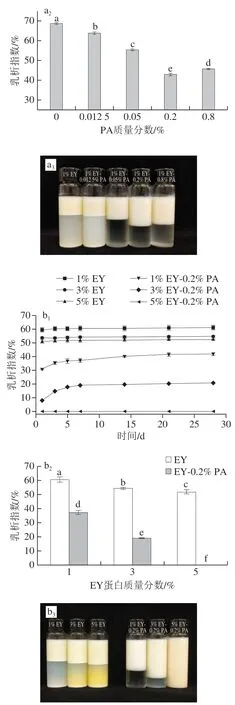
图4 乳液的乳析指数变化及第7天乳液的外观图Fig. 4 Changes in creaming index and appearance of emulsions on the seventh day of storage
为了探究EY-PA制备的酸性EY乳液保持稳定状态的能力,实验研究pH 3.0及最优PA质量分数(0.2% PA)时,不同EY蛋白质质量分数(1%、3%、5%)对乳液稳定性能的影响。图4b为不同蛋白质量分数的混合EY液与大豆油混合质量比为2∶1时,剪切均质制备的乳液。由 图4b1可知,5% EY-0.2% PA制备乳液在28 d内乳析指数均为0;其他乳液的乳析指数随着贮藏时间延长均呈缓慢上升的趋势,且在第7天后变化趋于平缓。由图4b2、b3可知,随着EY蛋白质量分数的提高,实验组和对照组的乳析指数均呈显著下降趋势(P<0.05);1% EY-0.2% PA制备乳液的乳析指数甚至低于5% EY制备乳液的乳析指数;放置28 d的5% EY-0.2% PA制备乳液仍未分层。这些结果表明pH 3.0时,EY-PA制备EY乳液的稳定性得到显著改善,且使用复合物制备的乳液能减少EY使用量并达到稳定状态。
2.5 不同比例乳液的黏度
乳液黏度与乳滴间的聚集程度及稳定性密切相关[28]。 由图5可知,乳液黏度随剪切速率的增大而降低, 极高剪切速率下黏度趋于定值,EY乳液均呈剪切稀化。图5a中,相同剪切速率的作用时,PA质量分数在0%~0.2%时,随着PA质量分数的增加,乳液黏度不断升高;当PA质量分数由0.2%升高至0.8%时,乳液黏度出现降低现象,此现象与Pei Yaqiong等[13]的研究结果一致。Le Denmat等[24]发现在EY乳液中,较高的乳液黏度意味着乳滴间空间斥力作用较强,其限制乳液液滴的流动性,有助于加强乳液稳定性。由图4a3可知,PA能提高EY乳液的黏度并改善乳液稳定性,但过高含量的PA可能会降低界面上蛋白质间的斥力作用而降低乳液稳定性。
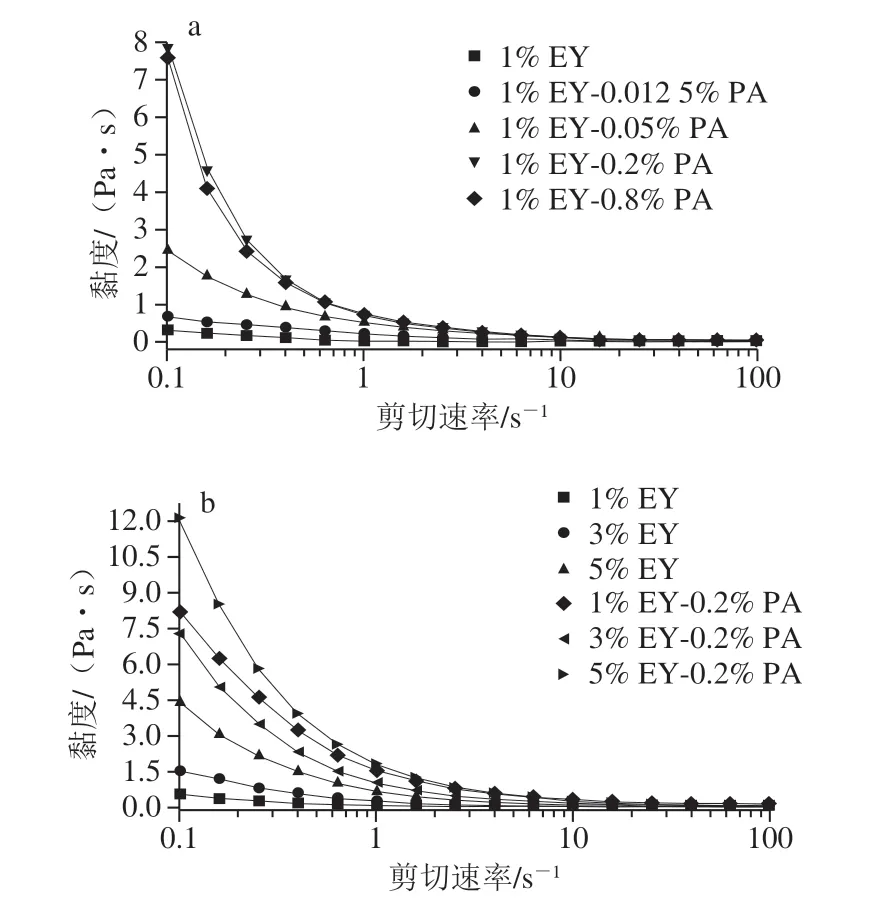
图5 不同PA质量分数(a)和EY蛋白质量分数(b)乳液的黏度Fig. 5 Viscosity versus shear rate curves of emulsions with different PA concentrations (a) and different EY concentrations (b)
由于EY乳液黏度影响产品的口感及质量[29],因此研究不同EY蛋白质量分数(1%、3%、5%)对乳液黏度的影响。由图5b可知,相同剪切速率的作用时,纯EY乳液的黏度随着蛋白质量分数增加而不断升高,此现象与Anton等[30]的研究结果一致。由图5b可知,EY-0.2% PA制备乳液的黏度均高于对照组(1%、3%、5% EY)制备的乳液的黏度,此现象与Pei Yaqiong等[13]加入PA后,乳液界面上蛋白质间的空间斥力作用加强而黏度变大的结果一致。由图4b3可知,纯EY组乳液的下层清液较浑浊甚至底部有沉淀产生,而1% EY-0.2% PA制备乳液的下层清液层几乎透明,其原因可能为更多EY在油水界面处稳定乳液,因此酸性EY乳液较其他条件制备乳液有更好的稳定性[31]。
2.6 乳液的粒径分析
乳液粒径影响乳液稳定性,乳滴粒径越小的乳液越稳定[32]。如图6所示,随着PA质量分数的增加,乳液粒径呈先显著减小后增大的趋势(P<0.05)。这表明PA与EY蛋白静电结合形成复合物后,在剪切均质过程中,复合物吸附到油水界面形成粒径较小的液滴,使乳液更稳定。浓度过高的PA聚集一部分乳滴聚结,从而使乳液中乳滴的平均粒径上升,降低EY乳液稳定性。结合图4、5可知,乳析指数、黏度、粒径有一定关联性,即EY-PA制备的酸性EY乳液黏度越高,粒径越小,稳定性越理想。

图6 乳液的粒径Fig. 6 Particle sizes of emulsions with different PA concentrations and 1% EY mixtures
2.7 不同比例乳液的微观结构
乳液微观结构的表征可揭示液滴的微观形态、分布情况。由图7可知,对照组(1% EY)乳液的液滴粒径较大,且分布不均匀,大量液滴聚集、聚结。PA质量分数0.012 5%~0.2%时,乳滴随着PA质量分数的增加而减小粒径,且分布更均匀,聚集、聚结情况好转。PA质量分数0.2%~0.8%时,1% EY-0.2% PA制备乳液的粒径较1% EY-0.8% PA制备的乳液的粒径明显减小,液滴呈规律的球形,且极少有聚结情况,所以1% EY-0.2% PA制备乳液保持理想的稳定性。因此pH 3.0时,EY蛋白作为乳化剂仍可包覆在油滴表面形成界面膜,但是由于缺乏足够排斥力,小液滴容易聚集并聚结形成更大粒径的液滴。而适量的PA可提供一定空间阻力以保持乳滴规则的球状,且未打破液膜形成更大尺寸的液滴。从微观角度说明EY-PA制备EY乳液形成的界面膜具有一定阻止液滴合并的能力。
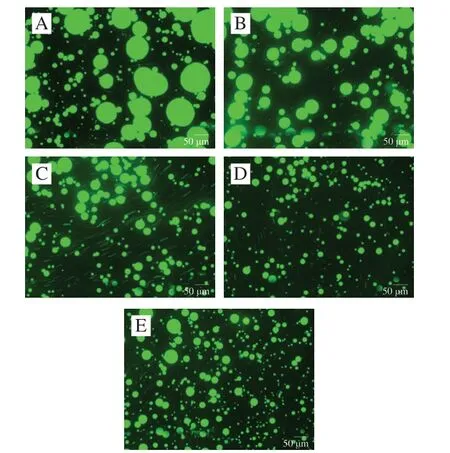
图7 乳液的液滴分布图(×20)Fig. 7 Droplet distribution micrographs of emulsions (× 20)
2.8 乳液界面蛋白吸附量分析
界面吸附层性影响乳液聚集稳定,界面蛋白吸附量是表征乳液稳定性的重要指标之一。由图8可知,1% EY-0.2% PA的界面吸附量与其他组别相比显著提高 (P<0.05)。随着PA质量分数的增加,EY乳液的界面蛋白吸附量呈先显著增大后减少的趋势(P<0.05)。另外,乳液的界面蛋白吸附量与乳析指数变化结果一致,即界面蛋白吸附量越高,乳液的乳析指数越小,乳液的稳定性越好,其原因为EY乳液中界面蛋白吸附量越高,则吸附在油滴表面的蛋白质含量越高,易形成致密的界面膜。界面蛋白膜越厚,空间位阻作用越明显,乳液抗聚结稳定性越好[19,33]。更高的界面蛋白吸附量除了增加界面上的蛋白质覆盖率,还抑制液滴聚集并形成较小的液滴[34-35]。因此,PA通过螯合磷酸钙桥释放蛋白质形成更多EY-PA复合物,使油滴表面的蛋白含量增加,界面空间位阻作用更明显,这限制了乳滴移动聚集,有助于形成更小粒径的液滴,由此乳液更稳定。而过高的PA质量分数降低静电复合物含量、界面蛋白吸附量,使乳液稳定性降低。
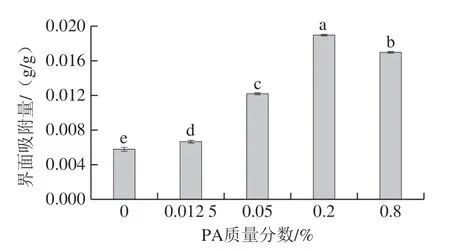
图8 乳液的界面蛋白吸附量Fig. 8 Interfacial protein adsorption capacity of emulsions with different PA concentrations and 1% EY
2.9 不同比例乳液的界面蛋白质组成
EY乳液主要由蛋白质形成并稳定,不同蛋白质稳定乳液的能力存在差异[23],因此采用SDS-PAGE手段分析EY-PA制备乳液的界面蛋白组成变化情况。由于各组界面蛋白均稀释6 倍,条带的深度代表其界面蛋白含量。由图9可知,1% EY泳道上的界面蛋白条带主要为LDL、VN,明显少于EY(pH 7)蛋白条带数。1% EY-0.012 5% PA的界面蛋白条带组成与1% EY基本相同,但1% EY-0.012 5% PA条带颜色更深。在PA质量分数0.05%~0.2%时,EY-PA制备乳液的界面蛋白条带中较对照组出现新条带,主要是35 kDa HDL、53 kDa HDL、19 kDa LDL、59 kDa PV条带,且随着PA质量分数的升高,界面蛋白条带颜色加深;而PA质量分数在0.2%~0.8%范围内增加时,条带颜色变浅。界面蛋白条带的颜色深度变化与界面蛋白吸附量变化结果一致。界面蛋白SDS-PAGE表明在pH 3.0时,EY中溶解性较好的LDL、VN吸附到界面上稳定乳液[24];而PA通过静电结合EY中可溶性蛋白,并破坏磷酸钙桥以释放其中的蛋白质,再与释放的游离蛋白质形成更多静电复合物EY-PA吸附到界面上稳定EY乳液。而过高浓度PA并不影响EY乳液的界面蛋白质组成,但是会降低界面蛋白吸附量,导致乳液稳定性变差。EY-PA制备乳液的界面蛋白条带与EY(pH 7)条带基本相同,这说明PA仅通过静电相互作用与EY蛋白结合,并未破坏蛋白质的组成结构。
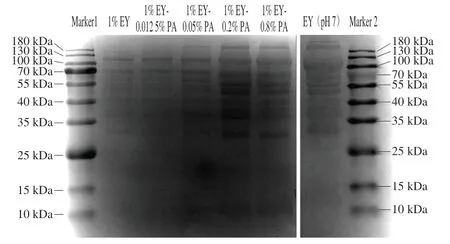
图9 乳液的界面蛋白组成Fig. 9 SDS-PAGE analysis of interfacial protein components of emulsions
3 结 论
本实验通过研究酸性条件中不同质量分数的PA对EY蛋白、EY乳液稳定性的影响,发现在EY液中添加PA能有效改善酸性EY乳液的稳定性。PA质量分数在 0.012 5%~0.2%范围内增加时,PA通过螯合作用破坏酸性EY中的磷酸钙桥并释放其中包覆的可溶性正电荷蛋白,并与EY中带正电荷的可溶性蛋白通过静电相互作用形成不溶性静电复合物EY-PA。由EY-PA制备酸性EY乳液较对照组黏度更高,粒径更小,乳析速率降低。乳液的微观及界面结果表明,改性EY液在剪切均质过程中有更多蛋白质吸附到油水界面,形成更厚的界面膜;乳液保持较小的液滴并呈规则球状均匀分布,液滴间聚结现象好转。但PA质量分数需控制在0.012 5%~0.2%范围内,过高含量(0.8%) PA减少静电复合物的含量,且破坏界面上蛋白质间的斥力作用导致EY乳液稳定性下降。本研究为EY-PA静电复合物应用于酸性EY乳液类产品的研发、生产提供参考。
