欧李果胶理化特性及乳化性质
2021-11-05张士凯何子杨秦伟帅许方舟李来成
张士凯,何子杨,秦伟帅,程 月,许方舟,李来成,吴 澎,
(1.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点实验室,山东 泰安 271018;2.泰山学院生物与酿酒工程学院,山东 泰安 271000)
果胶是一种复杂的多糖,主要由同型半乳糖醛酸聚糖(homogalacturonans,HG)、鼠李糖半乳糖醛酸I (rhamnogalacturonans I,RGI)、鼠李糖半乳糖醛酸II (rhamnogalacturonans II,RGII)的结构域组成[1]。果胶可以从多种植物中提取,包括苹果、梨、向日葵和柑橘类水果(果胶含量相对较高)[2],以及柔软的水果如葡萄和樱桃(果胶含量相对较少)[3]。根据酯化性质的不同,果胶通常分为高甲氧基果胶(酯化度(degree of esterification,DE)>50%)和低甲氧基果胶 (DE<50%),具有乳化、胶凝、抗氧化和增稠等多种功能特性[4]。近年,从各种水果或蔬菜的加工衍生材料中制备果胶已经成为热点。
欧李为蔷薇科樱属植物,因其含钙量高,又被称为“钙果”。由于其诱人的颜色、独特的风味及丰富的营养物质,已经被广泛加工为果酒、果醋、饮料等产品[5]。但是欧李的贮藏期较短,在生长-成熟-采收阶段,会出现不可避免的落果现象,造成经济损失;在处理加工过程中,也会产生大量的废弃物,主要包括果皮、果核和不完整果肉。因此,研究这些落果和废弃物具有较大的经济效益。目前关于欧李中果胶的开发、结构及乳化性质的报道较少,本实验旨在寻找一种果胶的新来源,为扩大欧李的利用提供理论基础。
本实验采用常规热酸法从欧李落果及加工废弃物中提取果胶,测试果胶的理化特性、表观结构、傅里叶变换红外光谱、Zeta电位、单糖组成、结晶性质。并以市售苹果果胶作为对比,比较2 种果胶的乳化指数、乳化能力和乳化稳定性,并测试2 种果胶乳液贮存期间的液滴粒径和显微结构。以期为欧李果胶(Cerasus humilis fruit pectin,CSP)作为乳化剂提供新的思路。
1 材料与方法
1.1 材料与试剂
商品苹果果胶(commercial apple pectin,CAP) 山东齐鲁生物科技公司;欧李落果及加工废弃物 山东云农集团;鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸及胆固醇 标准品 上海叶源生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
GCMS-QP 2010气相色谱-质谱联用仪 日本岛津公司; VERTEX 70傅里变换叶红外光谱仪、D8 ADVANCEX射线衍射仪 德国Bruker公司;SpectraMax M5多功能酶标仪 丹麦BioPorto公司;IX73荧光倒置显微镜 日本 奥林巴斯公司;Nano S90激光粒度分析仪 美国Beckman Coulter公司;AR2000ex流变仪 美国赛默飞公司;Supra 55扫描电子显微镜 德国Zeiss公司;IKA T18高速均质机 德国IKA公司;SCIENTA-10N冷冻冻干机 宁波新芝生物科技;ICPMS7800电感耦合等离子体发射光谱仪 美国安捷伦公司;TGL-20b R高速台式冷冻离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 果胶提取
欧李落果及加工废弃物,除去落果及废弃物中的果核,冷冻干燥机内干燥48 h,粉碎,过60 目,贮存于干燥器。参考Jiang Yang等[6]方法,并略作修改。以料液比1∶10(g/mL)加入95%乙醇溶液,加热至沸腾15 min。待其自然冷却,适量无水乙醇洗涤3 次,最后用丙酮洗涤1 次得醇不溶性固体(alcohol insoluble solids,AIS)。
以料液比1∶20(g/mL)将AIS与蒸馏水混合,用2 mol/L柠檬酸溶液将混合液pH值调节至2,置于90 ℃水浴120 min,恒定搅拌500 r/min。所得上清液4 ℃醇沉过夜,得粗果胶。粗果胶用无水乙醇洗涤2 次,用3.5 kDa透析袋处理48 h以去除杂质,最后通过冷冻干燥得纯化果胶。
1.3.2 理化性质测定
蛋白质含量测定采用Bradford[7]的方法;灰分和水分含量采用Zouambia等[8]的方法。干燥减量采用直接干燥法[9]。
将适量的果胶与2.0 mL四氢呋喃充分混合,超声浴中处理1 h,用0.45 µm微孔膜过滤,采用福林-酚比色法测定其总多酚含量[10]。均一式3 份,重复3 次进行测试。
1.3.3 金属元素检测
利用电感耦合等离子体发射光谱仪检测CAP和CSP中金属元素组成,采用外校准法和内标法校正仪器,对Ca、Zn、Mg和Pb等元素进行定量分析。
1.3.4 半乳糖醛酸含量测定
采用Lin Zhuangsheng等[11]的方法并作适当修改。用酶标仪在波长525 nm处测定吸光度,以D-半乳糖醛酸为标准品作标准曲线用以测定半乳糖醛酸含量。一式3 份,重复3 次进行测试。
1.3.5 扫描电镜分析
充分水合的CSP和CAP溶液(20 g/L)冷冻干燥以获得果胶,将果胶置于双面胶带上并涂薄金层,用3.00 kV的加速电压于扫描电子显微镜拍摄样品的形貌特征,放大倍数为1 000。
1.3.6 傅里叶变换红外光谱与DE分析
1 mg果胶与100 mg KBr混合并充分研磨压制为薄片,于4 000~400 cm-1进行64 次扫描,分辨率为4 cm-1, 经去噪和基线校正后得到吸收光谱。并利用傅里叶变换红外光谱计算果胶酯化度[11],即根据1 740 cm-1处峰面积与1 740、1 630 cm-1处峰面积之和的比进行计算[12]。
1.3.7 X射线衍射分析
果胶样品在10°~60°衍射角(2θ)范围内扫描,Cu-K-α辐射电压为40 kV,电流为40 mA。
1.3.8 流变学性质
配制20 g/L的CSP和CAP溶液,充分均匀后过夜使其完全水合。剪切速率为0.01~100 s-1,使用流变仪测定CSP和CAP的表观黏度。
1.3.9 单糖组成分析
取2 mg果胶样品至安培瓶,加入1 mL 2 mol/L三氟乙酸溶液,封管,120 ℃酸解90 min,挥干三氟乙酸。残基加入2 mL双蒸水、100 mg硼氢化钠还原,加入冰醋酸中和,浓缩,烘干,加入1 mL乙酸酐乙酰化,100 ℃反应1 h,冷却。加入3 mL甲苯,减压浓缩蒸干,重复4~5 次,以除去多余的醋酐。将乙酰化产物溶解于3 mL氯仿转移至分液漏斗,加少量蒸馏水,充分振荡以去除上层水溶液,重复5 次。氯仿层以适量的无水硫酸钠干燥,定容至10 mL,分析采用气相色谱-质谱联用仪测定乙酰化产物样品。
气相色谱-质谱条件:RXI-5 SIL MS色谱柱(30 m×0.25 m,0.25 mm);升温程序:起始温度120 ℃,以3 ℃/min升温至250 ℃,保持5 min;进样口温度250 ℃,检测器温度250 ℃,载气为氦气,流速 1 mL/min。标准品顺序为鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。
1.3.10 乳液制备
按照Schmidt等[13]的方法制备乳液。将完全水合的果胶溶液(10 mL,0.5%、1.0%、1.5%、2.0%)与等量的玉米胚芽油混合,使用高速均质机14 000 r/min匀浆2 min以获得乳状液。
1.3.11 乳化性质及稳定性
乳化指数按照Ahsan等[14]的方法进行测定,记录30 d内乳状液高度变化。乳化能力及乳化稳定性按照 Bayar等[15]的方法进行测定,将乳状液4 500 r/min离心5 min,测量乳液体积,之后80 ℃恒温水浴30 min,4 500 r/min离心5 min,测量剩余乳液体积。分别按下式计算:
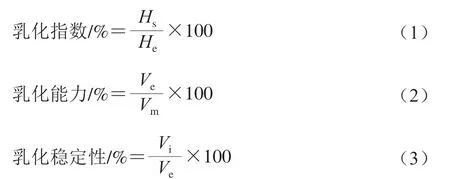
式中:Hs为贮存1~30 d后测得上清液层高度/mL;He为整个乳液系统高度/mL;Vm为乳液的初始体积/mL;Ve为第1次离心后的乳液体积/mL;Vi为80 ℃贮存30 min后剩余的乳化层体积/mL。
1.3.12 流变学分析
为比较CAP和CSP的乳化能力,使用流变仪测试乳状液流变学性质,在25 ℃进行稳定剪切,剪切速率在0.01~100 s-1之间。
1.3.13 液滴粒径和显微镜结构分析
采用激光粒度分析仪测量乳状液的液滴粒径分布,水和乳液的折射率设定为1.470和1.330。采用荧光倒置显微镜观察乳状液微观结构。
1.4 数据统计与分析
2 结果与分析
2.1 理化性质
本实验采用1.3.1节方法提取CSP,并与CAP进行对比。如表1所示,CSP和CAP的半乳糖醛酸质量分数、灰分质量分数和干燥减量分别为70.42%/75.92%、1.25%/5.03%和3.43%/10.09%,均未检出Pb元素,符合GB 25533—2010《果胶》的标准。CSP的蛋白质和总多酚含量明显高于CAP(P<0.05),而灰分低于CAP (P<0.05);CSP中Ca、Zn和Mg元素含量均高于CAP,这或许能为CSP提供更多良好的性质(凝胶性和乳化性)[16]; 通过傅里叶变换红外光谱分析得CSP和CAP的DE,分别为52.04%(>50%)和40.72%(<50%),分别属于高甲氧基果胶和低甲氧基果胶,这与果胶的来源及提取方式有关[17]。果胶结构主要为D-半乳糖醛酸单元组成的线性链,并具有D-半乳糖和L-阿拉伯糖侧链。CSP和CAP中性单糖含量顺序为阿拉伯糖>半乳糖>鼠李糖> 葡萄糖/木糖(CAP)>木糖/葡萄糖(CAP),其中阿拉伯糖和半乳糖是CSP和CAP中主要中性单糖,少量的葡萄糖可能来自提取过程中残留的可溶性糖或非果胶多糖中的葡萄糖聚合物[18]。综合分析,CSP的组成与 Hosseini等[19]提取的樱桃果胶相似,且含有较少的其他多糖,如纤维素。
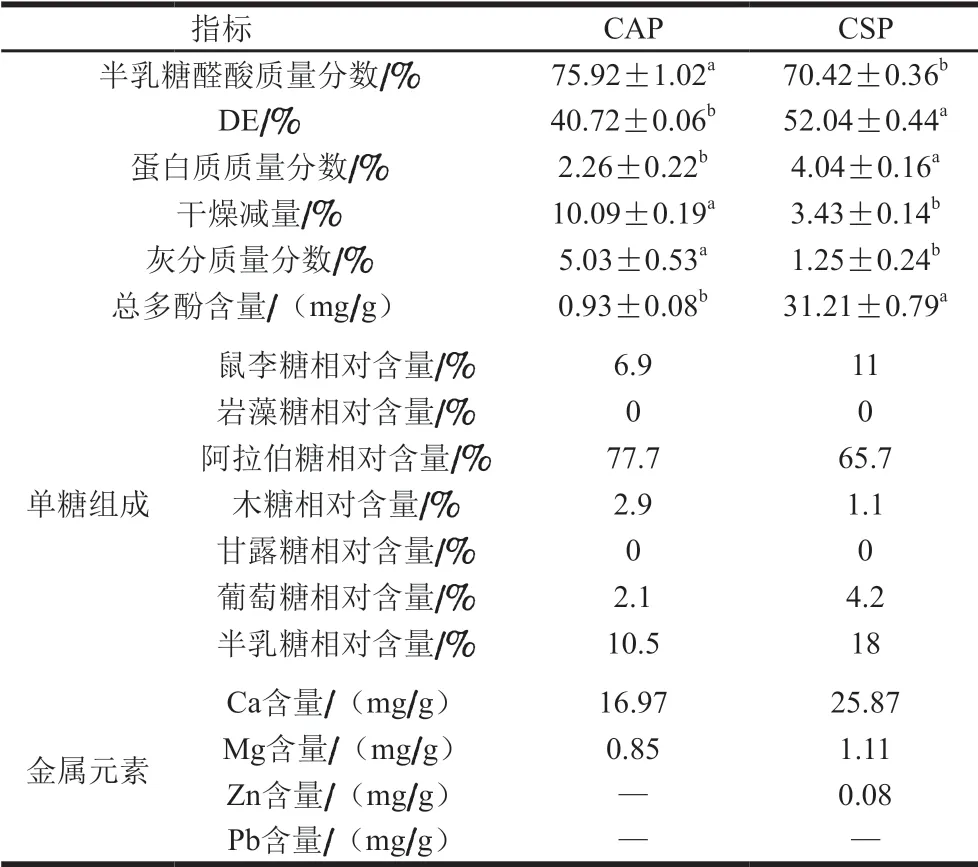
表1 CAP和CSP的理化指标Table 1 Physiochemical indexes of CSP and CAP
2.2 扫描电镜结果
如图1所示,CAP呈现为柔软且粗糙的絮凝团结构,而CSP呈光滑、连续和卷曲的片状或丝状结构,这些片状结构含有少量的分散小颗粒。这与火龙果[17]、马铃薯[18]和柚子皮[20]中所提果胶微观结构相似。相比CAP,CSP有更多的线性结构和分支,已有研究证明,果胶的线性结构和分支与其发挥乳化性能有着密切关联[21]。

图1 CSP(A)和CAP(B)的扫描电镜Fig. 1 SEM images of CSP (A) and CAP (B)
2.3 傅里叶变换红外光谱结果
如图2所示,3 420 cm-1附近的强峰是分子间和分子内氢键引起的O—H伸缩振动,2 935 cm-1附近的吸收峰是由果胶中C—H伸缩引起的,包括CH、CH2和CH3的弯曲振动,是多糖化合物的典型结构[22]。 1 740 cm-1和1 629 cm-1处的峰分别代表酯化羧基 (—COOR)和游离羧基(—COO-),可以计算出CAP和CSP的DE,分别为40.72%和52.04%。1 500 cm-1以下的中等吸收强度的峰通常被认为果胶的“指纹”域,1 105 cm-1和1 015 cm-1处的吸收峰代表C—C、C—O、C—CH和OCH的振动[23],反映了果胶中HG含量,根据峰面积可以看出,CSP中HG含量大于CAP,证明CSP有更长的骨干结构[24]。
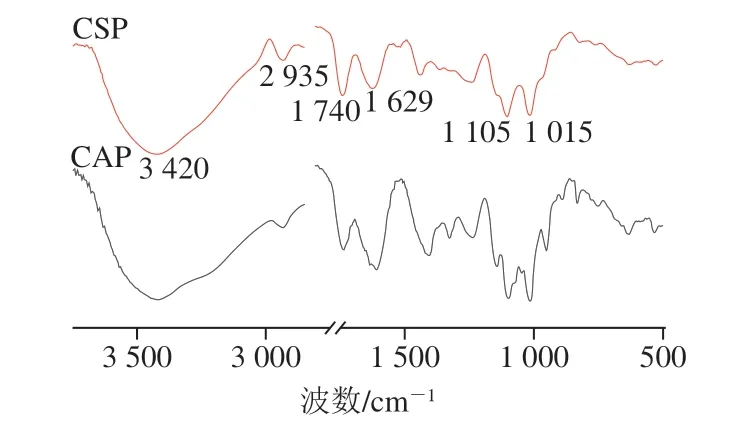
图2 果胶样品傅里叶变换红外光谱图Fig. 2 FTIR spectra of CSP and CAP
2.4 X射线衍分析
果胶的结晶度通常可以由X射线衍射谱图中尖锐和宽泛的衍射峰进行确定,这些峰代表果胶中大量羧基的系统性多半乳糖醛酸结构[25]。如图3所示,结果证实了CAP和CSP的无定形性质。这与樱桃[19]、茄子[26]和开心果[27]中提取的果胶性质相似。果胶结晶性质的差异与其性质、来源及提取方法有较大关系。
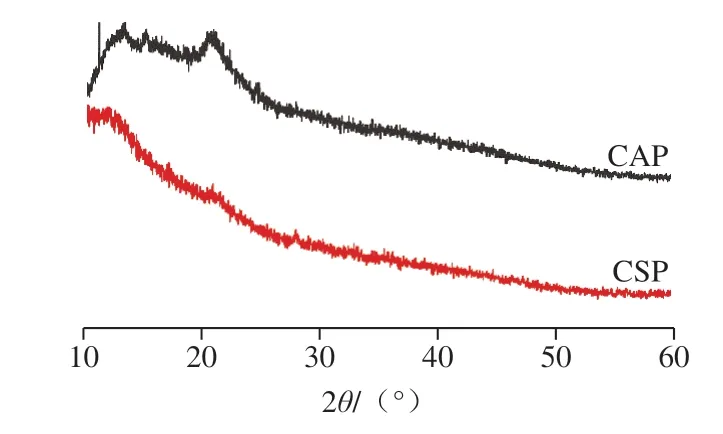
图3 果胶的X射线衍射谱图Fig. 3 XRD spectra of CSP and CAP
2.5 Zeta电位
果胶是一种富含半乳糖醛酸的酸性多糖,较高的pH值会引起羧基的解离,导致负Zeta电位降低。如图4所示,在pH 3~5时,果胶的负Zeta电位均随着pH值升高而降低,在pH 5~7范围内则保持相对稳定。在所有pH值条件下,CSP的负Zeta电位均大于CAP,测试过程中CAP可能发生了质子化反应,导致部分带负电羧基的缺少,从而表现出较高的负电位值[28]。已有研究证明,果胶中负电荷数量越多,其分散性和稳定性质越好[29],这与果胶发挥较好的乳化性能有着密切关联。
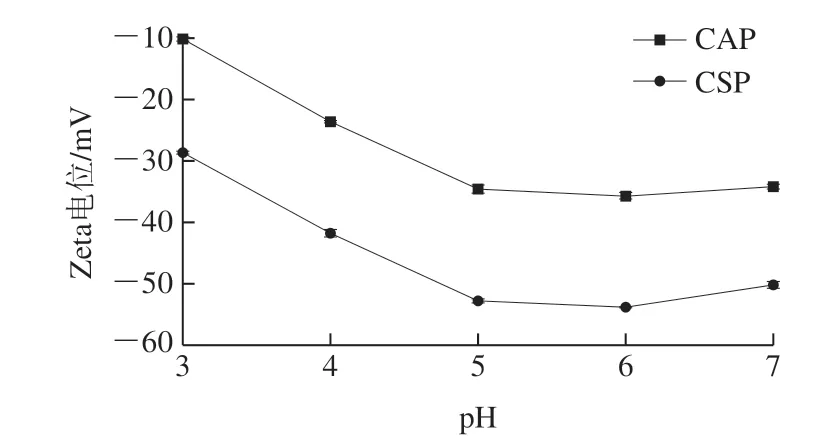
图4 果胶的Zeta电位趋势图Fig. 4 Zeta potential profiles of CSP and CAP
2.6 果胶黏度
如图5所示,2 种果胶表现出剪切变稀的性质,为假塑性非牛顿流体。与CAP对比,CSP有着更高的黏度和更强的抗剪切能力。黏度较高的CSP能够降低乳状液的流动性,并阻碍了液滴的移动或聚集,从而提高了乳液贮存稳定性[30]。
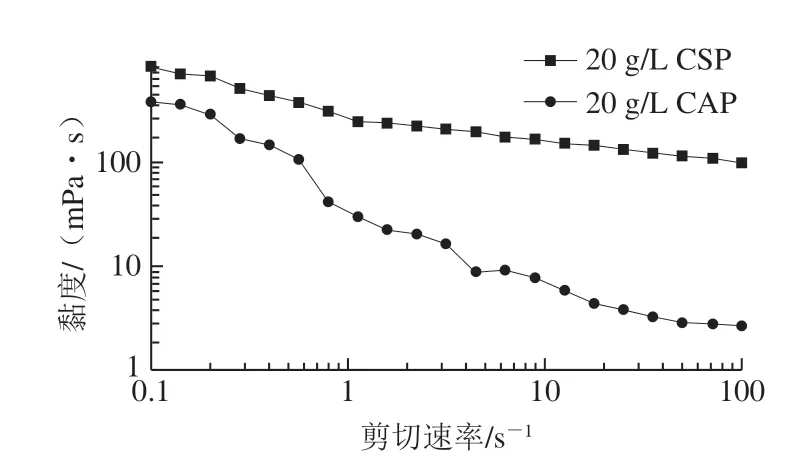
图5 果胶的流变特性Fig. 5 Rheological properties of CSP and CAP
2.7 乳液性质
2.7.1 外观、显微结构观察和粒径分析
分别制备不同质量分数(0.5%、1.0%、1.5%、2.0%)CAP和CSP乳液,在4 ℃环境中贮存30 d,并用数码相机记录配制1 h和30 d后的乳液外观形态,用以观察乳液物理稳定性(图6)。可以看出,放置1 h后,不同质量分数的CAP乳液均立即发生相分离,30 d后乳相高度变化不大,下层清澈,分离明显,发现破乳,且 CAP-1.0%、CAP-1.5%和CAP-2.0%乳相高度相似,说明当CAP质量分数大于1.0%时,增加CAP质量分数不能有效改善乳液的稳定性。CSP乳液在1 h后无明显相分离,30 d后,CSP-0.5%分层明显,CSP-1.0%有少量的相沉淀,分层不明显,CSP-1.5%和CSP-2.0%几乎未观察到相的分离,在整个实验过程中保持了较好的均匀性和稳定性。这些现象直观的表明了CSP的乳化性质和稳定性明显好于CAP。

图6 不同质量分数CSP、CAP乳液外观形态Fig. 6 Appearance of emulsions stabilized by CSP or CAP at different concentrations
如图7所示,在果胶质量分数0.5%~2.0%范围内,乳液稳定性与果胶浓度呈正相关。相比于CSP,所有CAP乳液均发生了不同程度的絮凝和破乳,导致乳液液滴粒径增加,加大了体系不稳定性风险,说明市售苹果果胶乳化性能较差。在较低质量分数条件下,CAP体系中能够覆盖油滴表面的可用颗粒较少,不足以完全稳定油滴,从而形成较大的液滴,并发生破乳、絮凝等现象。CSP体系较为稳定,可能是CSP赋予了液滴间更大的静电斥力,从而使界面上的吸附更有效,这与本实验Zeta电位数据一致(图4)。贮存30 d后的乳液液滴粒径分布如图8所示,液滴粒径分布趋势与相应乳液稳定性和显微镜观察一致,随着果胶含量增加,液滴粒径减小,CSP乳液平均粒径大于相同质量分数的CAP。一般认为,减小液滴粒径可以增加连续相黏度,从而获得较高的乳液稳定性[31-32]。
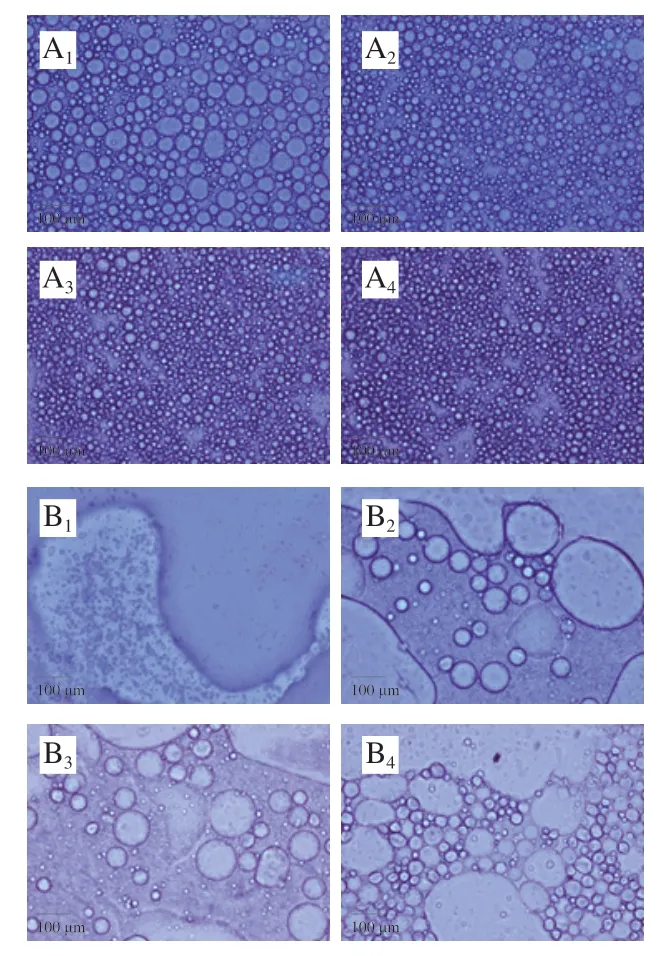
图7 不同质量分数CSP、CAP放置30 d后乳液的显微结构Fig. 7 Microstructures of emulsions stabilized by CSP or CAP at different concentrations after 30 days of storage
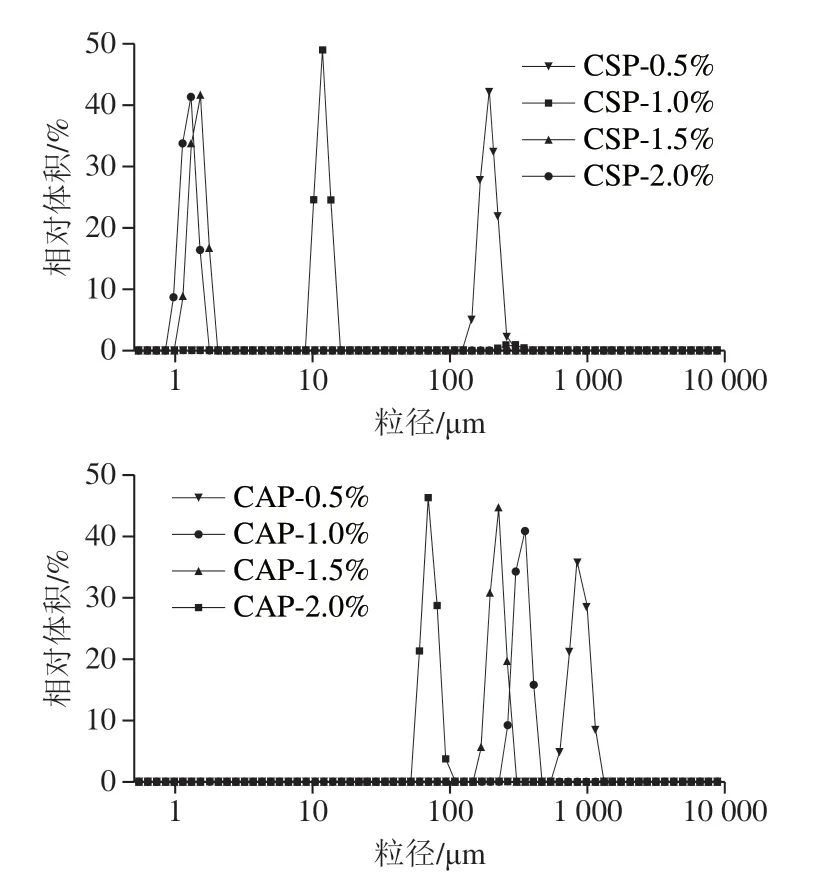
图8 CSP和CAP的液滴粒径分布Fig. 8 Droplet size distribution of emulsions stabilized by CSP or CAP at different concentrations
2.7.2 乳液乳化指数、乳化能力和乳化稳定性结果
如图9A所示,乳化指数在24 h内变化较大,之后的乳化指数几乎保持不变,且相同质量分数CSP的乳化指数值下降速度明显小于CAP,这与Jiang Yang等[6]的报道结果相似。乳液的乳化能力和乳化稳定性数值如图9B、C 所示,CSP乳液的乳化能力和乳化稳定性明显高于同等质量分数的CAP,并且随着果胶质量分数的增加,差距逐渐增大,这与乳化指数结果一致。综合数据分析,欧李次级果中提取的果胶乳化性能明显高于市售苹果果胶。这可能与其体系的黏度、持水能力和空间构象有关[33]。 某些金属离子(Ca2+、Mg2+、Zn2+等)的存在也会对果胶乳液体系产生积极的影响[30]。另外,与CAP相比,CSP总多酚含量较高。已有研究表明,多酚可以通过酯键与阿拉伯糖和半乳糖相连[34],CSP中的羧基可以通过氢键和疏水作用与多酚中的酚羟基发生分子间交联,从而形成连续相中非均相的聚集网络[35],这可能也是其优良乳化性能的原因之一。
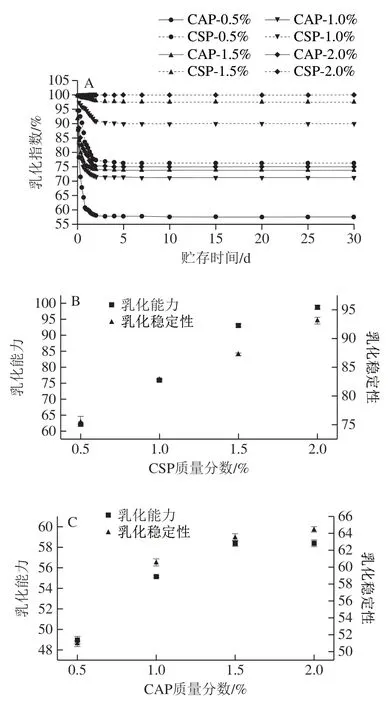
图9 不同质量分数CSP和CAP的乳化指数(A)、乳化能力和 乳化稳定性(B、C)Fig. 9 Emulsification index (A), emulsification capacity and emulsion stability (B, C) of CSP and CAP at different concentrations
2.7.3 流变学特性
如图10所示,2 种乳液在剪切速率1~100 s-1范围内均表现出剪切变稀行为,乳液黏度随着果胶质量分数的增加逐渐增大,CSP乳液的黏度均明显高于CAP,且表现出更强的抗剪切能力,这与Zhao Shaojie等[36]研究结果一致。较大剪切力可能会导致乳液内分子重排,增大果胶分子的空间位阻和摩擦力,从而导致表观黏度的 增加[37]。果胶乳液的流变学特性符合乳液黏度越大,乳化指数值越高的规律,与上述实验数据对应。
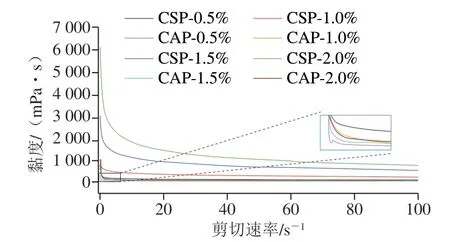
图10 CSP和CAP的流变学性质Fig. 10 Rheological properties of emulsions stabilized by CSP or CAP at different concentrations
3 结 论
本实验采用常规热酸法从欧李落果和废弃物中提取果胶,测其理化性质和结构,并对其乳化性能进行综合分析。结果表明,CSP为高甲氧基果胶,含有更多的总多酚、金属元素和蛋白质,CSP乳液在质量分数1.5%时具有较小的粒径和较高的黏度、乳化指数、乳化能力、乳化稳定性,无破乳现象,展现出较高的乳化性质。CSP的乳化性能可能与其线性结构、金属元素及多酚的交联作用有关。另外,较大的负Zeta电位值赋予了CSP更多的负电荷数量,使果胶乳液体系中分子间的静电斥力增大,一定程度上阻止了分子间的絮凝和聚集。CSP乳化性质的具体机理还需进一步研究和讨论。综上所述,CSP可以作为一种新型的乳化剂,在未来具有广阔的发展前景。
