加工方式对玉筋鱼干风味的影响
2021-11-05刘胜男刘云锋
刘胜男,刘云锋,曹 荣,3,刘 淇,
(1.中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.青岛卓越海洋集团有限公司,山东 青岛 266408;3.青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东 青岛 266235)
玉筋鱼(Ammodytes personatus)属鲈形目、玉筋鱼亚目、玉筋鱼科,俗称“面条鱼”、“沙钻”,是黄渤海地区中上层水域重要的地方性小型渔业资源[1]。马绍赛等[2]采用底网浮拖捕获鱼类的方式对胶州湾南沙水域渔业资源进行调查,发现玉筋鱼资源量占总资源量的96.5%,是2001年5—6月在该水域可形成渔汛的唯一品种。据《2020中国渔业统计年鉴》[3]报道,山东省2019年玉筋鱼年捕获量为33 776 t,占年总捕获量的38.2%。玉筋鱼营养丰富、肉鲜味美、价格低廉,多被加工成食品或冷冻品,鱼干作为其主要加工产品,多采用直接风干或加盐煮制后风干的工艺制作。区别于传统日晒干制方式,冷风干燥(cold air drying,CD)技术能提高生产效率、避免环境因素对产品品质的影响[4],现已逐步运用到食品加工过程中。加工方式对玉筋鱼干的外观、风味有较大影响,影响机理鲜见报道。
随着经济发展,消费者对食品风味有更高要求。水产品风味包括滋味、气味两部分。滋味物质多为一些小分子游离氨基酸、呈味核苷酸、有机酸、无机离子、呈味肽等。近年来,基于气相离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)技术在食品风味研究领域[5-9]得到广泛应用,该技术结合二者在分离、检测的优势,具有高分辨率、高灵敏度、操作简便等优点[10],为食品气味研究提供新的技术手段。本实验以捕捞自黄海海域的玉筋鱼为研究对象,采用 GC-IMS、高效液相色谱等技术分析不同加工方式对玉筋鱼干风味特征的影响,以期为玉筋鱼的高质化加工提供参考。
1 材料与方法
1.1 材料与试剂
实验用玉筋鱼采集自山东青岛市黄岛区积米崖,采集后迅速加冰袋置于2~6 ℃保温箱中,2 h内运回实验室,挑选形态完整、质量为(1.93±0.26)g/尾的样品,按不同工艺处理后待用。
17 种必需氨基酸混样标准品(脯氨酸除外) 西格玛奥德里奇(上海)贸易有限公司;腺苷酸(adenosine 5’-monophosphate disodium salt,5’-AMP)、肌苷酸(inosine 5’-monophosphate disodium salt,5’-IMP)、鸟苷酸(guanosine 5’-monophosphate disodium salt, 5’-GMP)(纯度均大于99%) 北京索莱宝科技有限 公司;乙腈(色谱纯) 德国默克股份两合公司;其他常规试剂(分析纯) 中国医药集团有限公司。
1.2 仪器与设备
PEN-3型电子鼻 德国Airsense公司;GC-IMS仪 德国G.A.S.公司;PM1000高效液相色谱仪 日立仪器(大连)有限公司;LA8080型高速氨基酸自动分析仪 日本株式会社日立高新技术公司;BR4I离心机 美国Thermo公司;冷风干燥机 大连中通食品机械有限 公司;C18色谱柱(250 mm×4.6 mm,5 μm) 沃特世科技(上海)有限公司。
1.3 方法
1.3.1 加工工艺
将样品分为3 组,一组为加盐煮后冷风干燥(boiling in salt solution followed by cold air drying,SCC)组,样品于3 g/100 mL食盐水中煮开锅后继续煮30 s,盛出放凉,35 ℃ CD工艺处理20 h;一组为CD组,将样品铺平后,在35 ℃冷风干制20 h;另设鲜鱼为对照组。
1.3.2 挥发性成分分析
1.3.2.1 电子鼻分析
称取0.5 g样品置于50 mL顶空瓶中,加盖密封后,用电子鼻进行检测。采用Winmuster软件进行数据采集与处理,并进行主成分分析(principal component analysis,PCA)。
1.3.2.2 GC-IMS分析
称取0.1 g待测样品于20 mL顶空进样瓶中,30 ℃富集10 min后上机检测,通过软件内置的NIST数据库和IMS数据库对物质进行定性分析,用设备自带LAV软件的Gallery Plot功能绘制样品的挥发性成分谱图。
GC条件:MXT-WAX极性柱(15.00 m×0.53 mm,1.00 μm);色谱柱温度40 ℃;载气为N2(纯 度≥99.999%);载气流速程序:初始流速2 mL/min,瞬时增速至5 mL/min,保持2 min;瞬时增速至15 mL/min,保持8 min;瞬时增速至50 mL/min,保持5 min;瞬时增速至100 mL/min,保持5 min。
IMS条件:漂移管温度45 ℃;漂移气N2(纯度≥ 99.999%)。
1.3.3 滋味成分分析
1.3.3.1 呈味核苷酸的测定
按刘胜男[11]的方法进行测定,色谱柱为C18(250.0 mm× 4.6 mm,5.0 μm)柱。
1.3.3.2 游离氨基酸含量的测定
取适量样品于10 mL离心管中,加入0.02 mol/L盐酸溶液定容,再分别加入5 mL甲醇、5 mL水,对C18柱进行活化,加入2.5 mL样品,再加1.5 mL 0.02 mol/L盐酸溶液,过柱后的样品用0.02 mol/L盐酸溶液定容到5 mL,过0.45 μm滤膜后,参照GB 5009.124—2016《食品中氨基酸的测定》[12],采用氨基酸自动分析仪进行测定。
1.3.3.3 滋味活性值(taste activity value,TAV)的计算
TAV按式(1)计算[13]:

式中:C1为样品中某呈味物质的含量/(mg/100 g);T1为该物质的阈值/(mg/100 g)。
1.3.3.4 味精当量(equivalent umami concentration,EUC)的计算
EUC按式(2)计算[13]:
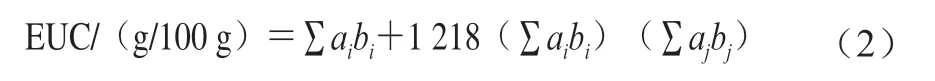
式中:1 218为协同作用常数;ai为鲜味氨基酸含量/(g/100 g);bi为鲜味氨基酸相对于谷氨酸单钠(monosodium glutamate,MSG)的鲜味系数(bGlu=1、bAsp=0.077);aj为呈味核苷酸含量/(g/100 g);bj为呈味核苷酸相对于IMP的鲜味系数(bAMP=0.18、bIMP=1、bGMP=2.3)。
1.4 数据处理
2 结果与分析
2.1 不同工艺制作的玉筋鱼干气味特征分析
2.1.1 PCA结果
PCA为若干综合指标的统计方法[14]。通过对10 个传感器的响应值进行PCA,结果如图1所示,其中PC1、PC2的贡献率分别为95.91%、3.38%,总贡献率为99.29%,基本包含所有气味信息,且3 组样品检测信号的特征区域间无重合,分离度较高,说明PCA能有效区分鲜鱼、不同工艺加工的玉筋鱼干气味。
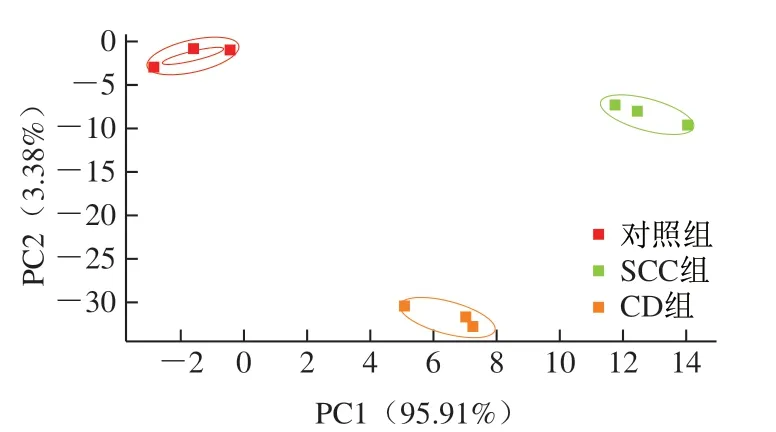
图1 不同样品的电子鼻分析结果Fig. 1 PCA plot of electronic nose data of different samples
2.1.2 GC-IMS分析结果
采用GC-IMS技术从3 组样品中鉴别出醇类、醛类、酮类、酯类、烃类、芳香族等共68 种挥发性成分。如图2所示,有9 种成分以单体(dimer,D)、二聚体(monomer,M)的形式共存。因GC-IMS Library数据库不完善,有17 种成分未能定性。图中每一竖列代表一种样品含有的挥发性有机物(volatile organic compounds,VOCs),每一横行代表同一VOCs在不同样品的信号峰,颜色代表各种气味物质含量差异,蓝色越深,表示相对浓度越低;红色越深,表示相对浓度越高。
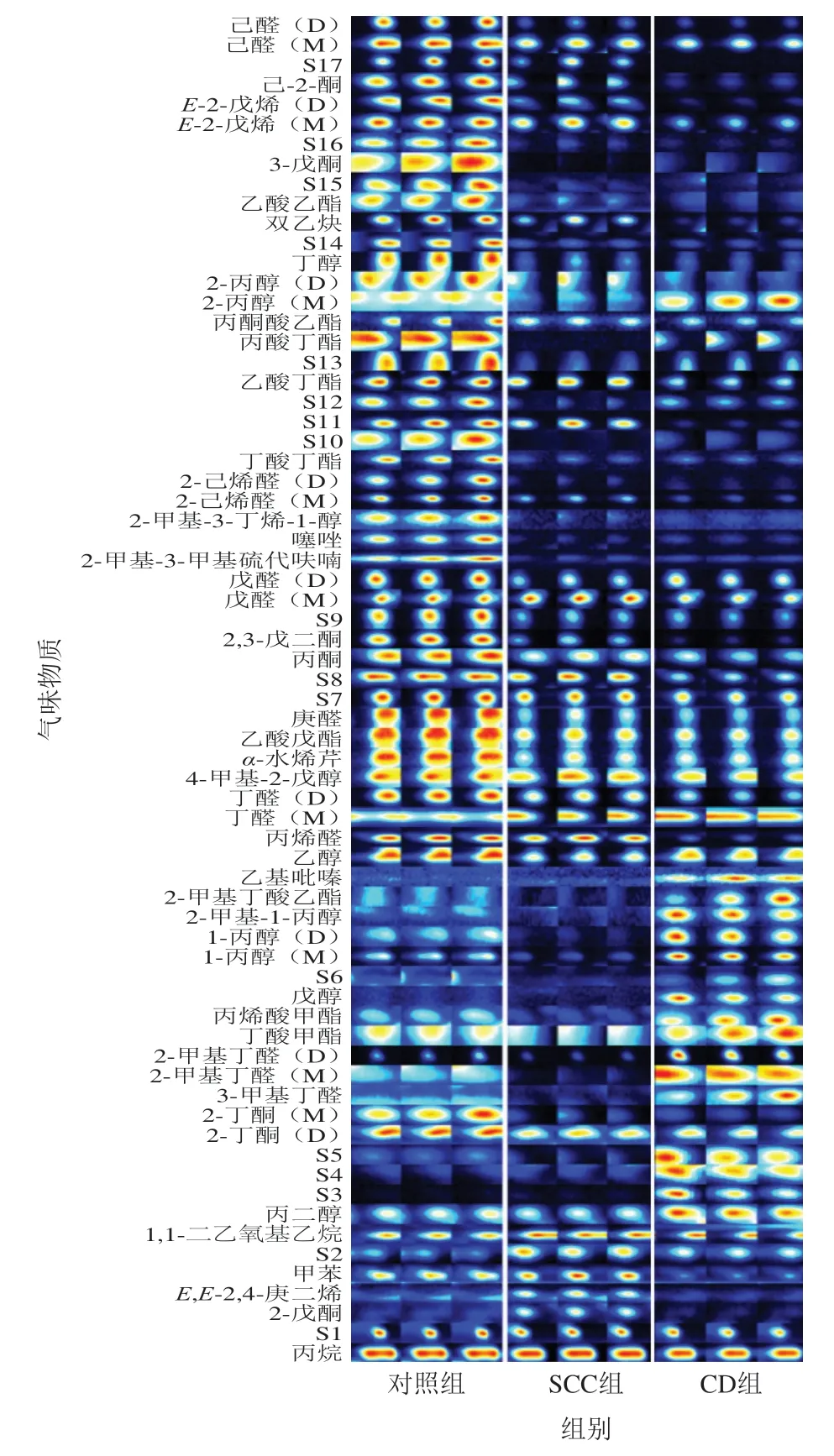
图2 不同样品的气味指纹图谱Fig. 2 GC-IMS fingerprints of the major volatile components in three samples
由图2可知,SCC组、CD组、对照组的气味成分有显著差异,可明显区分加工前后3 种样品的VOCs指纹图谱。对照组VOCs种类最多,其次是CD组,SCC组的VOCs种类最少。加工后SCC组中2-戊酮、E,E-2,4-庚二烯、甲苯、1,1-二乙氧基乙烷、丁醛(M)含量明显增加,2-丁酮(D)、2-丁酮(M)、3-甲基丁醛、2-甲基丁醛(M)、丁酸甲酯、丙烯酸甲酯、1-丙醇(D)、1-丙醇(M)、2-甲基-1-丙醇、2-甲基丁酸乙酯、丁醛(D)、4-甲基-2-戊醇、α-水烯芹、乙酸戊酯、庚醛、丙酮、2,3-戊二酮、2-丙醇(M)、己-2-酮、己醛(D)、己醛(M)等含量明显减少。
CD组丙二醇、3-甲基丁醛、2-甲基丁醛(D)、 2-甲基丁醛(M)、丁酸甲酯、丙烯酸甲酯、戊醇、 1-丙醇(D)、1-丙醇(M)、2-甲基-1-丙醇、2-甲基丁酸乙酯、乙基吡嗪、丁醛(M)、2-丙醇(M)的含量明显增加。丙烯醛、甲苯、2-丁酮(D)、2-丁酮(M)、丁醛(D)、4-甲基-2-戊醇、α-水烯芹、戊酸乙酯、庚醛、丙酮、2,3-戊二酮、戊醛(D)、戊醛(M)、2-甲基-3-甲基硫代呋喃、噻唑、2-甲基-3-丁烯-1-醇、2-己烯醛(D)、2-己烯醛(M)、丁酸丁酯、乙酸丁酯、丙酸丁酯、丙酮酸乙酯、2-丙醇(D)、丁醇、双乙炔、乙酸乙酯、3-戊酮、E-2-戊烯(D)、戊烯(M)、己-2-酮、己醛(D)、己醛(M)、E-2-戊烯(D)、E-2-戊烯(M)等含量明显减少。
由此可知,加工后,鲜鱼中的大部分挥发性物质含量明显降低或消失,CD组比SCC组生成更多种挥发性物质,不同加工方式形成自己的风味特征。
由图2可知,SCC组中相对浓度较高的物质以醛类、酮类、烃类和醇类为主,CD组中相对含量较高的物质以醛类、醇类和酯类为主。有研究[15-17]指出醛类物质阈值较低,又有叠加效应,对食品风味的形成有重要作用。酮类物质的阈值较高,但对鱼肉气味的贡献相对较小[18]。碳水化合物在加热、贮藏、烟熏等条件可形成低碳链的醛类,此过程是产生腥臭味等不愉快气味的潜在因素[19]。 烷烃类化合物、饱和醇类化合物由于阈值较高,对水产品整体风味的贡献不大[20-21]。酯类化合物可能是醇类、酸类经酯化反应的产物,其多呈芳香味,以油香气息占主导[22]。由图2可知,SCC组、CD组中戊醛、庚醛的相对含量均较高,戊醛(阈值20.0 μg/kg)可产生果香、面包香;庚醛(阈值3.0 μg/kg)有类似坚果的香气[23-24];CD组中还生成较多3-甲基丁醛(阈值1.2 μg/kg),其主要是Strecker降解的产物,可产生麦芽味和花香味[25]。戊醛、庚醛、3-甲基丁醛的阈值均较低,相对含量较高,推测其对玉筋鱼干风味的形成有较大贡献。因为CD组生成较多3-甲基丁醛,所以3-甲基丁醛可能为CD、SCC工艺产生风味差异的关键物质,而检测到大部分其他物质因其阈值过高或相对含量较低,对鱼干整体风味的影响可以忽略。王珏等[26]的研究报道也认为脂肪氧化产生的醛类物质一定程度上决定了鱼干的风味。
2.2 不同工艺加工的玉筋鱼干滋味特征分析
2.2.1 呈味核苷酸含量分析结果
呈味核苷酸是评价食品滋味的重要指标,食品中的呈味核苷酸主要指5’-单磷酸呈味核苷酸二钠盐(以 5’-IMP、5’-GMP、5’-AMP为主),这些呈味核苷酸可冲淡不良滋味,增强良好滋味[27]。根据呈味核苷酸的测定结果(表1)可知,3 种样品的主要呈味核苷酸含量关系为5’-IMP>5’-AMP>5’-GMP,其与脊尾白虾[13]、 条斑紫菜[28]、咸鲅鱼[10]等水产品的呈味核苷酸组成相似。玉筋鱼干中5’-IMP含量有明显积累,表明ATP降解途径可能以ATP→ADP→AMP→IMP→HxR→Hx为主。与对照组相比,加工后样品的5’-IMP含量均显著降低, 5’-AMP含量均显著升高,表明ATP降解过程中,5’-AMP的分解速度低于生成速度,5’-IMP的分解速度大于生成速度。吴依蒙等[29]发现,ATP降解主要来源于外源微生物产生的酶与内源酶的叠加作用。SCC组经过煮制工艺,内源酶活性基本消失,大部分外源微生物被抑制或灭杀,因此CD组的5’-AMP能更多地被降解为5’-IMP,其显著高于SCC组(P<0.05)。氯化钠能促进三磷酸腺苷的降解[30],因此SCC组5’-AMP含量显著高于对照组和CD组。
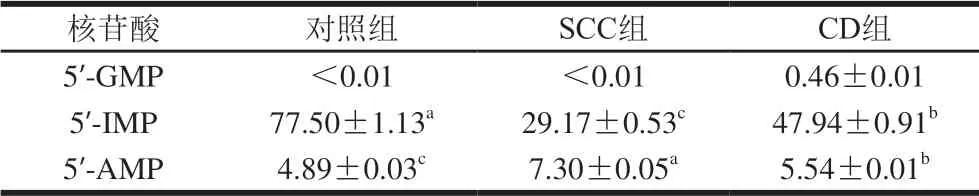
表1 不同样品的呈味核苷酸含量Table 1 Contents of nucleotide-related compounds in different samples mg/100 g
2.2.2 游离氨基酸含量的分析结果
由表2可知,不同加工方式影响玉筋鱼干游离氨基酸的种类和含量,对照组中共检测12 种游离氨基酸(Try除外,以下同),总含量为579.2 mg/100 g。SCC组中检出15 种游离氨基酸,其总含量为430.2 mg/100 g。CD组检出17 种游离氨基酸,其总量为1 509.4 mg/100 g。鱼干加工时,水解蛋白质的过程促进游离氨基酸的生成, 熊添[31]、陈惠[32]等发行热加工处理后的鱼肌肉中游离氨基酸含量较处理前增加,但SCC组中的游离氨基酸含量低于对照组,其原因可能为游离氨基酸为水溶性成分,在煮制过程中游离氨基酸溶出至煮制液中,导致SCC组中的游离氨基酸含量显著降低。
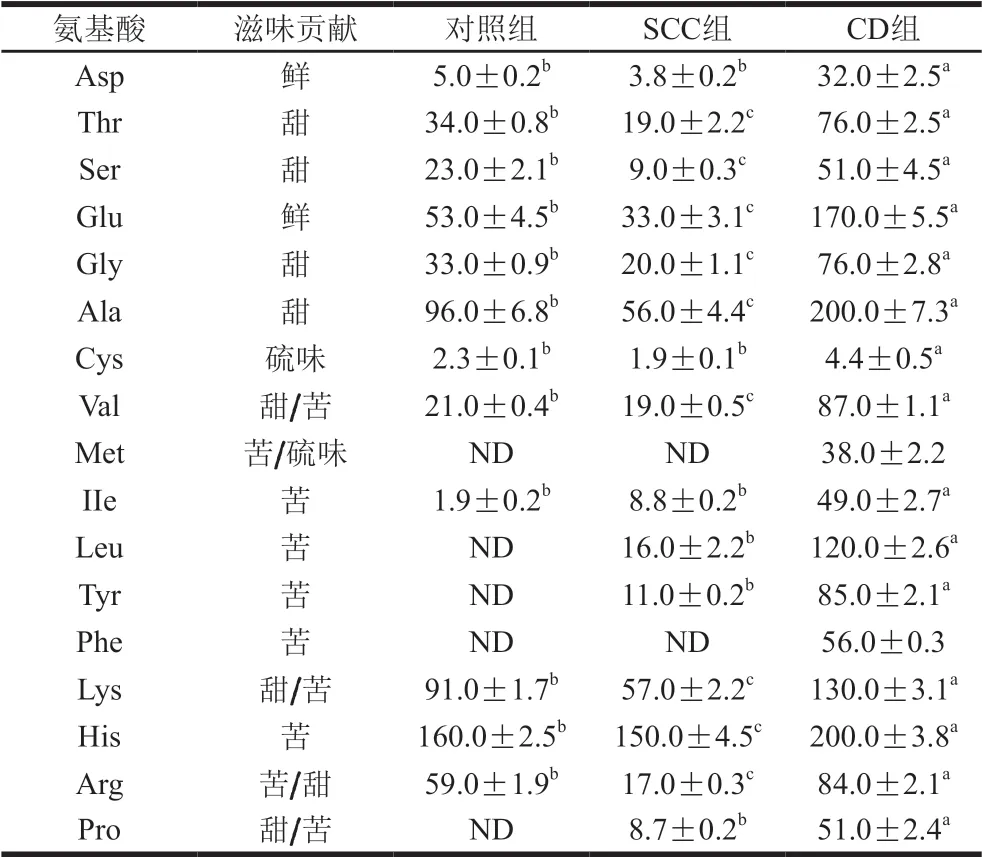
表2 3 种样品的游离氨基酸含量Table 2 Free amino acid composition of three dried fish samples mg/100 g
SCC组、CD组玉筋鱼干的鲜味氨基酸分别占游离氨基酸总含量的8.55%、13.38%,其中Glu占比较大,且Glu和5’-IMP可协同作用增加产品的鲜味[33];SCC组和CD组甜味氨基酸分别占游离氨基酸总含量的47.6%~48.0%、49.9%~50.1%,2 组甜味氨基酸含量均低于对照组(61.5%~61.8%),其中Ala、Lys是主要的甜味氨基酸,且CD组所有甜味氨基酸含量均显著 (P<0.05)高于SCC组、对照组。Park等[34]发现Ala对去除食品苦味有一定作用;苦味氨基酸占SCC组、CD组游离氨基酸总含量分别为65.9%~67.9%、59.2%~60.1%,其中His、Lys为占比最高的2 种氨基酸,加工后SCC组和CD组样品均生成Leu、Tyr,CD组还生成Met、Phe,Leu、Tyr、Met、Phe均对生成玉筋鱼干苦味有一定影响。虽然CD组苦味氨基酸占总氨基酸质量的比例低于SCC组,但CD组的苦味氨基酸总含量显著高于SCC组。感官评价发现CD组苦味明显强于SCC组,且主要集中在腹部(内脏部位),其原因可能为CD工艺制作的玉筋鱼干腹部含有更多苦味氨基酸或其他苦味物质,而煮制后这些苦味成分溶出至煮制液中或转变为其他非苦味物质。
2.2.3 滋味物质的TAV分析结果
味道阈值是人类味觉可辨别的最低浓度,通常用TAV表示食品呈味强度[35]。TAV大于1表明该物质对样品味道有重要影响。
SCC组、CD组、对照组的水分质量分数分别为9.83%、12.63%、73.62%,由此计算的主要鲜味氨基酸、呈味核苷酸的TAV结果如表3所示。加工过程由于蛋白质降解,5 种滋味物质含量均增加,因此SCC组、CD组5 种呈味物质的TAV均高于对照组。SCC组、CD组鱼干的Asp、5’-AMP、5’-GMP对应的TAV均小于1, 5’-IMP的TAV均大于1;CD组Glu的TAV大于1,SCC组Glu的TAV接近1,因此加工工艺制作玉筋鱼干中的主要鲜味氨基酸为Glu,主要呈味核苷酸为5’-IMP;除5’-AMP、5’-GMP对应的TAV外,CD组Asp、Glu、 5’-IMP、对应TAV均明显高于SCC组,因此经CD工艺制作的玉筋鱼干能更好地保留产品的鲜味。

表3 不同样品的鲜味物质及其TAVTable 3 Taste-active compounds and their TAV in three dried fish samples
呈味核苷酸与鲜味氨基酸同时存在时,可协同作用而增强食品的鲜味,此协同效应用EUC表示。经计算,对照组、SCC组、CD组的EUC值分别为0.37、1.04、8.17 g/100 g,CD组EUC值显著高于SCC组,说明CD工艺制作的玉筋鱼干风味更鲜美,此结果与TAV分析结果一致。
3 结 论
不同加工方式制作的玉筋鱼干在气味方面存在显著差异。PCA、GC-IMS均能区分不同工艺制作的玉筋鱼干气味,其中CD组样品整体气味组成更丰富;由于庚醛、戊醛、3-甲基丁醛阈值更低,其相对含量较高,所以对玉筋鱼干独特风味的形成有重要影响。其中3-甲基丁醛是CD工艺风味区别于SCC工艺气味的关键物质。
通过量化加工方式生产的玉筋鱼干中游离氨基酸、呈味核苷酸含量,能更准确地对滋味特征进行评价。首先,SCC组经过煮制工艺,内源酶活性基本消失,大部分外源微生物被抑制或灭杀,因此CD组的5’-AMP能更多地被降解为5’-IMP。氯化钠能促进三磷酸腺苷的降解,因此CD组的5’-AMP含量低于SCC组,5’-IMP含量高于SCC组。加工方式影响玉筋鱼干游离氨基酸的种类、含量。加工后,因发生蛋白质水解,游离氨基酸的种类、含量均增加,但因游离氨基酸为水溶性物质,SCC组生成的游离氨基酸在煮制时渗到煮制液中,因此游离氨基酸总含量关系为CD组>对照组>SCC组。CD组鲜味、甜味氨基酸含量均显著高于SCC组。通过TAV、EUC分析可知,CD、SCC工艺制作的玉筋鱼干中的主要呈味物质均为Glu、5’-IMP,CD工艺制作的玉筋鱼干的滋味优于SCC工艺制作的玉筋鱼干。
