荧光微球免疫层析方法定量检测水产品中 4 种硝基呋喃代谢物
2021-11-05张万利邵静梅刘飘雪
吴 烁,张 彪,张万利,邵静梅,刘飘雪,生 威
(食品营养与安全国家重点实验室,天津科技大学食品科学与工程学院,天津 300457)
硝基呋喃类兽药是合成广谱抗菌剂,该类药物能抑制大多数革兰氏阳性菌和革兰氏阴性菌、真菌及原虫等病原体的活性,因而被广泛应用于预防和治疗疾病[1-3]。同时,硝基呋喃类药物还被应用于家禽及畜牧业、蜜蜂及水产养殖中[4],其作为饲料添加剂、生长促进剂。戴欣等[5]发现,高剂量或长期对动物使用硝基呋喃类兽药,可产生毒性作用,可诱导突变,甚至致畸、致癌。这些药物的代谢物被人体吸收后会对人体健康造成巨大危害[6-7]。 因此,各国都对硝基呋喃类兽药作出限量规定。2019年欧盟规定在可食用性食品中,硝基呋喃代谢物的最低残留限量为0.5 μg/kg[8]。农业农村部2020年1月6日发布的第250号公告,明确规定在动物饲养过程中禁止使用硝基呋喃类药物,并且在动物性食品中不得检出[9]。
硝基呋喃类药物在动物体内代谢迅速,但其代谢物1-氨基-乙内酰脲(1-aminohydantoin,AHD)、5-吗啉-3-氨基-2-恶唑烷酮(5-methylmorpholino-3-amino-2-oxazolidinone,AMOZ)、3-氨基-2-恶唑烷酮(3-amino-2-oxazolidinone,AOZ)、氨基脲(semicarbazide,SEM)与蛋白质结合,形成稳定的蛋白结合物,可在生物组织中停留高达8 周[10]。对硝基呋喃类兽药的检测主要有高效液相色谱法[11-13]、液相色谱-质谱联用法[14-15]、 液相色谱-串联质谱法[16-18]等分析方法,其具有较高的灵敏度及准确性,但是需要专业人员操作,费时费力,成本高,通常用于验证性实验。酶联免疫吸附测试(enzyme-linked immunosorbent assay,ELISA) 法[19-21]、荧光免疫分析法[22-23]、化学发光法[24-26]、免疫层析法[27-32]等免疫分析方法,依靠抗原抗体的特异性结合,具有灵敏度高、特异性好、成本低、操作简单快速等优点。特别是免疫层析法,适用于现场快速检测大量样品兽药残留,是目前最普遍应用的方法。
本研究基于抗原抗体的特异性结合作用,根据T线荧光强度(fluorescence intensity of T line,FIT)与目标物浓度间关系,建立新型荧光微球免疫层析方法(fluorescent microspheres immunochromatographic assays,FMICA),制备荧光微球抗体偶联标记物(fluorescent microspheres antibody conjugated markers,FMs-Ab)为信号探针,以期在最优实验条件借助便携式试纸条荧光读数仪,实现水产品中4 种硝基呋喃代谢物的快速定量检测。
1 材料与方法
1.1 材料与试剂
多宝鱼、虾 天津市场;呋喃妥因(nitrofurantoin,NFT)、呋喃它酮(furaltadone,FTD)、呋喃唑酮(furazolidone,FZD)、呋喃西林(nitrofurazone,NFZ)、AHD、AMOZ、AOZ、SEM、邻硝基苯甲醛(2-nitrobenzaldehyde,2-NBA)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)、AHD衍生物(NPAHD)、AMOZ衍生物(NPAMOZ)、AOZ衍生物(NPAOZ)、SEM衍生物(NPSEM)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide,EDC)、牛血清白蛋白(bovine serum albumin,BSA) 美国Sigma公司;荧光微球(fluorescent microsphere,FM) 美国Ocean Nano Tech公司;硝酸纤维素膜 美国Milllipore公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HM3035三维平面点膜喷金仪、ZQ2000微电脑自动斩切机 上海金标生物有限公司;硝酸纤维素(cellulose nitrate,NC)膜、纯水仪 美国Millipore 公司;荧光分光光度计 美国Thermo公司;Savant-100便携式荧光读数仪 天津博硕科技有限公司;ZF1-II紫外分析仪 上海嘉鹏科技有限公司;商业化ELISA 试剂盒 德国R-Biopharm AG公司。
1.3 方法
1.3.1 FMs-Ab复合物制备
取40 μL 10 mg/L荧光微球溶液于2 mL 0.02 mol/L pH 7.4磷酸缓冲液(phosphate buffer,PB)中,加入300 μg EDC和200 μg NHS,250 r/min搅拌活化2 h。置于100 mL离心管中,4 ℃、10 000 r/min离心20 min后弃去上清液,将沉淀复溶于2 mL 0.02 mol/L pH 7.4 PB中,清洗2 次。逐滴加入一定量的抗体,置于磁力搅拌器上,常温250 r/min缓慢搅拌1 h进行偶联。加入2 mg BSA,室温静置,避光反应1 h进行封闭。置于100 mL离心管中,4 ℃、10 000 r/min离心30 min后弃上清液,将沉淀复溶于400 μL 0.02 mol/L pH 7.4 PB中。得到FMs-Ab复合物,置于4 ℃避光保存。
1.3.2 荧光微球免疫层析试纸条的组装
荧光微球免疫层析试纸条结构如图1所示,将样品垫、硝酸纤维素膜和吸水纸依次粘贴在PVC胶板上,以0.5 μL/cm的喷涂量将二抗、包被原分别作为控制线 (C线)和测试线(T线)划在NC膜上,置于37 ℃干燥烘箱孵育6 h,用微电脑自动斩切机切成3.7 mm宽度的试纸条,置于密闭干燥处保存备用。
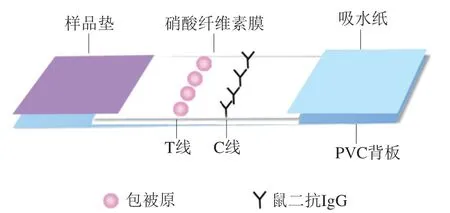
图1 荧光微球免疫层析试纸条组装Fig. 1 Schematic diagram for the assembling of fluorescent microsphere immunochromatographic test strip
1.3.3 FMICA实验条件的优化
样品缓冲液的种类、NC膜的种类、二抗、包被原的稀释倍数及FMs-Ab添加量均影响试纸检测的准确性及灵敏度。本实验选取不同pH值的PB、磷酸盐缓冲溶液(phosphate buffered saline,PBS)、3 种不同的NC膜进行试纸条检测,最终选择使试纸条C、T线FI一致且适中、荧光条带清晰、背景干扰程度较小时的实验条件为最优条件。借助便携式试纸条光读数仪测出C、T线的FI值,分别记为FIC、FIT。当添加样品缓冲液测得的 FIT/FIC(空白)接近于1,且(FIT/FIC(加标))/(FIT/FIC(空白)) 最小(抑制率最大)时为最佳二抗、包被原稀释倍数和FMs-Ab添加量。
1.3.4 FMICA方法灵敏度检测
确定好最佳抗体添加量、样品缓冲液种类、二抗和包被原稀释倍数及FMs-Ab最佳添加量条件后,用试纸条检测样品缓冲液(目标物浓度为0)和一系列浓度梯度NPAHD、NPAMOZ、NPAOZ、NPSEM标准品溶液,用便携式试纸条荧光读数仪测出FIC、FIT值,以目标物浓度为横坐标,FIT/FIC为纵坐标,得到该方法的标准曲线,检出限定义为抑制率10%对应的NPAHD、NPAMOZ、NPAOZ、NPSEM浓度。
1.3.5 FMICA方法特异性验证
选取硝基呋喃类兽药原药、代谢物、衍生物、结构类似物及其他常见兽药,通过比较不同物质的FIT/FIC值,验证方法特异性。
1.3.6 实际样品处理
衍生:将实际样品粉碎后均质,称取1.0 g均质后的样品于50 mL的离心管中,加入4 mL去离子水和0.5 mL 1 mol/L HCl溶液混匀。加入100 µL的邻硝基苯甲醛溶液(50 mmol/L),混匀后置于60 ℃水浴反应3 h。
萃取:取出衍生后的样品加入5 mL PBS和0.4 mL 1 mol/L NaOH溶液调节pH值至中性,再加入5 mL乙酸乙酯,旋涡混匀30 s,于25 ℃、5 000 r/min离心10 min。取上层于玻璃试管中,50 ℃氮气吹干,重悬于2 mL正己烷中,加入2 mL pH 7.4 PBS,振荡混匀后,于25 ℃、5 000 r/min离心10 min,下层溶液备用。
1.3.7 方法有效性验证
采用ELISA试剂盒验证FMICA方法的有效性。
1.4 数据分析
2 结果与分析
2.1 制备FMs-Ab时最佳抗体量的优化
按照1.3.1节方法,添加不同抗体量制备FMs-Ab,分别用pH 7.4 PBS、1 μg/L标准品溶液进行试纸条检测。当试纸条C、T线FI一致且适中,灵敏度最理想时,抗体添加量即为最优添加量。如图2所示,在制备FMs-Ab复合物时,NPAHD、NPAMOZ、NPAOZ、NPSEM抗体量分别添加90、70、60、60 μg时,试纸条C、T线FI一致且适中,且T线FI明显减弱,灵敏度较高,此时为最佳添加量。
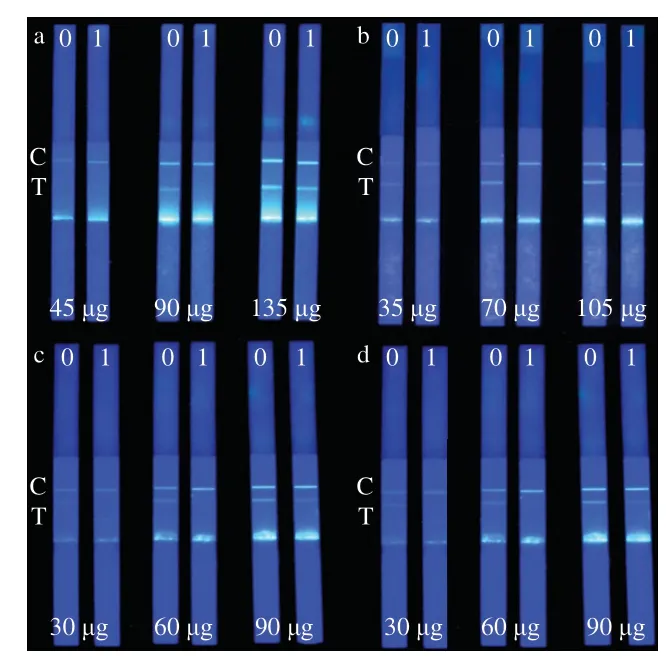
图2 FMs-Ab制备中抗体添加量的优化Fig. 2 Optimization of antibody dosage in the preparation of FMs-Ab
2.2 样品缓冲液的优化
样品缓冲液为试纸条的检测提供反应环境,其直接影响试纸条的灵敏度和准确性。本实验分别选取pH 5.7、7.4、8.5的PB和PBS为样品缓冲液进行试纸条检测。如 图3所示,样品缓冲液为pH 7.4 PBS时,4 种试纸条C、T线的荧光强度一致且适中,效果最好,最终选择pH 7.4 PBS为最佳样品缓冲液。

图3 FMICA样品缓冲液的优化Fig. 3 Optimization of loading buffer used in FMICA
2.3 二抗、包被原的最佳稀释倍数和FMs-Ab最佳添加量的优化
4 种包被原(NPAHD-BSA、NPAMOZ-BSA、NPAOZ-BSA、NPSEM-BSA)分别稀释70、50、20、100 倍,对应二抗分别稀释50、30、70、50 倍,FMs-Ab分别添加5、3、5、3 μL时,AHD、AMOZ、AOZ、SEM荧光微球免疫层析试纸条FIT/FIC(空白)接近于1,且 (FIT/FIC(加标))/(FIT/FIC(空白))最小(抑制率最大),此时为最佳二抗、包被原稀释倍数和FMs-Ab添加量。
2.4 硝酸纤维素膜的优化
选择Milllipore HF 90s、135s、140s共3 种硝酸纤维素膜进行优化。如图4所示,用Milllipore HF 90s硝酸纤维素膜上样,C线FI适中,但其膜孔径较大,层析过快,FMs-Ab与T线上的包被原未充分结合,导致T线FI太弱。用Millipore HF 140s硝酸纤维素膜上样,C线FI适中,但其膜孔径较小,层析缓慢,FMs-Ab与T线上的包被原过度结合,导致T线FI比C线强。最终选择C、T线FI一致且适中、条带清晰、无背景干扰的Millipore HF 135s硝酸纤维素膜。

图4 硝酸纤维素膜的优化Fig. 4 Optimization of NC membrane
2.5 试纸条检测方法标准曲线和检出限
样品缓冲液分别配制0、0.005、0.01、0.1、0.5、1、2、5 μg/L的NPAHD标准品溶液和0、0.01、0.05、0.1、1、2、5、10 μg/L的NPAMOZ、NPAOZ、NPSEM标准品溶液,进行试纸条检测,得出标准曲线。AHD、AMOZ、AOZ、SEM荧光免疫层析试纸条FIT/FIC(y)与目标物质量浓度(x)的线性方程分别为:y=-0.249 06lgx+0.217 38(R2=0.990 49)、y=-0.222 41lgx+0.481 98(R2=0.990 79)、y= -0.215 89lgx+0.398 11(R2=0.992 32)、y=-0.240 88lgx+ 0.500 61(R2=0.991 14),线性均良好(R2>0.99)。检出限分别为0.004、0.01、0.008、0.009 μg/L,检测线性范围分别为0.005~5、0.01~10、0.01~10、0.01~10 μg/L。
2.6 特异性评价
选取4 种硝基呋喃类药物原药、代谢物、结构类似物及其他常见兽药进行方法特异性评价。添加质量浓度均为5 μg/L的 NPAHD、NPAMOZ、NPAOZ、NPSEM标准品,代谢物标准品质量浓度为100 μg/L,原药质量浓度为100 μg/L,结构类似物、常见兽药质量浓度均为1 000 μg/L,用便携式试纸条荧光读数仪测定得出结果,如图5所示,AHD、AMOZ、AOZ、SEM荧光微球免疫层析试纸条分别对NPAHD、NPAMOZ、NPAOZ、NPSEM的FIT/FIC有较强响应,对代谢物和原药响应较小,其原因为代谢物的衍生物、代谢物和原药具有部分相似化学结构。其他结构类似物和常见兽药没有交叉反应,这些物质对检测结果没有影响。

图5 FMICA方法的交叉反应Fig. 5 Cross-reactivity of FMICA
2.7 实际样品的检测与有效性验证
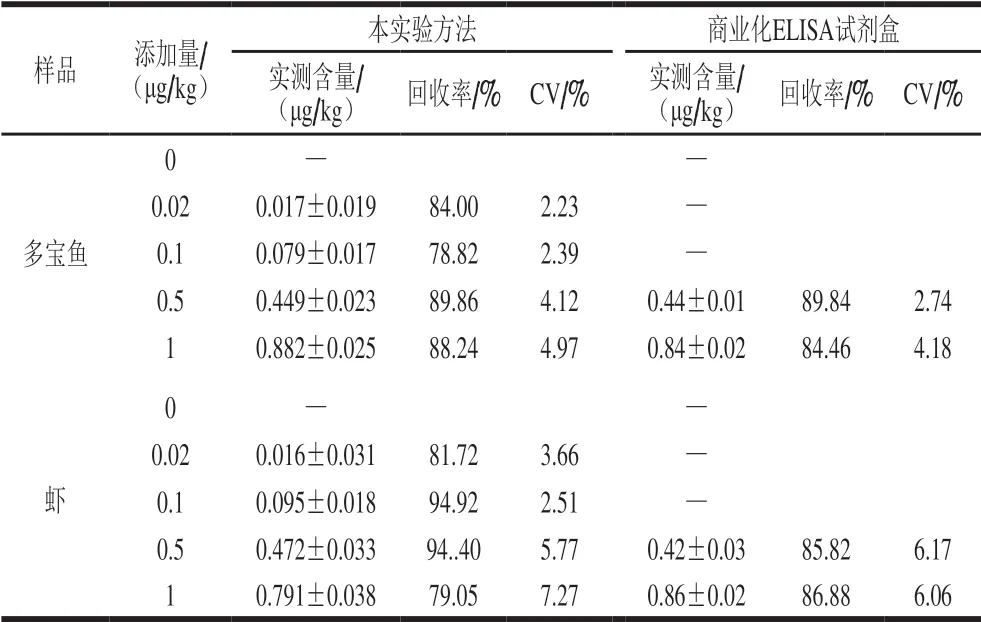
表2 实际样品中AMOZ的回收率(n=3)Table 2 Recoveries of AMOZ in spiked samples (n= 3)

表3 实际样品中AOZ的回收率(n=3)Table 3 Recoveries of AOZ in spiked samples (n = 3)
选取多宝鱼、虾作为实际样品,将质量浓度分别为0、0.02、0.1、0.5、1 μg/L的4 种代谢物标准品分别添加到实际样品中,用FMICA方法及商业化ELISA试剂盒进行检测。其实测含量、回收率、变异系数(coefficient of variation,CV)结果如表1~4所示,FMICA方法测出AHD、AMOZ、AOZ、SEM回收率为75.88%~104.81%,CV为1.90%~10.61%,商品化ELISA试剂盒的添加回收率为81.89%~107.65%,CV为2.57%~7.29%。2 种方法检测结果一致,证明FMICA方法准确性好,且FMICA方法能快速、简单地实现对多宝鱼、虾中AHD、AMOZ、AOZ、SEM的定量检测。

表1 实际样品中AHD的回收率(n=3)Table 1 Recoveries of AHD in spiked samples (n = 3)
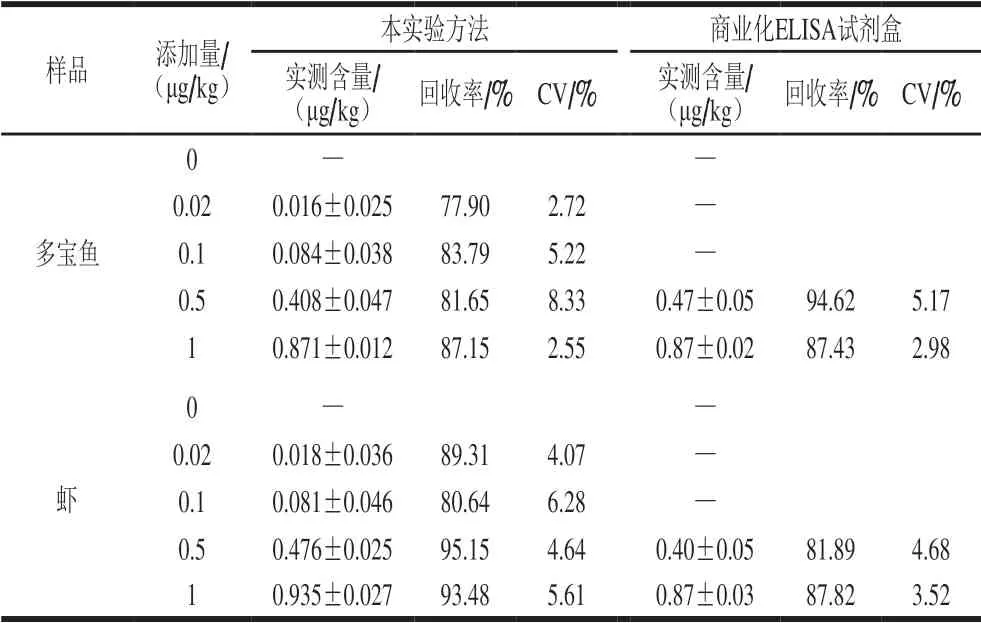
表4 实际样品中SEM的回收率(n=3)Table 4 Recoveries of SEM in spiked samples (n = 3)
3 结 论
本研究采用FM纳米材料作为信号标记物,基于抗原抗体的特异性结合作用,建立FMICA法用于定量检测水产品中4 种硝基呋喃类兽药代谢物的残留。与仪器验证方法相比,本研究建立的方法检测时间更短、操作更简单。与传统ELISA方法相比,灵敏度更高、操作更简单。与胶体金免疫层析检测方法相比,本方法在保留快速、简单的优势的同时,检测灵敏度更高。实际样品中硝基呋喃类兽药含量的测定结果与商品化ELISA试剂盒的测定结果具有理想的一致性,因此本方法具有很好的准确性和实用性。此外,FM纳米材料由于其优良的光学特性,其作为信号标记物在建立食品中小分子危害物的高灵敏、快速定量检测方法中具有良好的应用前景。
