锰离子催化臭氧氧化气相丁醛
2015-09-04朱荣淑刘贤博何永兵欧阳峰
朱荣淑,刘贤博,何永兵,曹 罡,欧阳峰
(1.深圳市水资源利用与环境污染控制重点实验室(哈尔滨工业大学深圳研究生院),518055广东深圳;2.深圳市城市废弃物能源再生公共技术服务平台,518055广东深圳)
近年来,随着餐饮业的发展,随之而来的油烟污染也越来越严重,其对大气污染贡献仅次于机动车污染源和工业污染源而位居第三[1].油烟中挥发性有机物(VOCs)不仅对大气造成了严重的污染,也是导致肺癌的元凶之一[2-3].此外,居民针对油烟臭味(主要由VOCs产生)的投诉越来越多,已占环境投诉的30%~40%[1].餐厨油烟废气中VOCs的治理已经引起政府的极大关注.
VOCs的处理方法主要包括吸附法、催化燃烧和催化臭氧氧化等[4].其中液相催化臭氧氧化是近年来发展起来的常温常压下降解有机物的方法,在氧化过程中产生的羟基自由基可无选择地将有机物氧化分解,从而达到净化的目的[5].Andreozzi等[6]研究了乙醛酸的Mn2+催化臭氧化,在一定条件下进行催化臭氧氧化实验,降解率可达60%,比无催化剂条件下降解率提高了35%.Davida 等[7]用Co(Ⅱ)作为臭氧化催化剂对草酸降解进行了批量催化臭氧氧化实验,结果表明,微量的Co(Ⅱ)可以加速草酸的臭氧化,降解率较直接臭氧氧化提高了近50%.醛类是餐厨油烟中典型的VOCs,且是油烟臭味的主要来源[8],有关锰离子催化臭氧氧化醛类的研究鲜见报道.本文以丁醛作为目标污染物,以锰离子作为均相催化剂,开展液相催化臭氧氧化丁醛的研究,并考察了催化剂浓度、pH、臭氧与污染物浓度比、温度、污染物初始浓度对锰离子催化臭氧氧化丁醛活性的影响.
1 实 验
1.1 实验材料
试剂主要有:丁醛、MnSO4·H2O、硫酸、氢氧化钠、碘化钾、淀粉,均由天津市大茂市化学试剂厂生产,均为分析纯.实验所用N2和O2由钢瓶提供(深圳市深特工业气体有限公司,纯度均为99.9%).
1.2 实验方法
1.2.1 催化剂的制备
均相催化剂的制备:将一定量的MnSO4·H2O溶于水中,配置一定浓度的含Mn2+溶液.
1.2.2 实验过程
反应气组分包括丁醛、O2、O3,N2为平衡气.N2和O2由钢瓶气提供,丁醛采用鼓泡法产生.O3由O2经过臭氧发生器(CF-G-3-10g,青岛国林)产生.N2、丁醛、臭氧经由流量计进入混合管输入到装有25mL均相锰离子催化剂反应器中,气体总流量为110mL/min.图1为反应装置示意.
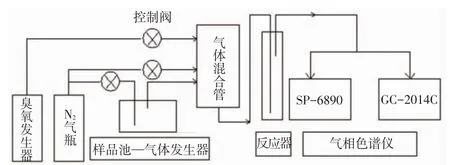
图1 Mn2+催化臭氧氧化反应装置示意
采用化学碘量法测量臭氧浓度,由SP-6890气相色谱仪(山东鲁南瑞虹化工仪器有限公司,毛细柱50m×0.25mm×0.5μm)在线检测产物中有机物浓度,由GC-2014C气相色谱仪(日本岛津)在线检测生成物CO2和CO.测量结果以5min/次的采样频率在线记录储存于电脑中.
实验前,向反应液中通入丁醛直至检测出的丁醛浓度稳定后,再通入臭氧开始实验以消除水对丁醛吸收的影响.初始条件为:pH=5、催化剂浓度为1mmol/L、丁醛浓度为200mL/m3、臭氧与丁醛浓度比为0.2、反应温度为(25±1)℃.在各影响因素研究实验中,考察参数包括:pH(1,3,5,7,9)、催化剂浓度(0.1,0.5,1,2,4mmol/L)、臭氧与丁醛浓度比(0.05,0.1,0.2,0.5,1)、温度(25,30,40,50,60℃)、污染物初始浓度(50,100,200,400,500mL/m3).在考察每个参数的影响实验中,除被考察参数改变外,其他参数与初始条件一致.
1.2.3 评价指标
催化活性可用丁醛的降解率来评价,即
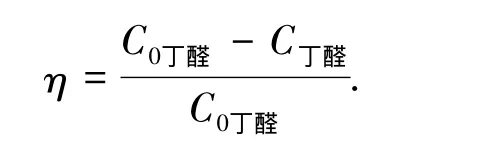
式中:C0丁醛为丁醛的初始浓度,C丁醛为反应达到平衡时丁醛的浓度.
为更好地考察VOCs矿化情况(产物为CO2和H2O),对其矿化率也进行了测定,即γ=CCOx/(4×C0丁醛).其中CCOx为反应中产生的CO2和CO的浓度.
2 结果与讨论
2.1 Mn2+催化臭氧氧化丁醛的活性
图2为丁醛催化臭氧氧化的活性曲线.可以看出,直接臭氧氧化的降解率只有30.98%,而催化臭氧氧化的降解率为85.98%.这一结果表明,均相催化剂Mn2+的加入可以较大程度地提高丁醛的降解率.这一现象与文献[6-7,9-10]结果一致,主要是 Mn2+催化臭氧液相氧化有HO·的参与[11],从而促进了有机物的降解.
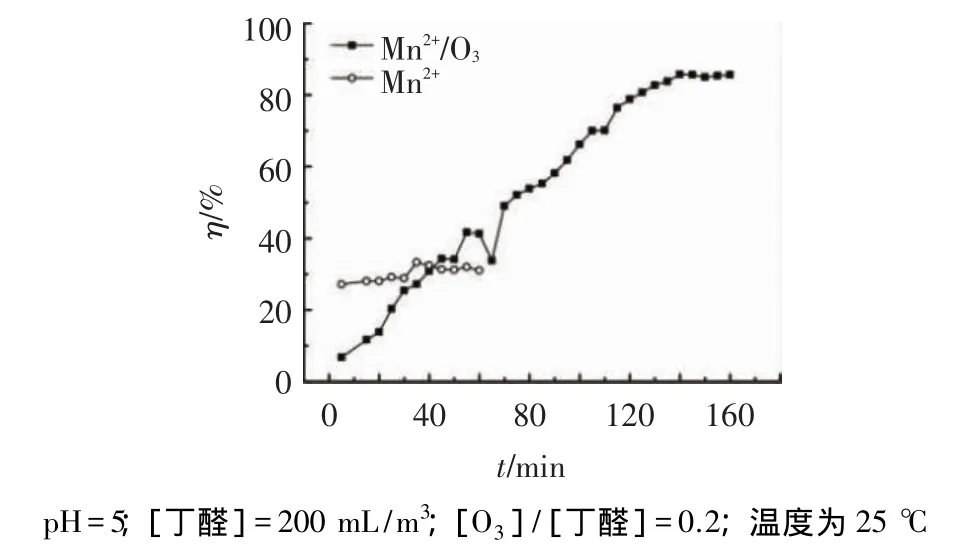
图2 丁醛催化臭氧氧化活性曲线
前40 min的催化降解率低于直接臭氧氧化,这主要是由于反应开始羟基自由基的产生量很小,而此时臭氧的直接氧化作用又很弱.
2.2 反应条件对催化活性的影响
2.2.1 pH 的影响
图3为pH对Mn2+催化臭氧氧化丁醛的影响.其中图3(a)为不同pH下丁醛浓度随时间的变化,图3(b)为平衡时不同pH下的丁醛降解率.可以看出,随着pH的升高,丁醛的降解率先升高后降低再升高,pH为5时的降解效果最好,可达85.98%.有研究表明,在催化臭氧化中起作用的很可能是水合二氧化锰[10],这就使原来的均相环境介质转变为水溶液、催化剂的表面和催化剂-溶液界面等3种环境[12].二氧化锰的零点电位在 4.5左右,有研究表明pH过高或过低均会一定程度上影响催化剂水合二氧化锰的形成,从而影响羟基自由基的形成,因此,降解率随着pH的升高先增大后降低.在pH=9时又有略微升高,主要是因为氢氧根的存在更有利于羟基自由基的产生,但碱性条件下并不利于水合二氧化锰的形成[13-14],从而不利于羟基自由基的产生.综上,体系存在最佳pH.
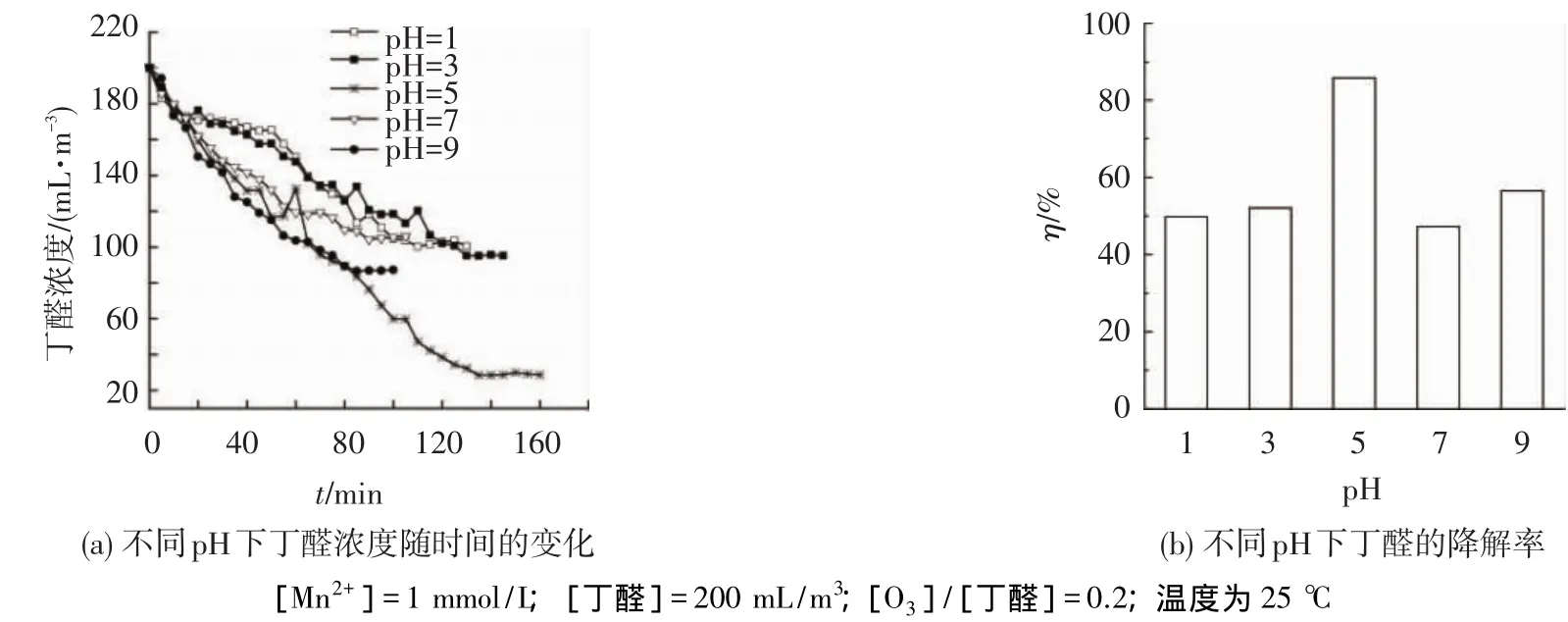
图3 pH对Mn2+催化臭氧氧化丁醛的影响
2.2.2 催化剂浓度的影响
图4为Mn2+浓度对催化臭氧氧化降解丁醛的影响.图4(a)为不同Mn2+浓度下丁醛浓度随时间的变化,图4(b)为平衡时不同Mn2+浓度下丁醛的降解率.可以看出,随着催化剂浓度的升高存在一个最佳值.丁醛的降解率先升高后降低,最佳催化剂浓度为1 mmol/L.与 Li等[10]的报道一致.这主要是由于催化剂的浓度影响催化剂活性位的多少,高浓度的催化剂可提供更多的活性位.但过多的Mn2+可能会消耗产生的羟基自由基,从而使降解率下降[10,12].

图4 Mn2+浓度对催化臭氧氧化丁醛的影响
2.2.3 臭氧与丁醛浓度比的影响
图5为臭氧与丁醛浓度比对Mn2+催化臭氧氧化丁醛的影响,图5(a)为不同[O3]/[丁醛]下丁醛浓度随时间的变化,图5(b)为平衡时不同臭氧与丁醛浓度比下丁醛的降解率.可以看出,随着臭氧与丁醛浓度比的增加,丁醛的降解率随之增加,在比例为0.5时降解率可达 95.29%,最后趋于平稳.马双忱等[15]利用含有Mn2+的溶液氧化气相中的SO2也观察到同样的现象.这主要是由于随着臭氧和丁醛浓度比的增加,产生的HO·与丁醛比例也随之增大,使丁醛的降解率升高.
2.2.4 反应液温度的影响
图6为反应液温度对Mn2+催化臭氧氧化丁醛的影响,图6(a)为不同温度下丁醛浓度随时间的变化,图6(b)为平衡时不同温度下丁醛的降解率.可以看出,温度在25~60℃内,降解率先增大后降低,这可能是温度的升高能促进反应速率加快,也可以促进HO·生成速度,但臭氧和丁醛在水中的溶解度随温度的升高而降低,这两种相反的影响在一定程度上可能相互抵消[16].温度较低时,第一种影响占主导作用,而温度较高时第二种影响占主导作用.
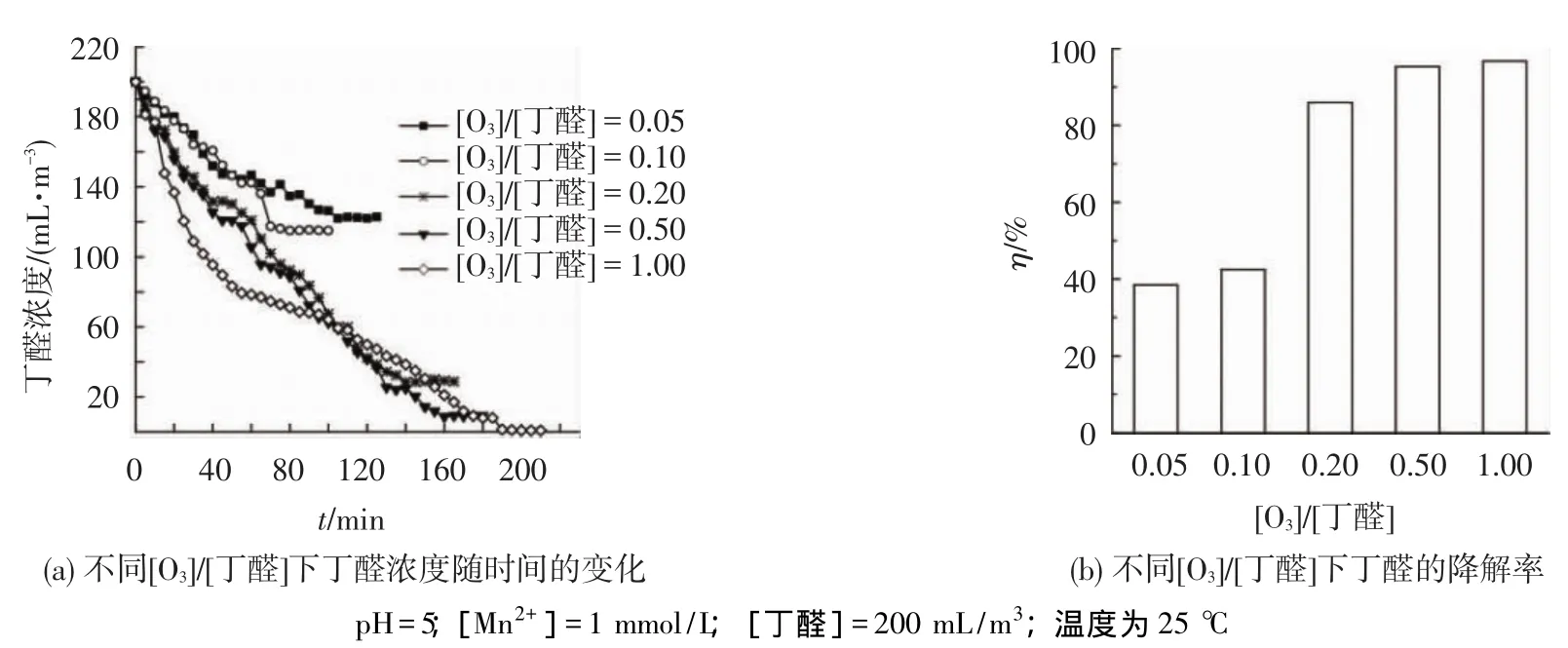
图5 臭氧与丁醛浓度比对Mn2+催化臭氧氧化丁醛的影响
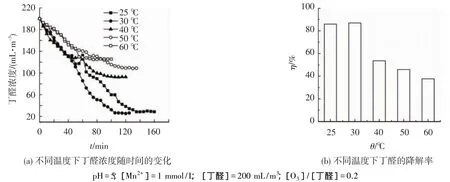
图6 反应温度对Mn2+催化臭氧氧化丁醛的影响
2.2.5 丁醛初始浓度的影响
图7为丁醛初始浓度对Mn2+催化臭氧氧化丁醛的影响,图7(a)为不同初始丁醛浓度下丁醛浓度随时间的变化,图7(b)为平衡时不同初始丁醛浓度下丁醛的降解活性.可以看出,在丁醛的初始浓度为50~500 mL/m3内,随其浓度的增加,丁醛的降解率降低,与许多文献报道一致[13,17-18].这主要是由于催化剂活性位的限制,使丁醛还未能与催化剂作用就排放出去,从而造成降解率下降.
图7(b)显示了达到降解平衡时不同初始丁醛浓度条件下的丁醛矿化率.可以看出,随着丁醛初始浓度的增加,其矿化率也随之降低.值得注意的是在初始浓度为50 mL/m3时,其矿化率可达91.8%,几乎可以完全降解丁醛.
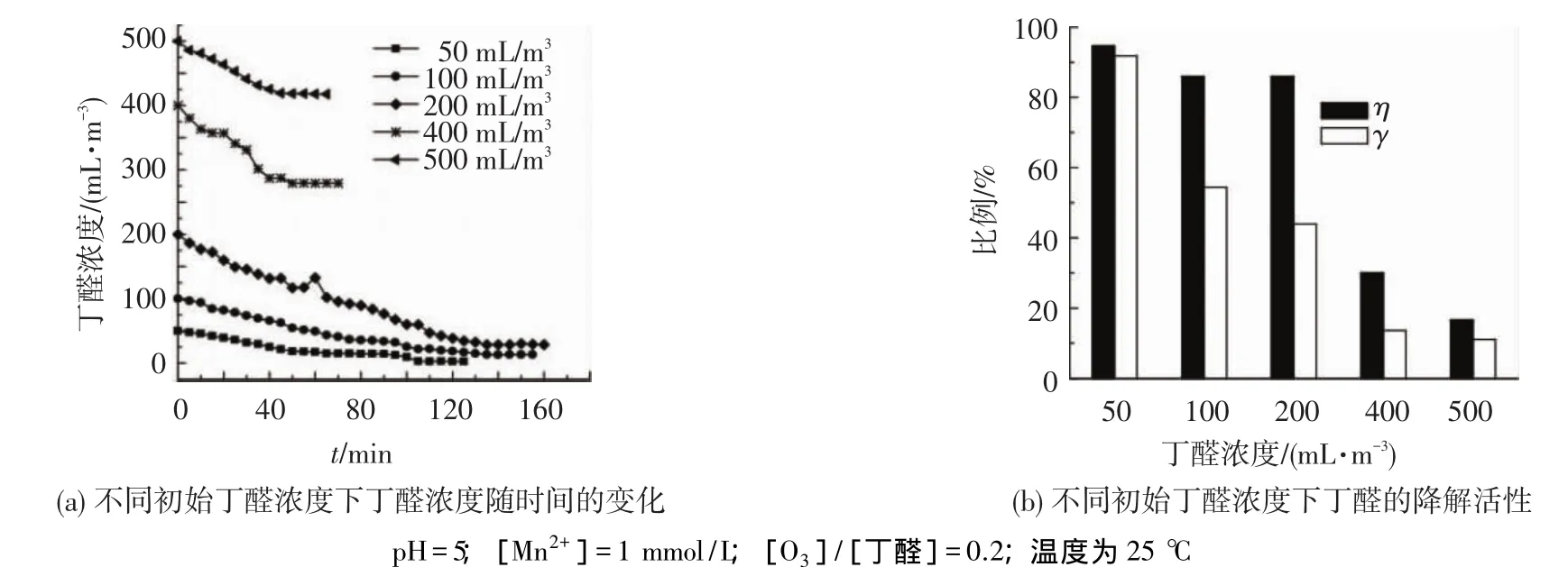
图7 丁醛初始浓度对Mn2+催化臭氧氧化丁醛的影响
3 结 论
1)Mn2+的加入可以显著提高丁醛的降解率,相较于直接臭氧氧化降解率提高了59%.
2)丁醛的降解率随丁醛浓度的降低和[O3]/[丁醛]升高而增大;随Mn2浓度和温度的增大先升高后降低,在浓度和温度分别为1 mmol/L和30℃时降解效果最好;存在最优pH,即pH=5时降解效果最好.
3)在催化剂浓度为1 mmol/L、pH=5、丁醛初始浓度为 50 mL/m3、[O3]/[丁醛]=0.2、温度为室温的条件下,丁醛的降解率可达94.67%,丁醛的矿化率可达91.8%,几乎可以完全去除丁醛.
[1]邓任伟.国内餐饮业油烟污染现状分析及其防治对策探讨[J].北方环境,2012,5(23):110-112.
[2]甄瑞卿.厨房油烟板式净化器研究[D].北京:首都经济贸易大学,2008.
[3]王秀艳,高爽,周家岐,等.餐饮油烟中挥发性有机物风险评估[J].环境科学研究,2012,25(12):49-54.
[4]BERENJIAN A,CHAN N,MALMIRI H.Volatile organic compounds removal methods:a review[J].American Journal of Biochemistry and Biotechnology,2012,8(4):220.
[5]李来胜,祝万鹏,李中和.催化臭氧化:一种有前景的水处理高级氧化技术[J].给水排水,2001,27(6):26-29.
[6]ANDREOZZI R,MAROTTA R,SANCHIRICO R.Manganese-catalysed ozonation of glyoxalic acid in aqueous solutions[J].Journal of Chemical Technology and Biotechnology,2000,75(1):59-65.
[7]PINES D,RECKHOW D.Effect of dissolved cobalt(II)on the ozonation of oxalic acid[J].Environmental Science &Technology,2002,36(19):4046-4051.
[8]谭晓风,孙晓钰,刘德全,等.厨房烹调油烟的有机物定性定量 GC/MS分析[J].质谱学报,2003,24(1):270-274.
[9]任健,何松波,孙承林.腐殖酸协同Mn2+催化臭氧氧化降解五氯苯酚[J].现代化工,2013,33(7):68-71.
[10]LI Haiyan,QU Jiuhui,ZHAO Xiang,et al.Removal of alachlor from water by catalyzed ozonation in the presence of Fe2+,Mn2+, and humicsubstances[J].Journalof Environmental Science and Health,Part.B,2004,39(5/6):791-803.
[11]NAWROCKI J,KASPRZYK-HORDERN B.The efficiency and mechanismsofcatalytic ozonation[J].Applied Catalysis B:Environmental,2010,99(1):27-42.
[12]PARK J,CHOI H,CHO J.Kinetic decomposition of ozone and para-chlorobenzoie acid (pCBA)duringcatalytic ozonation[J].Wat Res,2004,38(4):228-229.
[13]竹湘锋,徐新华,王天聪.Fe(Ⅲ)/O3体系对草酸的催化氧化[J].浙江大学学报:理学版,2004,31(3):322-325.
[14]Andreozzi R,CAPRIO V,MAROTTA R.The use of manganese dioxide as heterogeneous catalyst for oxalicacid ozonation in aqueous solution[J].Applied Catalysis A:General,1996,138(1):75-81.
[15]马双忱,苏敏,马京香,等.锰离子催化臭氧液相烟气脱硫实验研究[J].环境科学,2009,30(11):3173-3176.
[16]苏敏.臭氧高级氧化技术同时脱硫脱硝的实验研究[D].河北:华北电力大学,2009.
[17]ZHU Rongshu,CHE Sainan,LIU Xianbo,et al.A novel fluidized-bed-optical-fibers photocatalytic reactor(FBOFPR)and its performance[J].Applied Catalysis A:General,2014(471):136-141.
[18]吴耀国,惠林,赵晨辉,等.金属锰(II)催化臭氧化TNT的机理[J].火炸药学报,2006,29(5):17-21.