酱油中内源性苯甲酸本底含量调查与溯源分析
2021-11-05李国辉王道兵岳红卫武竹英钟其顶
李国辉,班 楠,王道兵,常 迪,岳红卫,武竹英,钟其顶,
(1.中国食品发酵工业研究院,北京 100015;2.北京市产品质量监督检验院,北京 101300)
苯甲酸及其钠盐是目前国际上应用最广、用量最大的食品防腐剂[1],GB 2760—2014《食品添加剂使用标准》[2]中规定,苯甲酸及其钠盐可作为防腐剂,用于碳酸饮料、配制酒等22 类食品中,最大使用量范围为0.2~2.0 g/kg(以苯甲酸计)。然而,在自然条件下,苯甲酸又是许多植物的次级代谢产物[3-8]。据食品添加剂联合专家委员会(Joint FAO/WHO Expert Committeeon Food Additives,JECFA)报告,在谷物、蔬菜、水果、坚果、豆类等食品中天然存在一定量的苯甲酸,尤以浆果含量最高[1,5-6]。在杂食和食草动物的内脏、肌肉以及乳类及其制品中也天然存在微量的苯甲酸。JECFA根据9 个国家提供的数据对苯甲酸盐通过食物的摄入量进行了评估,其中酱油是我国居民苯甲酸盐摄入的主要来源,澳大利亚、新西兰、法国、英国和美国主要通过软饮料摄入苯甲酸盐[1]。
酱油是我国居民摄入苯甲酸的主要来源,GB 2760—2014中要求苯甲酸在酱油中的最大使用量为1.0 g/kg。在“健康中国2030”的大背景下,零添加酱油以其不添加外源物质的创新特质受到广大消费者青睐。但从目前对于零添加酱油的调查结果看,酱油中存在微量的苯甲酸本底。由于酱油中允许添加外源苯甲酸,零添加酱油中是否存在人为添加苯甲酸的可能性,目前尚不明确,也给食品安全监管部门以及相关生产企业带来很大的困扰。为确保零添加酱油市场有序发展,解决酱油行业发展所面临的微量苯甲酸以及市场监管问题,本研究旨在明确酱油中内源性微量苯甲酸的含量水平,阐明内源性苯甲酸的生成途径及变化规律,为零添加酱油的市场监管提供基础数据,支撑酱油行业有序发展。
1 材料与方法
1.1 材料与试剂
酱油原料(小麦、大豆、水)和生产过程样品:落黄(各原料经前处理、混合后,刚进入发酵罐时的样品)、过程油(发酵过程中压榨抽提的酱油,第1次抽提简称为头油,第2次抽提简称为二油、第3次抽提简称为三油)、酱油原油(简称为原油)以及部分零添加酱油预售品和成品采自某知名酱油企业,部分不同生产企业的常规酱油和零添加酱油购自超市。
苯丙氨酸(纯度≥99.8%)、苯甲酸(纯度≥ 99.8%)、甲醇(分析纯)、乙腈(分析纯) 上海安谱实验科技股份有限公司;异硫氰酸苯酯(分析纯) 美国Sigma公司;亚铁氰化钾、乙酸锌、三乙胺、乙酸钠、乙酸、盐酸、正己烷(均为分析纯) 北京化工厂有限责任公司;蔗糖(IAEA-CH-6,参考值(-10.449±0.2)‰) 国际原子能机构。
1.2 仪器与设备
2695高效液相色谱仪(配紫外检测器) 美国Waters公司;3k15高速离心机 德国Sigma公司;ME104E万分之一天平 瑞士梅特勒-托利多公司;Vortex-Genie 2涡旋振荡器 美国Scientific Industries 公司;1260 Infinity II制备液相色谱仪 美国安捷伦 公司;Flash 2000-Delta V元素分析仪-稳定同位素比率质谱仪 美国赛默飞世尔科技公司;KQ-500DE型数控超声清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 苯甲酸含量测定
采用GB 5009.28—2016《食品中苯甲酸、山梨酸和糖精钠的测定》[9]中液相色谱法进行。
1.3.2 苯丙氨酸含量测定
参考QB/T 4356—2012《黄酒中游离氨基酸的测定 高效液相色谱法》[10]进行测定。液体样品取1.00 mL于10 mL容量瓶中,用0.1 mol/L盐酸定容至刻度(固体样品粉碎或匀浆后取2.50 g于50 mL带盖离心管中,加入25 mL 0.1 mol/L盐酸,超声提取30 min,离心,取上清液500 μL),进行测定并定量。
1.3.3 苯甲醛含量测定
采用液相色谱法[11],液体样品取10 mL酱油样品,50%甲醇溶液定容于50 mL容量瓶中(固体样品粉碎或匀浆后取2.5 g于50 mL带盖离心管中,加入50%甲醇溶液,超声提取30 min,离心),过0.22 μm滤膜后经高效液相色谱测定。
色谱条件:C18色谱柱,柱温30 ℃;流动相为甲醇-水(35∶65,V/V),流速0.8 mL/min;紫外检测器,波长250 nm;进样量20 μL。
1.3.4 样品中苯甲酸稳定碳同位素比值(δ13C)测定
采用GB 5009.28—2016[9]方法对样品中苯甲酸进行提取,采用制备液相色谱仪对提取液中苯甲酸进行分离并收集,收集液经冷冻干燥后使用100 μL 0.1 mol/L的盐酸溶液进行复溶,复溶后的溶液经元素分析仪-稳定同位素比例质谱仪分析苯甲酸的δ13C值。
1.4 数据处理
实验数据用SPSS 19.0统计分析,采用Origin 8.5 作图。
2 结果与分析
2.1 酱油中苯甲酸的含量
在酱油生产企业采集不同批次的成品零添加酱油8 份,零添加酱油预售品8 份,酱油原油32 份,分别分析其苯甲酸含量,结果见表1。酱油原油中,苯甲酸含量范围为7.52~14.44 mg/kg,均值为11.61 mg/kg;零添加酱油预售品中,苯甲酸含量范围为9.43~17.09 mg/kg, 均值为13.31 mg/kg;市售零添加酱油成品中,苯甲酸含量范围为12.53~14.23 mg/kg,均值为13.25 mg/kg; 在所有的48 份企业零添加原始样品中,苯甲酸含量范围为7.52~17.09 mg/kg,均值为12.72 mg/kg。 所有样品中苯甲酸的检出率为100%,表明在酱油生产过程中存在自然生成的微量苯甲酸,所有样品中苯甲酸含量小于20 mg/kg,可初步认为酱油生产过程中微量苯甲酸的本底值或在20 mg/kg以内,远低于GB 2760—2014中对于酱油中苯甲酸最大使用量1 000 mg/kg。同样参考GB 2760—2014中对于苯甲酸最大使用量要求,最低为碳酸饮料200 mg/kg,基本可以认为含量低于20 mg/kg不具备实际防腐能力。
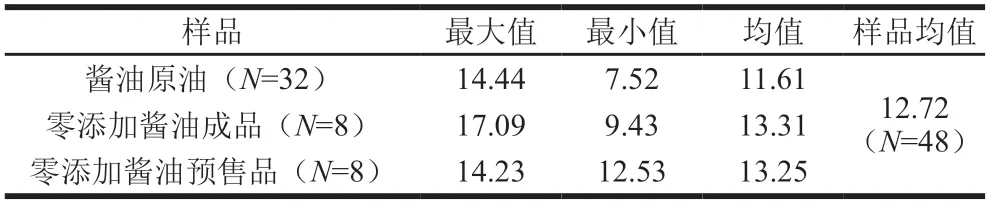
表1 酱油中苯甲酸含量 Table 1 Benzoic acid concentration in soy sauce mg/kg
2.2 酱油生产过程中苯甲酸本底跟踪分析
上述分析可知,酱油原油中存在微量苯甲酸,均值为10.17 mg/kg,由于是企业直接采样,排除人为添加苯甲酸的可能,因此酱油原油中微量苯甲酸来源于生产过程。本研究系统分析酱油生产过程(原料、落黄、过程油)中苯甲酸的动态变化,结果见表2。
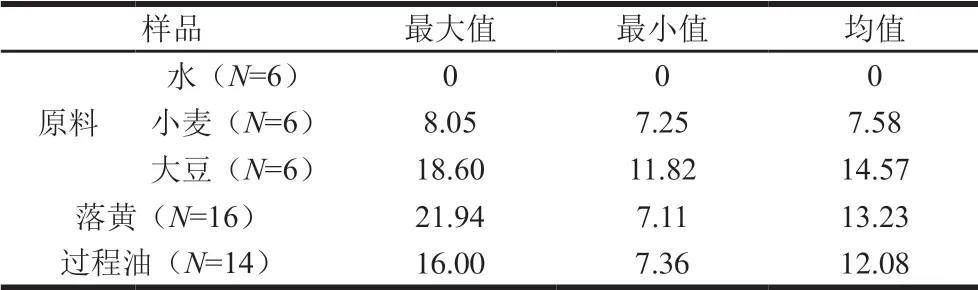
表2 酱油生产过程中苯甲酸含量跟踪分析 Table 2 Analysis of benzoic acid content during the production process of soy sauce mg/kg
3 种原料中,大豆的苯甲酸含量最高,均值为14.57 mg/kg,小麦次之均值为7.58 mg/kg,酿造用水中未检出苯甲酸。大豆和小麦中的苯甲酸应该为植物生长过程中的次生代谢产物,相关文献已有报道[3,12-15]。大豆和小麦的苯甲酸均值为11.07 mg/kg,考虑酱油的实际生产,大豆用量远高于小麦,按大豆用量90%计算,酱油生产过程中原料带入的苯甲酸含量约为13.87 mg/kg,略高于酱油原油中苯甲酸的含量均值。认为酱油中微量苯甲酸主要来源于原料大豆和小麦带入。
对酱油生产过程中落黄和过程油中苯甲酸含量进行跟踪分析可知,落黄样品中,苯甲酸含量范围为7.11~21.94 mg/kg,均值为13.23 mg/kg,基本和原料中苯甲酸含量均值13.87 mg/kg一致;不同阶段的过程油中苯甲酸含量范围为7.36~16.00 mg/kg,均值为 12.08 mg/kg,略高于最终原油中苯甲酸的均值11.61 mg/kg, 接近于零添加酱油成品和预售品中苯甲酸均值13.31 mg/kg和13.25 mg/kg。
2.3 贮存时间对酱油中苯甲酸本底含量的影响
上述分析表明,酱油中存在微量的苯甲酸本底值,且预售零添加酱油和成品零添加酱油中苯甲酸含量略高于原油,分析可能为零添加酱油所选择的过程油批次(头油、二油、三油)不同以及酱油贮存阶段苯甲酸会有微量增加。本实验对不同生产日期的零添加酱油成品在不同模拟货架期内苯甲酸含量变化继续测定分析,结果见图1。
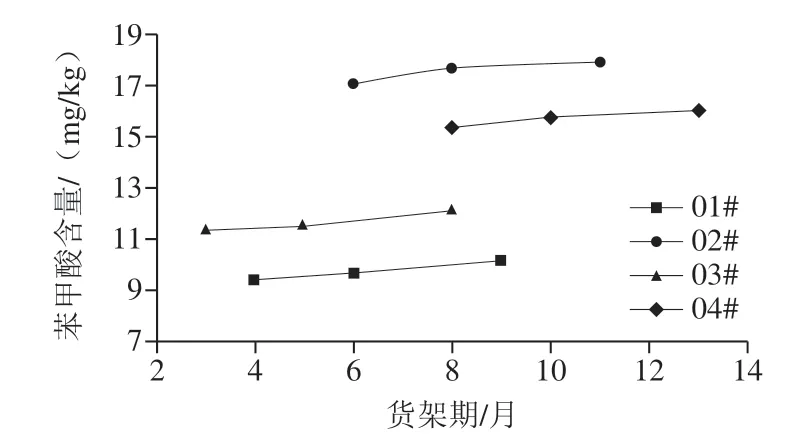
图1 不同货架期的零添加酱油中苯甲酸含量变化Fig. 1 Changes in the content of benzoic acid in zero-additive soy sauce with different shelf lives
不同生产日期以及货架期零添加酱油产品的苯甲酸含量,随贮藏时间延长呈略有增加的趋势,表明除发酵过程中苯甲酸产生之外,在酱油的贮存(或货架)期过程中,同样存在微量苯甲酸的生成,也表明酱油中存在一定量的苯甲酸前体物质。
2.4 酱油中微量苯甲酸前体物质分析
综合目前关于食品中苯甲酸来源的文献报道[16-18],其主要分为4 个途径:1)食品加工原料中带入;2)食品中马尿酸水解生成苯甲酸和甘氨酸;3)苯丙氨酸降解为苯甲酸和肉桂酸;4)苯甲醛氧化生成苯甲酸。结合上述分析结果,酱油原油中微量苯甲酸绝大部分来源于原料带入,在贮存过程中某种前体物质会缓慢转化为微量苯甲酸。依据酱油的实际生产工艺与产品特点,该类前体物质可能为苯丙氨酸和苯甲醛。
2.4.1 酱油生产过程中苯丙氨酸含量分析
本实验优化QBT 4356—2012测定酱油样品中苯丙氨酸的方法,方法分离度良好(图2),在5.16~206.5 mg/L 线性范围内,线性方程为y=28 115x-5 879,R2=0.999 9,平均回收率为92.5%(表3),方法稳定性相对标准偏差为1.42%(表4)。
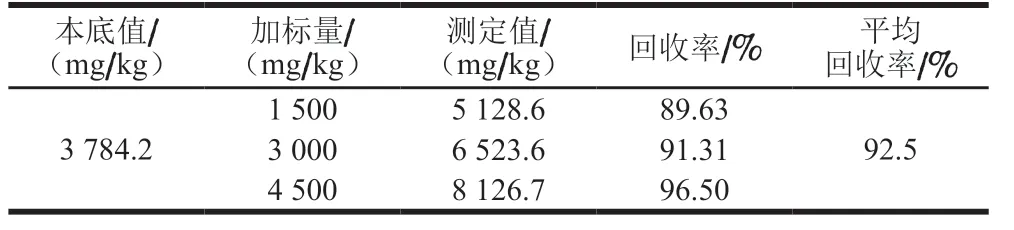
表3 酱油中苯丙氨酸回收率测定Table 3 Recoveries of phenylalanine in spiked soy sauce

表4 酱油中苯丙氨酸测定重复性分析Table 4 Repeatability for phenylalanine in soy sauce

图2 高效液相色谱测定酱油中苯丙氨酸色谱图Fig. 2 HPLC chromatogram of phenylalanine in soy sauce
落黄、过程油、原油、零添加酱油预售品以及成品零添加酱油中苯丙氨酸含量,见图3。其中落黄样品中苯丙氨酸平均含量为4 071.5 mg/kg,过程油中游离苯丙氨酸平均含量为3 244.4 mg/kg,原油中游离苯丙氨酸平均含量为4 238.5 mg/kg,零添加酱油预售品中平均游离苯丙氨酸含量为3 854.5 mg/kg,零添加酱油成品中游离苯丙氨酸平均含量为3 759.7 mg/kg。上述对于酱油中苯丙氨酸的测定结果与文献报道结果相接近[12-14]。根据苯丙氨酸的含量水平以及苯甲酸可能生成途径(图4),苯丙氨酸可能为酱油中苯甲酸的前体物质。

图3 酱油生产过程中苯丙氨酸含量跟踪分析Fig. 3 Analysis of phenylalanine content during the production process of soy sauce
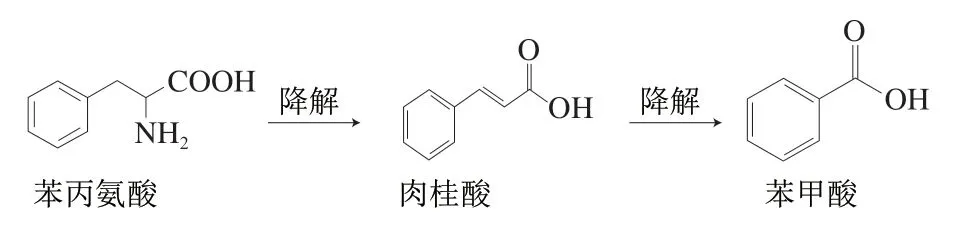
图4 苯丙氨酸转化为苯甲酸途径示意图Fig. 4 Schematic diagram of the transformation of phenylalanine to benzoic acid
2.4.2 酱油生产过程中苯甲醛含量分析
苯甲酸的另一生成途径为苯甲醛的氧化途径(图5)。 本研究建立了酱油中苯甲醛测定方法,方法分离度良好(图6),在0.25~5 mg/L线性范围内,方法线性相关系数为0.999 6,方法定量限(RSN=10)为0.2 mg/L,加标回收率实验结果见表5,平均回收率为90.6%。
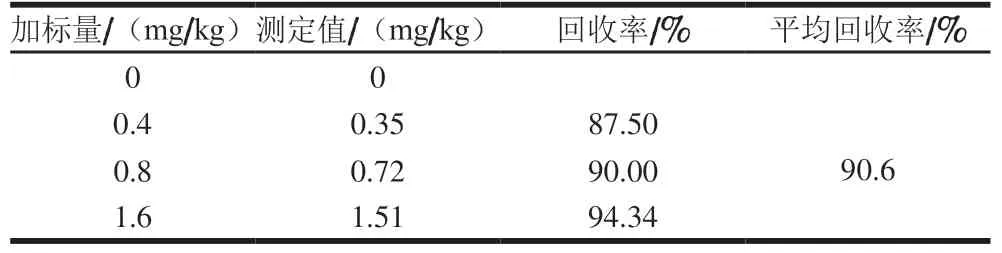
表5 酱油中苯甲醛测定方法回收率Table 5 Recoveries of benzaldehyde in soy sauce
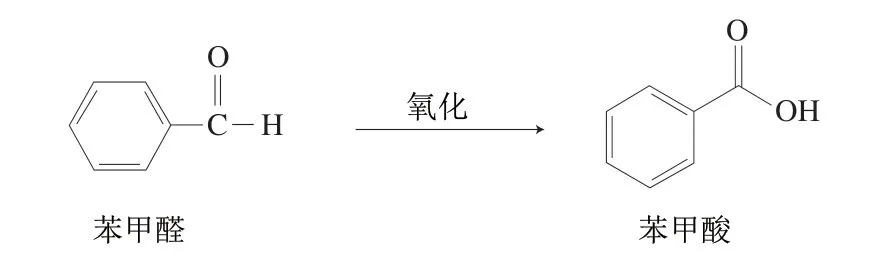
图5 苯甲醛转化为苯甲酸途径示意图Fig. 5 Schematic diagram of the transformation of benzaldehyde to benzoic acid
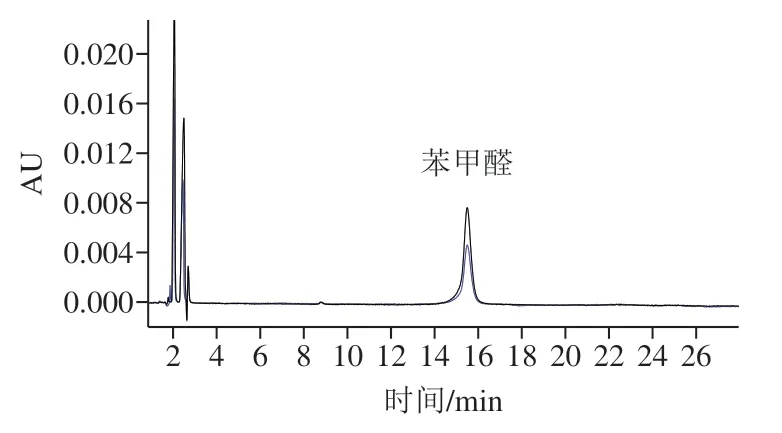
图6 酱油中添加苯甲醛液相色谱图Fig. 6 HPLC chromatogram of different concentrations of benzaldehyde added in soy sauce
所有酱油原料、生产过程样品以及原油样品中均未检出苯甲醛,因此确定苯甲醛不是酱油中苯甲酸生成的前体物质。
2.4.3 酱油中苯丙氨酸对苯甲酸的贡献率分析
结合不同生产日期的零添加成品酱油在实验室存放5 个月货架期数据,成品零添加酱油在货架期内苯甲酸的年增加率为10.30%~18.83%,年增加量为1.58~ 1.99 mg/kg,平均年增加率14.26%(表6)。因此,苯丙氨酸对酱油中苯甲酸具有一定的贡献率。

表6 酱油中苯甲酸含量货架期变化分析Table 6 Change in benzoic acid content in soy sauce during shelf life
2.5 酱油生产过程中苯甲酸13C稳定同位素分析
稳定同位素技术在鉴别天然/外源添加物质中具有重要应用,化合物的最初碳源均来自植物光合作用固定的CO2,因光合作用类型差异使得不同来源的有机物存在碳同位素差异。来源于同一原料的化合物,理论上其13C稳定同位素丰度值应与原料特征一致(同位素分馏效应会有微小影响)[19-23]。如果酱油中苯甲酸与原料中的苯甲酸13C丰度值一致,也可证明酱油中苯甲酸主要来源于原料带入。
本实验通过制备液相色谱仪将各样品中苯甲酸分离制备,收集液经冷冻干燥后溶解进元素分析-同位素比率质谱分析测定。元素分析仪经IAEA-CH-6蔗糖标准品进行校正,选取一个酱油样品和一个大豆样品重复处理5 次,分析测定方法稳定性,苯甲酸δ13C测定的标准偏差分别为0.14‰和0.13‰,满足测定要求,结果见表7。酱油生产过程中苯甲酸δ13C值变化情况如图7所示,大豆中苯甲酸δ13C值为-27.36‰,小麦中苯甲酸δ13C值为-27.76‰,因为大豆和小麦均属于C3植物,这一特征符合C3植物的稳定碳同位素特征,也说明大豆和小麦中苯甲酸来源于自身次级代谢。落黄中苯甲酸δ13C均值为-26.43‰,而过程样品以及原油、成品酱油中苯甲酸δ13C值均在-25‰附近,均值为-25.57‰。苯甲酸值在落黄和发酵产油过程中可能出现同位素分馏现象,导致苯甲酸δ13C值有微小偏正,但整体处于C3植物δ13C特征范围内(-36.00‰~-22.00‰)[24-26],表明酱油中微量苯甲酸来源于原料带入。
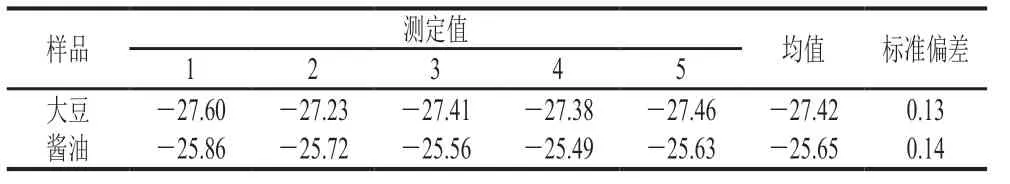
表7 苯甲酸δ13C测定重复性分析Table 7 Repeatability for benzoic acid δ13C‰
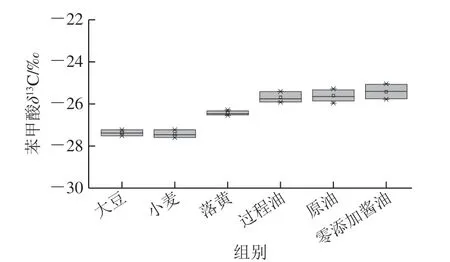
图7 酱油生产过程中苯甲酸δ13C跟踪分析Fig. 7 Analysis of benzoic acid δ13C during the production of soy sauce
2.6 市售酱油中苯甲酸含量分析
从超市分别购置7 份不同品牌的常规酱油(CG)和不同品牌的零添加酱油(LTJ),分析不同酱油之间苯甲酸含量差异,结果见表8。其中,常规酱油中苯甲酸含量均值为462.87 mg/kg,与文献报道结果相近[27-33],含量均小于GB 2760—2014规定的最大使用量1 000 mg/kg,零添加酱油中苯甲酸含量均值为13.38 mg/kg,远低于常规酱油,与上述对于酱油中苯甲酸含量本底值分析结果一致。
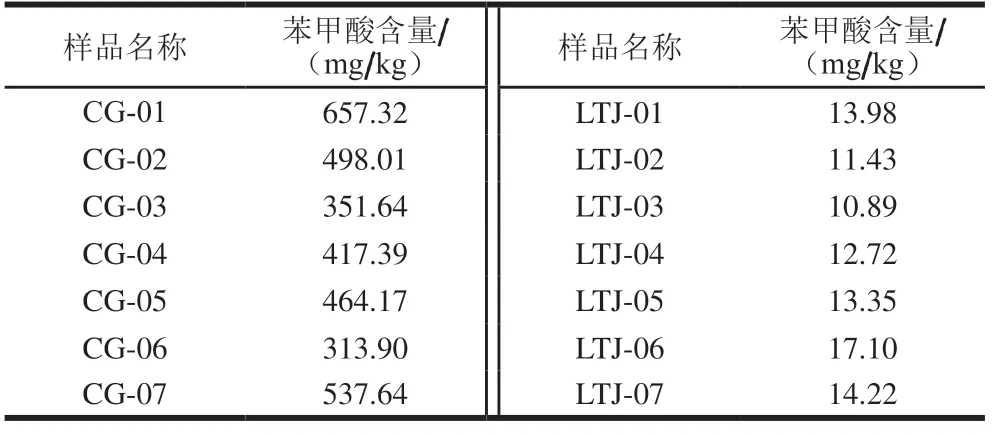
表8 不同酱油之间苯甲酸含量差异Table 8 Benzoic acid contents in regular and zero-additive soy sauce
3 结 论
本实验对酱油中微量苯甲酸本底含量以及溯源进行研究,系统分析了酱油生产以及贮存过程中苯甲酸含量变化。结果表明:1)酱油中苯甲酸本底值为7.52~17.09 mg/kg,均值为12.72 mg/kg,且苯甲酸的检出率为100%;2)酱油中微量苯甲酸本底主要来源于原料带入;3)在贮存或货架期阶段,苯丙氨酸的降解致使酱油中苯甲酸含量呈缓慢增加的趋势,平均年增加率为14.26%、年增加量为1.80 mg/kg。本研究阐明了酱油中内源性苯甲酸本底值与生成途径,将为零添加酱油的市场监管提供基础数据,为酱油行业有序发展提供基础支撑。
