基于染料Genefinder和适配体的荧光传感 体系检测赭曲霉毒素A
2021-11-05叶志杰周鸿媛张宇昊
郭 婷,叶志杰,周鸿媛,张宇昊,2,马 良,2,
(1.西南大学食品科学学院,重庆 400715;2.西南大学生物学研究中心,重庆 400715)
目前,赭曲霉毒素污染农产品现象越来越严重,因此引起高度重视。2020年7月,爱尔兰食品安全局发布预警通报,赭曲霉毒素A(ochratoxin A,OTA)含量升高,立即下令召回一批小麦片。赭曲霉毒素是由曲霉属、青霉属的真菌产生的有毒次级代谢产物[1-2],常见的赭曲霉毒素有OTA、赭曲霉毒素B、赭曲霉毒素C,其中毒性最大且最受关注的是OTA,其广泛存在于粮食及其制品中,具有致畸、致癌、致突变等多种毒性,已被国际癌症研究机构列为2B类致癌物[3]。目前针对OTA的检测方法主要包括色谱法[4-7]、免疫法[8-10]。 其中色谱法准确度高,但样品前处理复杂,需昂贵的大型仪器、专业人员操作,仅适合实验室操作,无法达到目前食品安全快速检测的要求。免疫法作为快速检测方法,具有操作简单、灵敏度高、检测快的特点,但是其核心元件是抗体,存在制备时间长、稳定性差、不易保存、假阳性等问题。
近年来,生物传感器法因其微型、智能、多功能等特点,受到越来越多的关注。目前生物传感器已被广泛应用于临床诊断、食品分析、生物监测等方面[11-13]。生物传感器的核心部件分别为识别、传感元件。传统的识别元件是生物抗体等活性物质,由于其稳定性问题限制了传统生物传感器的进一步推广与应用。而适配体技术可有效解决上述问题。适配体为对目标物具有高特异性结合能力的DNA或RNA[14-16]。与抗体相比,适配体可体外合成,且制备价格低,稳定性好,以适配体为识别元件的生物传感器在食品安全检测领域有巨大的应用潜力。Zhang Jing等[17]采用AgPt双金属纳米粒子修饰的金属有机框架构建适配体电化学传感器检测OTA,检出限(limit of detection,LOD)为14 fg/mL。Li Yapiao等[18]采用荧光标记探针开发具有信号关闭或信号打开的竞争性荧光各向异性方法测定OTA。Zhu Weiran等[19]构建可同时检测OTA和AFB1的比色传感器,该传感器对OTA的检测范围为0.5~80 ng/mL,对AFB1的检测范围为5~250 ng/mL。Ma Liang等[20]开发基于磁性石墨烯的荧光传感器检测展青霉毒素,荧光染料FAM修饰的适配体通过静电相互作用吸附在磁性石墨烯表面,磁性石墨烯与FAM染料发生能量共振转移现象,染料的荧光被强烈猝灭,加入展青霉毒素时,适配体识别展青霉毒素,并与其形成一定的结构,从而从磁性石墨烯表面释放,荧光强度恢复,根据荧光强度的变化检测展青霉毒素。
Genefinder染料是花青素类的染料,具有安全环保、毒性低、灵敏度高等特点[21-22]。该染料与双链DNA作用后荧光会增强800~1 000 倍,因此其常用于电泳中核酸染色[22-23],而检测方面的应用鲜见报道[22]。因此,本研究以适配体为识别元件,荧光染料Genefinder为传感元件,采用荧光染料特殊的荧光特性构建荧光传感体系,实现快速、高灵敏检测OTA。检测原理图如图1所示,首先OTA适配体与其互补链形成双链结构,Genefinder染料与此双链结构DNA结合后产生较强的荧光信号,然后加入毒素OTA,适配体与OTA结合形成四链体结构,双链打开,Genefinder染料荧光强度降低。根据荧光强度的改变检测目标物OTA含量。
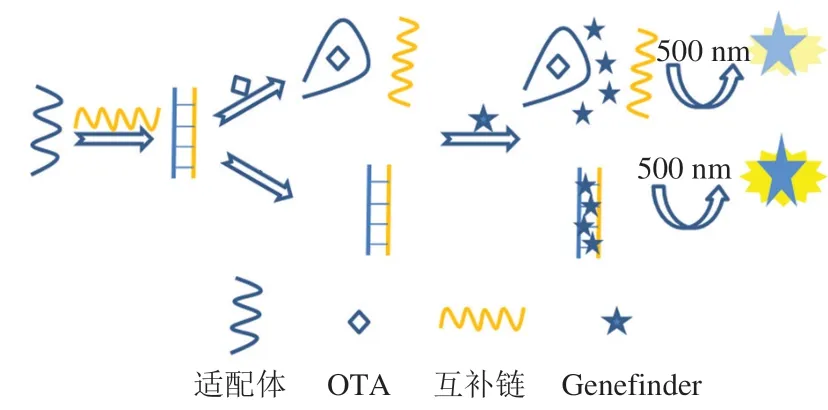
图1 传感体系的检测原理图Fig. 1 Schematic diagram of the sensing system
1 材料与方法
1.1 材料与试剂
红酒购于本地超市。
OTA适配体(5’-GATCGGGTGTGGGTGGCGTAAA GGGAGCATCGGACA-3’)[24]及其互补链(5’-TGTAAGA TGCTCACTTTATAACACTCACACTAGATC-3’) 生工 生物工程(上海)有限公司;染料Genefinder 合肥 博美生物科技有限责任公司;OTA、黄曲霉毒素M1(aflatoxins M,AFM1)、黄曲霉毒素B1(aflatoxins B1,AFB1)、黄曲霉毒素B2(aflatoxins B2,AFB2)、黄曲霉毒素G1(aflatoxins G1,AFG1)、玉米赤霉烯酮(zearalenone,ZEN)、单端孢霉烯(trichothecenes-2,T-2)毒素标准品 美国Sigma公司。
1.2 仪器与设备
UV-2450紫外分光光度计 日本岛津公司;F-2500荧光分光光度计 日本日立公司;台式高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 DNA浓度测定
采用紫外-可见分光光度计测定适配体DNA在260 nm波长处的吸光度,依据朗伯比尔定律计算得DNA浓度,用10 mmol/L磷酸盐缓冲溶液(pH 7.4)将其配制成500 nmol/L DNA溶液,于-20 ℃备用。
1.3.2 荧光传感器构建
DNA母液解冻后,水浴90 ℃处理10 min,逐渐冷却至室温(退火)备用。研究孵育时间对传感器的影响。取50 μL 500 nmol/L OTA适配体与等体积等浓度互补链混合,再加入2.5 μL质量浓度1 mg/L的OTA溶液,孵育60 min后,加入2 μL Genefinder 100×,得到终体积500 μL、OTA适配体及互补链终浓度50 nmol/L、OTA终质量浓度5 μg/L的混合溶液,设定激发波长500 nm、发射波长529 nm测定其荧光光谱,无目标物、添加目标物时的荧光强度分别记为F0、F。
研究适配体浓度对传感器的影响。将一定浓度的OTA适配体与等体积等浓度互补链混合,再加入终质量浓度为5 μg/L OTA孵育60 min后,加入2 μL Genefinder 100×,测定荧光光谱。
1.3.3 荧光传感器性能分析
OTA适配体及其互补链退火后,将等体积等浓度的OTA适配体及其互补链混合(终浓度为50 nmol/L),再加入不同浓度OTA孵育60 min后,加入2 μL Genefinder 100×,测定荧光光谱。
OTA适配体及其互补链退火后,将等体积等浓度的OTA适配体及其互补链混合(终浓度为50 nmol/L),再分别加入5 μg/L OTA,10 μg/L T-2、ZEN、AFB1、AFB2、AFM1、AFG1及混合毒素(5 μg/L OTA与10 μg/L T-2、ZEN、AFB1、AFB2、AFM1、AFG1混合)孵育60 min后,加入2 μL Genefinder 100×,测定其荧光值。
1.3.4 实际样品中OTA的检测
向红酒样品中加入一定量OTA,分别配成质量浓度为2、5、10 μg/L的阳性样本。将红酒样于室温、15 000 r/min离心5 min取上清液,稀释100 倍后,按照构建的荧光传感体系检测OTA。
1.4 数据处理
运用Excel软件分析数据,运用Origin软件制图。
2 结果与分析
2.1 传感体系的检测原理
以OTA为研究对象,其适配体为识别元件,Genefinder为传感元件构建荧光传感体系。以500 nm为激发波长,从图2可知,仅有OTA溶液的条件不产生荧光信号,因此不影响荧光传感体系的准确度。OTA适配体及互补链分别与染料Genefinder作用后产生较微弱的荧光信号。适配体、互补链混合后再加入Genefinder,荧光强度明显增强,其原因为适配体与互补链形成了双链结构,Genefinder与双链结构作用产生较强的荧光。适配体、互补链混合体系中再次加入OTA后,适配体与OTA形成四链体结构,导致双链打开,荧光强度降低。因此,可通过检测荧光信号强度与体系中OTA质量浓度的关系,定量检测OTA。
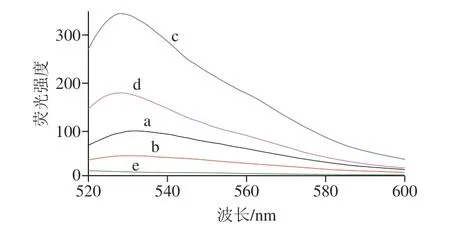
图2 不同条件的荧光强度Fig. 2 Fluorescence intensity under different conditions
2.2 传感体系的构建
2.2.1 孵育时间
适配体对目标物的识别需要一定时间,孵育时间过短可能造成部分适配体未能识别目标物。因此本实验研究10~120 min孵育时间对荧光信号的影响。孵育时间与荧光信号强度的关系见图3,结果表明,10~60 min内随着孵育时间的延长,荧光猝灭量逐渐增强,适配体与OTA孵育60 min,荧光猝灭量达到最大,60 min后荧光猝灭量无明显变化,说明孵育时间为60 min时,体系中OTA适配体与OTA的结合已饱和。因此,选择孵育时间60 min进行后续实验。
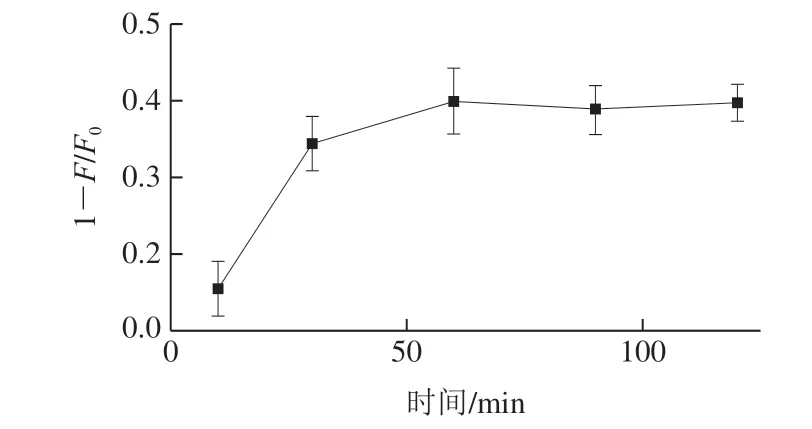
图3 孵育时间对荧光强度的影响Fig. 3 Effect of incubation time on fluorescence intensity
2.2.2 适配体浓度
如图4所示,随着OTA适配体浓度的增加,荧光猝灭强度也逐渐增加,适配体浓度为50 nmol/L时达到平衡。为了满足实验需求、节约成本,后续实验适配体浓度选择50 nmol/L。
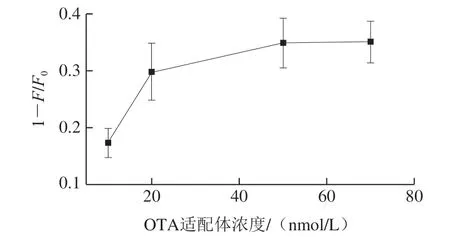
图4 适配体浓度对荧光强度的影响Fig. 4 Effect of aptamer on the fluorescence intensity
2.3 荧光传感体系的性能分析
2.3.1 荧光传感体系与OTA质量浓度的线性关系
在最佳的实验条件下,构建荧光传感体系,考察荧光传感体系对不同质量浓度OTA的荧光响应情况。如 图5A所示,随着OTA质量浓度的增加,荧光强度逐渐减弱,其原因为OTA的加入破坏双链结构。从图5B可知,OTA质量浓度在50 pg/L~300 ng/L范围内,1-F/F0与OTA质量浓度的对数呈线性,线性方程为y=0.121lgx+0.542(R2=0.996),该传感体系的实际LOD为50 pg/L,结果表明该荧光传感体系具有较高的灵敏度。从表1可知,与近年来检测OTA的荧光传感方法相比,该方法仍然具有一定的竞争力。
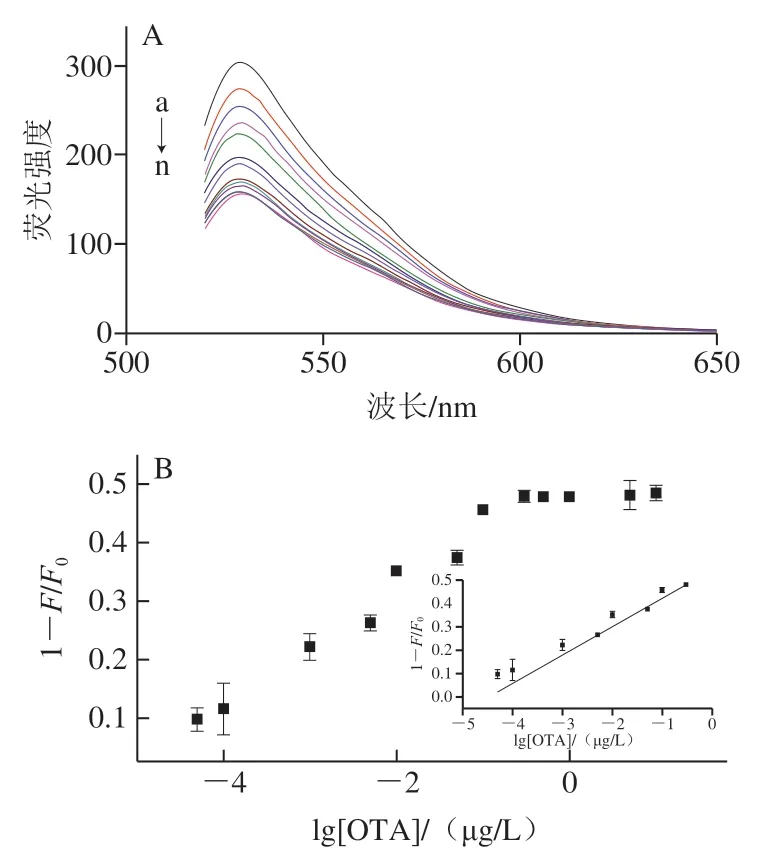
图5 不同质量浓度OTA对所构建传感体系荧光响应变化(A)及 1-F/F0与OTA质量浓度对数的线性关系(B)Fig. 5 Fluorescence spectra of the sensor with different concentrations of OTA (A) and influence of OTA concentration on fluorescence intensity (B)
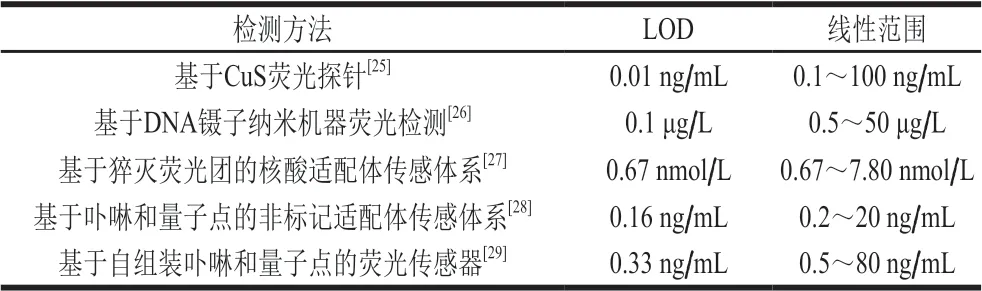
表1 OTA的荧光检测方法的LOD和线性范围Table 1 LODs and linear ranges of fluorescent methods for OTA detection
2.3.2 荧光传感体系的选择性
以AFB1、AFB2、AFM1、AFG1、ZEN、T-2为样本考察该传感体系的选择性。实验中OTA质量浓度为5 μg/L,对照毒素质量浓度均为OTA的2 倍。如图6所示,加入OTA后荧光传感体系的荧光强度猝灭量最大,这是因为传感体系中使用的适配体与OTA可以特异性结合,而与其他毒素无明显作用。另外,研究OTA与其他对照毒素共存时荧光传感体系的性能,结果表明其他毒素对传感体系并无明显影响,说明该传感体系对OTA具有较好的选择性。
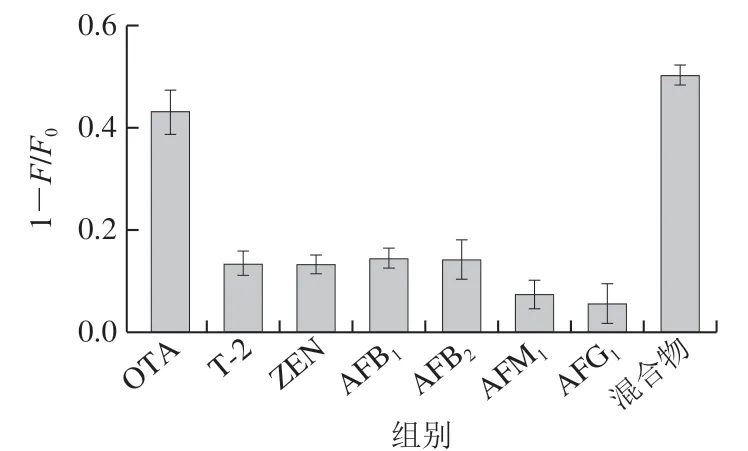
图6 荧光传感体系的选择性Fig. 6 Selectivity of the sensing system
2.4 实际样品测定
为了考察传感体系实际测定效果,以红酒作为实际阴性样品,研究加标回收情况。如表2所示,采用传感体系检测的加标回收率在101.9%~105.6%的范围内,这说明该荧光传感体系可用于测定真实样品中的OTA。
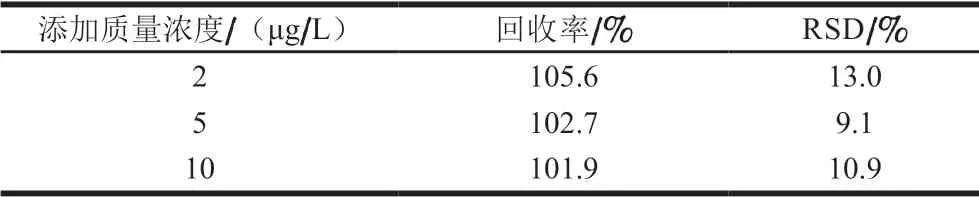
表2 实际样品加标回收率(n=3)Table 2 Spike recoveries for real sample (n= 3)
3 结 论
本实验构建简单的基于染料Genefinder和适配体的荧光传感体系,可用于高灵敏度、高特异性检测OTA。在最优条件中,该荧光传感体系的线性范围50 pg/L~ 300 ng/L,实际LOD为50 pg/L。实际样品检测效果理想,说明本传感体系在食品安全检测中具有较强实用性,为开发简单、快速、灵敏和高选择性的食品安全生物传感体系提供了新的思路。
