银杏叶提取物对瓣膜间质细胞钙化的保护作用
2021-11-05孔祥清
刘 静,孔祥清
南京医科大学第一附属医院心血管内科,江苏 南京 210029
钙化性主动脉瓣膜疾病(calcific aortic valve dis⁃ease,CAVD)是一种常见的心脏疾病。在65岁以上的成年人中,CAVD 导致心血管疾病的死亡率增加了大约30%;在75 岁以上的成年人中,死亡率增加了40%~50%[1-2]。该疾病的发展被认为是由内皮损伤、脂质沉积、炎性细胞浸润、细胞外基质(extracel⁃lular matrix,ECM)沉积和瓣膜新血管形成引起的,从而促进成骨和钙化[3]。迄今为止,尚无有效的药物可以治疗或者延缓CAVD的进展。华法林是维生素K 的拮抗剂,一直是抗凝治疗的主要药物[4]。华法林一方面通过抑制肝脏中的维生素K环氧还原酶发挥抑制凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ的合成,从而起到抗凝血的作用;另一方面,华法林还可以抑制维生素K 依赖蛋白基质Gla 蛋白(matrix Gla protein,MGP)的羧基化。羧基化MGP通过直接抑制骨形态发生蛋白(bone morphogenetic protein,BMP)2 和BMP4 的形成来防止钙化,是组织细胞钙化的重要抑制因子[5-6]。我们的前期研究已证实,治疗水平10 μmol/L的华法林和1.6 mmol/L的无机磷酸盐(Pi)可导致主动脉瓣间质细胞(aortic valve interstitial cell,AVIC)的钙化[7-8]。
大量的动物实验和临床研究表明,银杏叶提取物(ginkgo biloba extract,EGB761)对心血管疾病具有保护作用,包括抗氧化清除超氧化物、自由基和一氧化氮(nitric oxide,NO),抗血小板,减轻炎症和动脉粥样硬化斑块形成,调节包括NO和内皮素(en⁃dothelin,ET)在内的血管活性物质的合成,从而保护血管[8]。最近有研究表明,EGB761可显著减少β⁃甘油磷酸钠诱导的大鼠主动脉血管平滑肌细胞内钙的沉积,从而减轻血管钙化[10-11],但尚不清楚EGB761是否可以减轻AVIC钙化。
因此,本研究主要在猪AVIC培养的基础上,以治疗水平10 μmol/L 的华法林和1.6 mmol/L Pi诱导钙化模型,观察EGB761对猪AVIC钙化及成骨分化的作用及其机制。
1 材料和方法
1.1 材料
3 月龄实验用猪,雌性,体重20~30 kg,美国密西根州立大学动物实验中心提供。所有与动物有关的工作都得到了美国密歇根州立大学实验动物伦理委员会的批准。高糖DMEM 培养基(Gibco 公司,美国);华法林钠(Sigma⁃Aldrich 公司,美国);重组人骨形态发生蛋白⁃2(human recombinant BMP2,rhBMP2,广州赛业生物科技有限公司);茜素红(Sig⁃ma⁃Aldrich 公司,美国);CCK⁃8 试剂盒(Dojindo 公司,日本);钙离子检测试剂盒(CA590,Randox公司,英国);BCA蛋白定量试剂盒(ThermoFisher 公司,美国);碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒(Bioassay Systems 公司,美国);Msx2抗体、pSmad1/5 抗体(Abcam 公司,美国);Runx2 抗体、BMP2 抗体、GAPDH 抗体(Cell Signaling Technology公司,美国);Alex Fluro700 荧光标记二抗(Thermo⁃Fisher 公司,美国);ABI QuantStudio 7 Flex Real⁃Time PCR System(Applied Biosystems 公司,美国);Odyssey®CLX imaging system(Li⁃cor Biosciences 公司,美国)。
1.2 方法
1.2.1 猪AVIC的分离和培养
取心脏放入含5%双抗的预冷PBS 溶液。沿主动脉瓣环自根部约20%处将主动脉瓣3个瓣叶从根部剪下,放入预冷PBS 中反复漂洗。将剪碎的主动脉瓣置入胶原酶Ⅱ消化液,37 ℃水浴搅拌消化10~15 min,收集上清,加入10%胎牛血清的DMEM培养液,1 500 r/min 离心,去上清,加入高糖DMEM 培养液混悬沉淀;混匀液用一次性无菌细胞筛过滤后转入T25 细胞培养瓶中,37 ℃、5%CO2细胞培养箱继续培养;48 h后观察细胞贴壁情况并进行首次细胞换液;72 h 后,细胞生长密度达到80%融合时进行细胞传代,即为原代培养的第1 代。传代后取第3~5 代的细胞用于本实验的后续研究。
1.2.2 华法林诱导猪AVIC 钙化模型的构建及EGB761干预
高糖DMEM 培养基中加入1%的胎牛血清、1%青链霉素双抗、1.6 mmol/L Pi 以及10 μmol/L 华法林,4 ℃,避光保存待用。细胞贴壁融合达到80%时,用华法林钙化培养基处理AVIC,设为华法林处理组。EGB761干预组在华法林诱导钙化培养基中同时加入不同浓度的EGB761,共同孵育培养4~7 d。为了进一步验证EGB761 抑制瓣膜间质细胞成骨样分化的机制,设立rhBMP2 干预组,将100 ng/mL rhBMP2[12]同时加入到华法林诱导钙化培养基和EGB761中,共同孵育培养AVIC 4~7 d。
1.2.3 细胞活性检测
将AVIC 以8×103个/100 μL 接种于96 孔板中,待细胞达到80%融合时吸去完全培养基;细胞分为正常对照组、华法林处理组、不同浓度EGB761干预组(华法林诱导钙化培养基+0.1、0.3、0.5、0.7 mg/mL EGB761),给予不同的培养基继续孵育细胞4~7 d。按照CCK⁃8 试剂盒说明,向每孔加入10 μL CCK⁃8溶液,培养箱内孵育3 h,酶标仪测定450 nm处的吸光度。
1.2.4 茜素红染色
弃去培养板内培养基,用PBS 清洗3 次;4%甲醛溶液固定细胞10 min,PBS 清洗3 次;95%乙醇室温固定细胞20~30 min后,去离子水漂洗3遍;2%茜素红染色1 min,镜下观察到橘红色结节即终止染色,最长染色时间不超过5 min;2%茜素红的配制方法参照Gao等[7-8]的方法;去离子水洗净非特异性染色,镜下拍照。
1.2.5 细胞钙浓度测定
将12 孔板中培养的细胞用PBS 清洗3 次,每孔加入0.6 mol/L HCl 150 μL,4 ℃摇床24 h 脱钙处理。收集上清液,使用钙离子检测试剂盒测定钙浓度。每个样品取5 μL 加入96 孔板,加入200 μL 工作液,室温振荡5 min混合均匀,读取570 nm处吸光度。分别测量标准品及样品在570 nm处吸光值(A标、A样);继续加入EDTA,在样品变为无色时立即再次读取吸光值,得到A样/EDTA;计算细胞内绝对钙浓度(mg/dL)=(A标-A样/EDTA)/A标。将12 孔板中液体吸净弃上清,预冷的PBS 冲洗细胞;每孔加入100 μL 0.1 mol/L NaOH/0.1% SDS 裂解细胞,裂解液4 ℃13 000g离心20 min,取上清使用BCA 法测蛋白浓度。标准化钙浓度(μg/mg 蛋白)=绝对钙浓度/蛋白浓度。
1.2.6 细胞ALP活性检测
将12孔板中培养液吸净,用预冷的PBS清洗;各孔添加200 μL 0.05%的Triton X⁃100,反复冻融3次。收集每孔中液体,4 ℃15 000 r/min离心15 min,取上清液作为待测样品。使用ALP活性检测试剂盒,向96孔板内添加20 μL待测样品和180 μL工作液,工作液按每200 μL 分析缓冲液加入5 μL 醋酸镁和2 μL pNPP底物缓冲液的比例进行配制,轻轻震荡混匀。读取t0(0 min)和t(4 min)时波长405 nm 处的吸光值:ODt0、ODt及对照OD校准和OD水。根据公式计算待测样品的ALP活性(U/L)=[(ODt-ODt0)×200]/[(OD标准-OD水)×200×4]×35.3。标准化细胞内ALP活性(U/mg蛋白)=细胞内绝对ALP活性/蛋白浓度。
1.2.7 Real⁃time PCR
Runx2、Msx2 以及BMP2 引物设计合成由美国IDT 公司 完成。Runx2 上游引物5′⁃GGACGAG⁃GCAAGAGTTTCAC⁃3′,下游引物5′⁃GTGGATTA⁃AAAGGACTTGGTGC⁃3′;Msx2上游引物5′⁃CTGGT⁃GAAGCCCTTCGAGAC⁃3′,下游引物5′⁃AGGGCT⁃CATATGTCTTGGCG⁃3′;BMP2 上游引物5′⁃GGAGC⁃TAGCACTGAGCGAC⁃3′,下游引物5′⁃CGAAGT⁃GAGGAGCCCAAGTT⁃3′);GAPDH 上游引物5′⁃GTCGGAGTGAACGGATTTGGC⁃3′,下游引物5′⁃CTTGCCGTGGGTGGAATCAT⁃3′。根据CellAmpTMDirect TB GreenTMRT⁃qPCR Kit(TaKaRa 公司,日本)说明书直接进行逆转录。使用QuantStudio 7 Flex Real⁃Time PCR仪进行实时荧光定量PCR。所有荧光定量PCR反应均重复3次,目标基因标准化于管家基因GAPDH。采用2-ΔΔCt计算目的基因表达的相对值。
1.2.8 Western blot检测相关蛋白表达
使用NE⁃PER 核蛋白⁃胞浆蛋白专用抽提试剂盒(Thermo公司,美国)按照说明书提取蛋白。提取的蛋白用10%~15%SDS⁃PAGE 电泳,上样量50 μg,半干转膜,用5%脱脂奶粉溶液的TBST缓冲液封闭,一抗(BMP2、Runx2、Msx2、pSmad1/5)4 ℃孵育过夜,二抗室温避光孵育1 h,全程避光直接用Odyssey®CLX imaging system(Li⁃cor Biosciences 公司,美国)进行扫描。对扫描结果进行分析。
1.3 统计学方法
通过SPSS 23.0 软件进行分析,统计图通过Graphpad Prism 6.0 软件作图。所有计量数据以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析(one⁃way ANOVA),Bonferroni法进行多重比较检验。P<0.05表示差异有统计学意义。
2 结果
2.1 EGB761对AVIC活性的影响
与正常对照组相比,0.1 mg/mL 和0.3 mg/mL EGB761 干预组AVIC 的活性无明显统计学差异(P>0.05),而0.5 mg/mL 和0.7 mg/mL EGB761 干预组与正常对照组相比,AVIC 活性均明显减低,差异有统计学意义(P<0.05),提示高浓度的EGB761可能具备致细胞毒性作用(图1)。因此,本文选择0.1 mg/mL 和0.3 mg/mL 两种浓度的EGB761 进行后续研究。

图1 不同浓度的EGB761与华法林对AVIC活性的影响Figure 1 The effect of EGB761 on AVIC viability under warfarin treatment
2.2 EGB761对华法林诱导AVIC钙化的作用
茜素红染色结果显示,与正常对照组相比,华法林处理组可见明显的橘红色矿化结节,给予0.3 mg/mL 的EGB761干预处理后,橘红色矿化结节明显减少,而给予0.1 mg/mL EGB761 干预处理后,橘红色矿化结节未见明显减少(图2A)。细胞内钙含量测定结果显示,华法林处理组细胞内钙含量较正常对照组显著升高(P<0.05)。给予0.3 mg/mL EGB761干预处理后显著降低了细胞内钙含量(P<0.05),而0.1 mg/mL EGB761 干预处理后,细胞内钙含量相比较华法林处理组未见明显差异(P>0.05,图2B)。ALP 活性检测结果进一步显示,华法林显著增加了ALP 活性,0.3 mg/mL EGB761 干预处理组与华法林处理组相比,细胞内ALP 活性显著降低(P<0.05),而0.1 mg/mL EGB761处理组与华法林处理组相比,细胞内ALP 活性没有明显影响(P>0.05,图2C)。上述结果提示,0.3 mg/mL EGB761 可以减轻华法林诱导的AVIC 钙沉积,从而显著抑制了AVIC 的钙化。后续选择0.3 mg/mL EGB761进行成骨分化机制的研究。
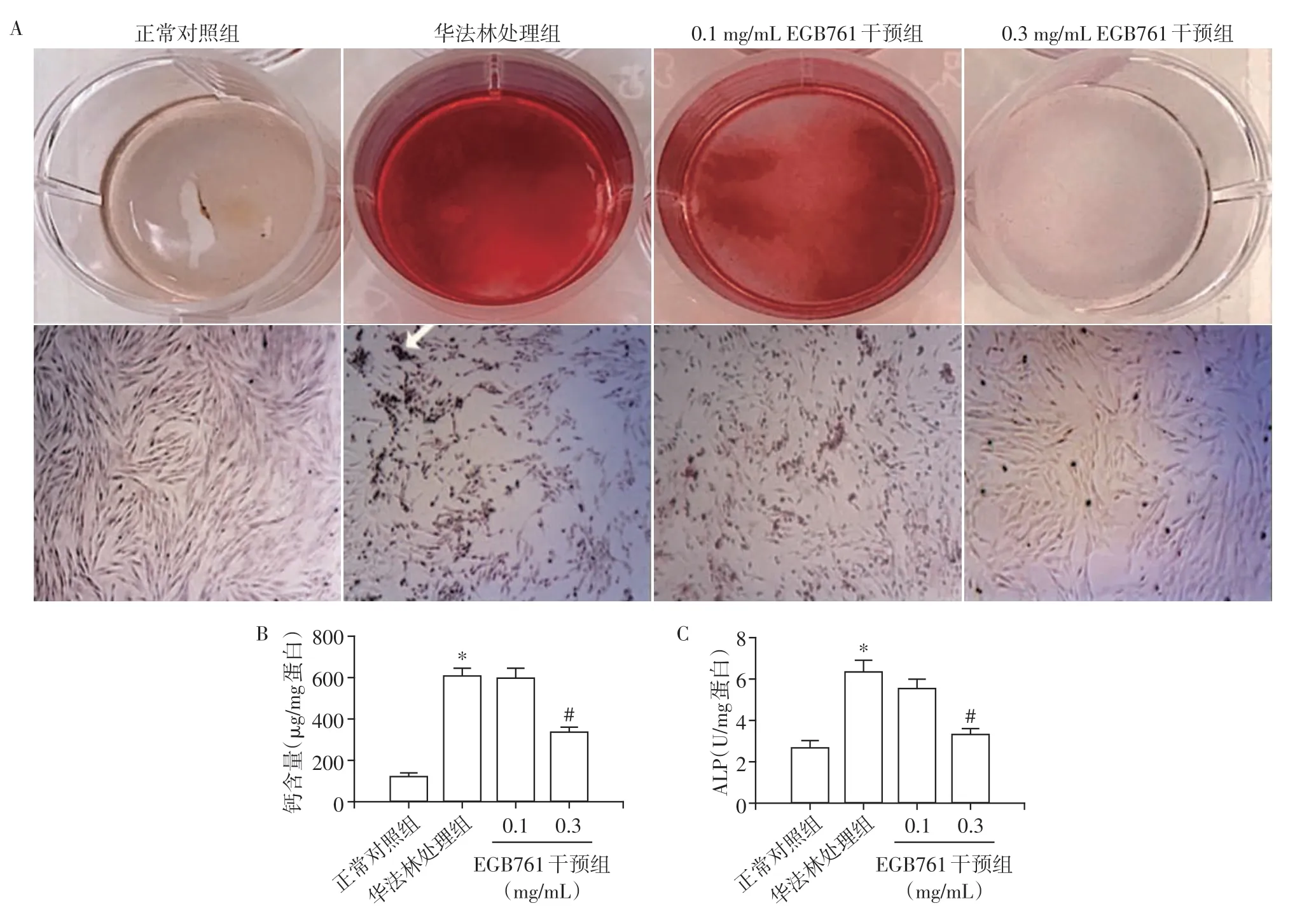
图2 EGB761对AVIC钙化的抑制作用Figure 2 The inhibition of EGB761 on calcification in AVIC
2.3 EGB761抑制华法林诱导AVIC的成骨分化
Real⁃time PCR和Western blot结果显示,华法林诱导AVIC成骨样分化标志蛋白Runx2、Msx2、BMP2的表达均明显增加(P<0.05),给予0.3 mg/mL EGB761 处理细胞后,Runx2、Msx2、BMP2 的表达均显著降低(P<0.05)。结果表明,EGB761 抑制了AVIC内成骨分化蛋白Runx2、Msx2 和BMP2 的激活,从而发挥了抗成骨分化的保护作用(图3)。
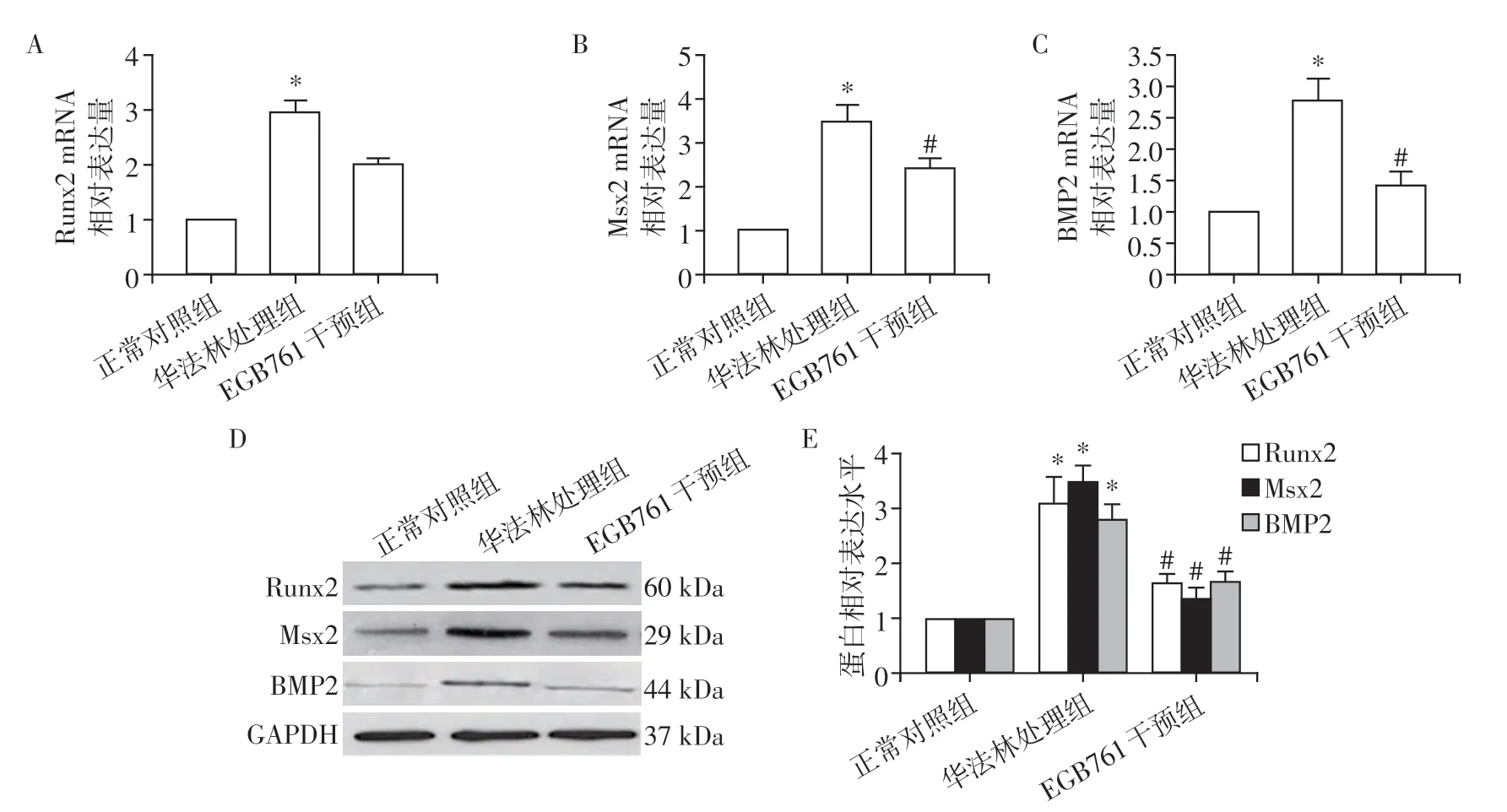
图3 EGB761对AVIC成骨分化的抑制作用Figure 3 The inhibition of EGB761 on osteogenesis differentiation in AVIC
2.4 EGB761 通过BMP2/Smad1/5/Runx2 通路抑制AVIC成骨样分化
将100 ng/mL rhBMP2 与EGB761 共同孵育pAVIC。茜素红染色、细胞内钙含量及ALP 活性检测结果显示,EGB761 显著降低了华法林诱导AVIC的钙沉积、钙含量及ALP 活性,而这一作用可以被rhBMP2 显著逆转(P<0.05,图4A~C)。Real⁃time PCR 结果显示,rhBMP2 上调了EGB761 抑制的Runx2 和Msx2 mRNA 表达(P<0.05,图4D、E)。Western blot 结果显示,rhBMP2 显著增加了被EGB761 抑制的Runx2 以及磷酸化Smad1/5 蛋白的表达水平(P<0.05,图4F)。结果表明,EGB761 可能通过抑制磷酸化Smad1/5,抑制Runx2 的表达上调,从而发挥抑制AVIC成骨样分化的作用。
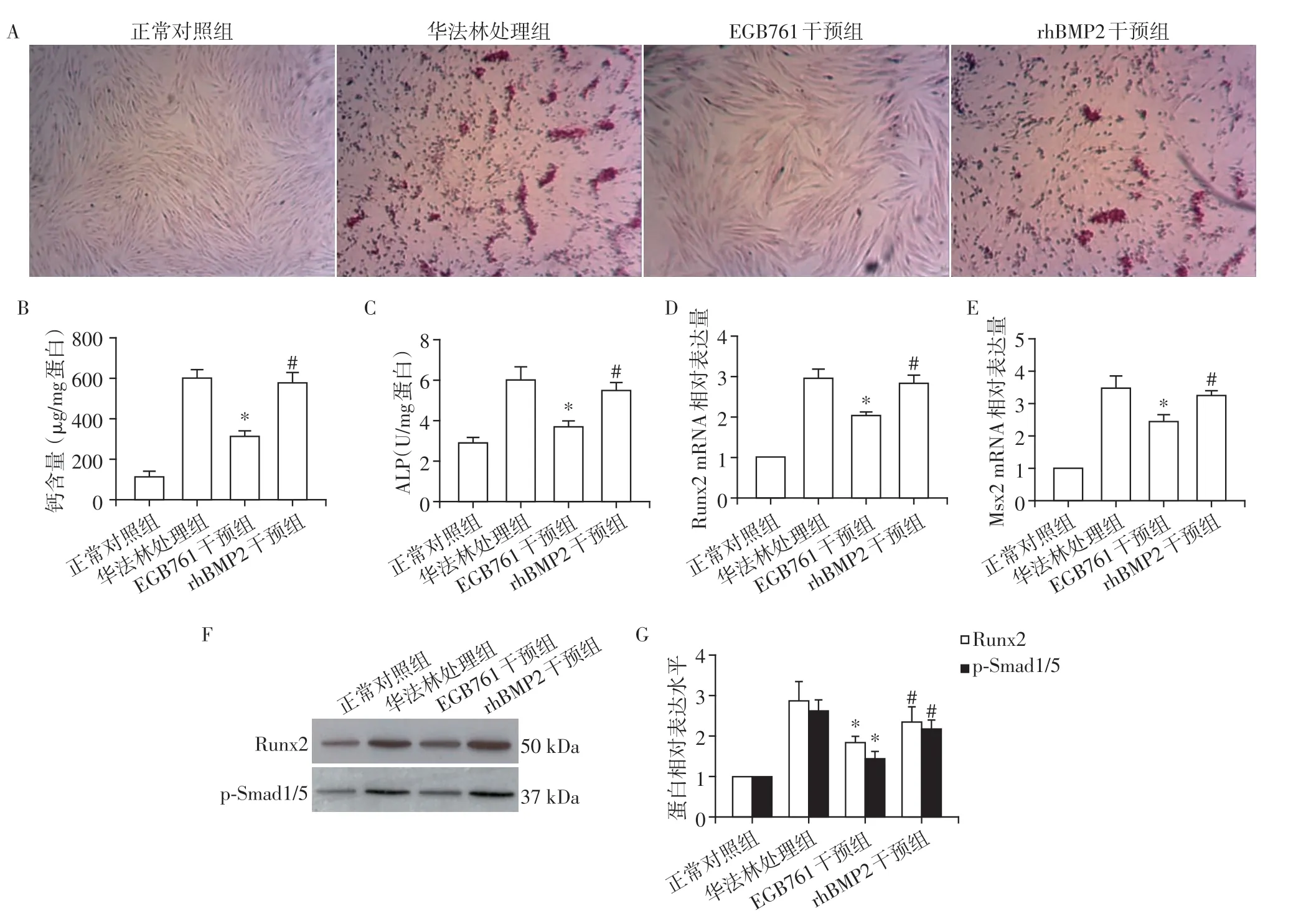
图4 EGB761通过BMP2/Smad1/5/Runx2通路抑制钙化和成骨分化Figure 4 EGB761 blocks calcification and osteogenesis differentiation by inhibition BMP2/Smad1/5/Runx2 signaling path⁃way
3 讨论
CAVD 涉及到主动脉瓣瓣叶进行性增厚、基质重塑以及钙盐沉积,从而导致瓣叶严重钙化、结构功能减退,最终发生瓣膜严重的狭窄和/或关闭不全[2]。随着研究的深入,CAVD 不再被认为是一个被动的、随着年龄的增长和钙沉积,瓣膜进行性退化的过程,而是一种“主动调控”的进行性疾病[13]。CAVD的发展过程包括慢性炎症、脂蛋白沉积、肾素⁃血管紧张素系统参与以及细胞外基质重塑,激活特定的成骨分化信号通路,参与瓣膜间质细胞从成纤维细胞/肌成纤维细胞转向成骨样细胞表型和细胞凋亡[14]。瓣膜间质细胞是主动脉瓣膜的主要细胞类型,在CAVD进展中起主要作用,它是目前探讨瓣膜钙化发生发展机制的主要方向[3],多项研究确定了瓣膜间质细胞具有成骨分化和钙化的能力[15]。
现有的研究证实多条信号通路均参与瓣膜钙化的病理过程,如BMP2/Smad1/5/8、NF⁃κB⁃RANKL、Wnt⁃β⁃catenin和p38⁃MAPK通路等[12]。众多学者对成骨因子BMP2/Smads/Runx2 信号转导通路进行了深入的研究。BMP2 通过结合靶细胞表面2 种丝氨酸/苏氨酸激酶受体(BMPR⁃Ⅰ,BMPR⁃Ⅱ)向胞内传递信号。首先BMP2 与细胞膜上BMPR⁃Ⅱ结合后,BMPR⁃Ⅰ能够特异性与此二聚体结合而发生自身磷酸。磷酸化的BMPR⁃Ⅰ再依次通过激活下游的一系列细胞内底物信号蛋白,这些蛋白统称为受体调节 的Smads(R⁃Smads),包 括Smad1、Smad5 和Smad8。被磷酸化激活的Smad1 或Smad5 与Co⁃Smads(Smad4)结合形成复合物后由胞浆进行核转位进入细胞核,调节各种靶基因的转录包括Runx2和Msx2等,共同参与各种成骨细胞表型基因表达和分化[16]。用外源的BMP2,如rhBMP2,可以启动该信号通路,激活Smads 复合物,在特异性转录因子Runx2的参与下调节下游靶基因的表达。
EGB761 是一种标准化的提取物,含有24%的黄酮糖苷和6%的萜烯内酯,如银杏内酯A、B、C、J和白果内酯。类黄酮具有清除自由基的作用,而萜烯内酯则保护线粒体膜免受自由基的破坏[17]。研究报道,EGB761 可以稳定由于过量线粒体氧自由基和过氧亚硝酸盐引起的线粒体膜电位的变化,并有助于防止离子稳态的破坏,起到抗氧化的作用。此外,还有学者发现,EGB761可以显著降低β⁃甘油磷酸诱导的大鼠主动脉平滑肌细胞钙沉积,还抑制成骨分化,这可能与减少ALP的表达有关;此外,它还下调NF⁃κB活性,并减少血管平滑肌细胞氧自由基的产生,有潜力作为临床上预防和治疗血管钙化的一种手段[10-11]。
本研究使用国际上认可的体外诱导瓣膜间质细胞钙化模型[7],即治疗水平(10 μmol/L)的华法林联合低剂量的Pi处理瓣膜间质细胞,在此基础上给予EGB761共同干预处理钙化的瓣膜间质细胞。本研究结果提示,EGB761 可以明显抑制华法林诱导的瓣膜间质细胞的钙含量,下调ALP 活性,从而减少细胞内钙结节形成。Real⁃time PCR 和Western blot的结果均进一步提示,EGB761抑制了华法林诱导的瓣膜间质细胞成骨分化,Runx2、Msx2 以及BMP2的mRNA 表达和蛋白表达量均显著降低。给予rhBMP2 进一步验证了上述结果,EGB761 降低了华法林诱导瓣膜间质细胞的钙沉积、钙含量及ALP活性,下调了参与瓣膜间质细胞成骨分化的基因表达,这一作用可以被rhBMP2 显著逆转。Western blot 结果进一步证实了EGB761 抑制了Smad1/5 磷酸化及Runx2 的表达上调,可能与抑制了BMP2/Smad1/5/Runx2 通路有关,其机制可能是EGB761 减少了BMP2 的表达,使BMPR⁃Ⅰ和BMPR⁃Ⅱ激活减少,抑制了Smad1/5 复合物磷酸化后由胞浆转位进入细胞核,从而进一步抑制了调节各种靶基因的转录包括Runx2和Msx2的表达。
综上所述,本研究首次证实,EGB761 可能通过减少BMP2的表达抑制Smad1/5磷酸化,阻止其由胞浆进入细胞核,从而抑制了Runx2和Msx2的表达上调,抑制了BMP2/Smad1/5/Runx2 信号通路的激活,缓解了瓣膜间质细胞钙化及成骨样分化。这一研究结果为将来临床防治钙化性主动脉瓣疾病提供了新的分子靶点及方向。
