肌醇依赖酶1内切酶活性抑制剂STF⁃083010对肝脏缺血再灌注损伤的保护作用
2021-11-05龚伟达
詹 峰,蒋 超,张 楷,龚伟达,王 荇,张 云
江苏大学附属宜兴医院肝胆腹腔镜外科,江苏 无锡 214200
肝脏缺血再灌注(ischemia⁃reperfusion,IR)损伤是肝部分切除术和肝移植术后常见的并发症,其发病机制复杂。该过程涉及到活性氧的释放,炎症细胞的激活,炎性介质的产生等诸多因素[1]。近年来的研究发现内质网应激(endoplasmic reticulum stress,ERS)反应能加重炎症反应,是导致肝脏缺血再灌注损伤的重要病理机制之一[2]。STF⁃083010 是肌醇依赖酶1(inositol⁃requiring enzyme 1,IRE1)核糖核酸酶特定抑制剂,可特异性阻断IRE1⁃剪切型X⁃盒结合蛋白1(spliced X⁃box binding protein 1,sXBP1)信号通路,有效降低sXBP1 的表达[3]。本研究旨在探讨STF⁃083010 预处理对肝脏缺血再灌注损伤的影响。
1 材料和方法
1.1 材料
30 只健康雄性C57BL/6 小鼠,6~8 周龄,体重15~20 g,购自南京医科大学实验动物中心,无特殊病原体(SPF)环境下饲养,自由进食、饮水。动物实验已获得动物伦理委员会的批准。STF⁃083010(Selleck 公司,美国);丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(北京达科为);TRIzol(南京诺唯赞)、肿瘤坏死因子(tu⁃mor necrosis factor,TNF)⁃α、白细胞介素(interleu⁃kin,IL)⁃6和IL⁃1β引物(Invitrogen公司,英国);逆转录试剂盒(TaKaRa 公司,日本);ChamQ 通用型SYBR Green qPCR Master Mix(南京诺唯赞);TUNEL染色试剂盒(武汉赛维尔);RIPA 裂解液(上海碧云天);sXBP⁃1抗体(Proteintech公司,美国)、转录因子C/EBP 同源蛋白(C/EBP⁃homologous protein,CHOP)抗体、GAPDH 抗体、兔源性二抗(CST 公司,美国);超敏ECL发光液(苏州新赛美)。
1.2 方法
1.2.1 动物模型
将30只小鼠随机分成3组,每组10只。①假手术组(sham组):小鼠仅接受腹腔麻醉和开、关腹操作;②肝缺血再灌注组(IR组):小鼠在建立IR 前30 min,按30 mg/kg 腹腔注射生理盐水;③STF⁃083010 预处理+肝缺血再灌注组(IR+STF⁃083010组):小鼠在建立IR 前30 min,按30 mg/kg 腹腔注射STF⁃083010。
肝脏缺血再灌注模型建立具体步骤:小鼠术前12 h禁食,不禁饮,5%水合氯醛腹腔注射,麻醉成功后,取小鼠腹部正中切口,用生理盐水棉签明确分离肝左、中叶后,使用无损伤血管夹夹闭通往肝左叶和肝中叶的肝蒂,此时可见缺血肝叶色泽改变,关腹。90 min 后,松开血管夹,缺血肝叶恢复血供,肝脏颜色转红,关腹。6 h 后处死小鼠,收取静脉血和肝脏组织,部分组织用4%甲醛固定,其余肝脏样本生理盐水冲洗后,液氮保存。
1.2.2 RNA提取和实时定量PCR
采用TRIzol 法提取组织和细胞RNA,并测定RNA 的浓度及纯度(NanoDrop 公司,美国)。首先按照反转录试剂盒说明书进行逆转录,所得cDNA进行实时定量PCR,反应使用SYBR qPCR Master Mix 试剂,并在ABI 7900 Fast Real⁃Time PCR system上进行。按照2-ΔΔCt法来计算相对表达量,实验重复3 次。
1.2.3 蛋白提取及Western blot
提取总蛋白时,使用含1%蛋白酶抑制剂和1%磷酸酶抑制剂的RIPA 裂解液裂解细胞。测定浓度后,按比例加入5×上样缓冲液,100 ℃水浴10 min。蛋白经SDS⁃PAGE 电泳分离后,将相应分子量的蛋白湿转至PVDF 膜上,然后在室温下用快速封闭液封闭10 min;分别加入一抗4 ℃孵育过夜,室温下二抗孵育2 h,TBST 洗膜后使用超敏ECL 曝光液成像分析,实验重复3次。
1.2.4 肝功能检测
取小鼠静脉血,3 000 r/min 离心10 min,收集上清。根据试剂盒说明测定血清ALT和AST水平。
1.2.5 肝脏组织病理学检查
取10%福尔马林溶液固定的肝组织,常规切片后,HE 染色,于光镜下观察肝小叶结构、肝细胞水肿及坏死的情况。
1.2.6 TUNEL染色观察细胞凋亡情况
根据TUNEL染色试剂盒说明操作,具体步骤为:用免疫染色固定液4%多聚甲醛固定细胞30~60 min;PBS洗涤2次,每次10 min;加入免疫染色强力通透液室温孵育5 min;PBS洗涤2次,每次10 min;在样品上加50 μL TUNEL 检测液,37 ℃避光孵育60 min;PBS洗涤3次;用抗荧光淬灭封片液封片后,于荧光显微镜下观察并拍照。
1.3 统计学方法
应用GraphPad7.0 软件对实验数据进行统计学处理。所有定量数据以均数±标准差()表示,多组间差异采用方差分析,组间差异两两比较采用SNK 法。P<0.05为差异有统计学意义。
2 结果
2.1 血清转氨酶水平变化
收取小鼠静脉血,测定各组小鼠血清ALT、AST水平。与sham组相比,IR组小鼠肝酶明显升高(P<0.01,图1);与IR组小鼠相比,IR+STF⁃083010预处理组小鼠血清ALT、AST水平显著降低,差异有统计学意义(P<0.01,图1)。

图1 STF⁃083010 预处理对缺血再灌注小鼠ALT 和AST的影响Figure 1 Effects of STF⁃083010 on ALT and AST in mice with liver ischemia/reperfusion injury
2.2 各组肝脏组织学改变
灌注6 h 后,收取小鼠肝脏标本行HE 染色。sham组小鼠肝脏组织排列正常,肝小叶结构清晰,肝细胞成条索状排列,无肝细胞坏死;IR组肝细胞排列紊乱,水肿明显,并可见大片肝细胞坏死(图2A);而IR+STF⁃083010IR组肝细胞呈轻度水肿,肝小叶结构基本完整,坏死肝细胞较IR组也明显减少。同样地,TUNEL染色也发现IR组肝细胞凋亡较sham组显著增加,而STF⁃083010预处理能明显减少肝细胞凋亡(图2B)。表明STF⁃083010 预处理能有效减轻小鼠肝脏缺血再灌注损伤。
2.3 各组肝脏IL⁃6、TNF⁃α、IL⁃1β表达量的变化
与sham组相比,IR组小鼠IL⁃6、TNF⁃α、IL⁃1β mRNA 水平明显升高(P<0.01,图3);IR+STF⁃083010组肝脏IL⁃6、TNF⁃α、IL⁃1β mRNA的表达水平较缺血再灌注组明显降低,差异有统计学意义(P<0.01,图3)。
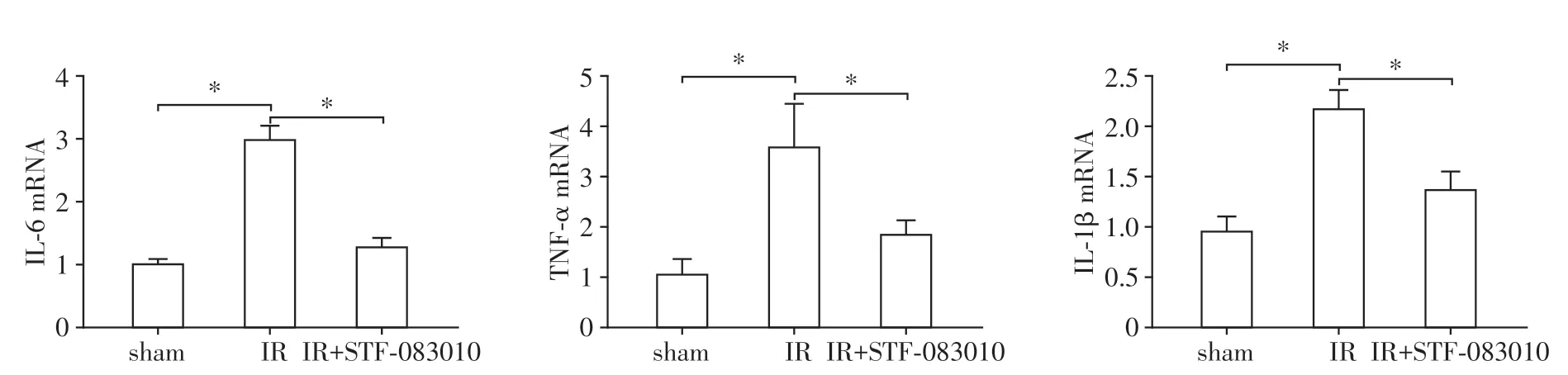
图3 STF⁃083010预处理对缺血再灌注小鼠肝脏组织中IL⁃6、TNF⁃α、IL⁃1β水平的影响Figure 3 Effects of STF⁃083010 on the levels of IL⁃6,TNF⁃α,IL⁃1β in liver with ischemia/reperfusion injury
2.4 各组肝脏sXBP1蛋白表达水平的变化
免疫组化染色发现sham组小鼠肝脏组织中仅有少量的sXBP1 蛋白表达,相比sham组,IR组中sXBP1蛋白的表达明显升高(图4A);STF⁃083010预处理则能显著降低缺血再灌注导致的sXBP1 和CHOP蛋白水平增高(图4B)。
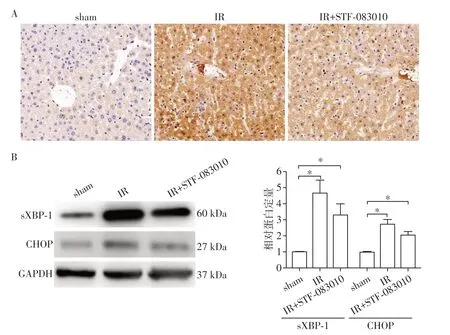
图4 STF⁃083010预处理对缺血再灌注小鼠肝脏组织中sXBP1、CHOP蛋白表达的影响Figure 4 Effects of STF⁃083010 on the expression of sXBP1 and CHOP in liver with ischemia/reperfusion injury
3 讨论
肝脏缺血再灌注损伤是一个极其复杂的病理生理过程,缺血过程会引起细胞内酸中毒、钙超载等;再灌注过程会导致活性氧释放、氧化应激、炎症反应等,最终导致肝细胞凋亡和坏死,进而出现肝功能不全,是影响肝移植、肝切除手术预后效果的主要因素之一[4-5]。因此,探索预防或减轻肝脏缺血再灌注损伤的相关研究,具有重要的临床意义。
近年来的研究表明,ERS 与IR 损伤密切相关,ERS 可通过激活经典的未折叠蛋白反应(unfolded protein response,UPR)抑制错误蛋白质翻译和/或指导错误蛋白质进行正确折叠修饰,进而减轻细胞应激损伤。在应激早期,细胞能迅速启动生存途径,降低内质网负荷,并维持其稳态。当内质网受到长时间的刺激或刺激强度过大时,内质网内大量错误蛋白或未折叠蛋白超过了细胞生存途径所能处理的范围,将使内质网内的稳态遭到破坏,引起内质网持续性应激,激活CHOP等介导的细胞凋亡程序,导致细胞凋亡[6-7]。
经典的ERS 有3条信号通路,即蛋白激酶样内质网激酶(PKR⁃like ER kinase,PERK)/真核翻译起始因子2α(eukaryotic translation initiation factor⁃2α,eIF2α)、IRE1/sXBP1、转录激活因子6(activating transcription factor 6,ATF6)。其中,IRE1⁃sXBP1 通路是ERS 中最为经典和保守的通路[8]。IRE1 在决定细胞在ERS 状态下应对各种刺激的转归中扮演重要角色[9-10]。IRE1磷酸化活化后可激活其具有核酸内切酶活性的RNase 结构域,特异性地剪切XBP1 mRNA,促进剪接形式的XBP1 蛋白即sXBP1表达。sXBP1 是强效转录因子,也是ERS 中重要的效应分子,它能进一步促进下游信号分子CHOP等的表达,导致细胞凋亡,加重炎症损伤[11]。薛强等[12]研究发现使用短发夹RNA干扰XBP1能有效减轻肝移植时的缺血再灌注损伤。STF⁃083010 是一种新型IRE1⁃sXBP1 通路特异性抑制剂,在不影响IRE1 激酶活性的情况下,特异性抑制IRE1的核酸内切酶活性,从而抑制XBP1 mRNA 剪接,降低sXBP1 蛋白表达[13]。最近研究显示其在多种肝脏损伤中具有保护作用。Lebeaupin 等[14]报道STF⁃083010 可以缓解高脂饮食诱导的小鼠非酒精性脂肪肝病,其机制与NOD样受体家族核苷酸结合寡聚化结构域样受体3(NOD⁃like receptor family pyrin domain containing 3,NLRP3)炎症小体激活及细胞死亡相关。Chen等[15]研究显示STF⁃083010改善四氯化碳诱导的肝损伤,并上调miR⁃122 表达,进而缓解肝脏纤维化。本课题组的前期研究发现STF⁃083010 可以通过阻断IRE1⁃sXBP1 信号通路,激活自噬信号,减轻硫代乙酰胺(thioacetamide,TAA)引起的小鼠肝脏损伤[16]。徐璐等[17]的研究发现STF⁃083010 可以减轻大鼠肾脏缺血再灌注损伤,改善肾功能。然而,关于STF⁃083010 在肝脏缺血再灌注中作用的研究尚未见报道,本研究结果显示STF⁃083010能显著降低小鼠缺血再灌注肝脏组织中sXBP1、CHOP 蛋白的表达,抑制ERS相关炎症和凋亡通路,对小鼠肝脏缺血再灌注损伤具有保护作用。
综上所述,本研究显示STF⁃083010对小鼠肝脏缺血再灌注损伤具有保护作用,其机制可能与抑制ERS 相关凋亡通路有关。提示STF⁃083010 有可能在肝脏外科的临床中有其应用价值,有望为肝缺血再灌注损伤的防治提供一个新的干预靶点。
