血清碱性磷酸酶水平预测维持性血液透析患者冠状动脉钙化
2021-11-05盛燕辉
郭 静,曾 鸣,张 浩,王 军,盛燕辉,刘 静*
1南京医科大学第一附属医院心血管内科,2肾内科,3影像科,江苏 南京 210029
我国慢性肾脏病(chronic kidney diseases,CKD)患者人数高达1.3 亿[1],而心血管疾病(cardiovascu⁃lar disease,CVD)是CKD 患者最主要的并发症和死亡原因[2]。血管钙化尤其是冠状动脉钙化在CKD患者中普遍存在,在维持性血液透析(maintenance he⁃modialysis,MHD)患者发生率高达90%[3-4]。血管钙化可以导致高血压、充血性心力衰竭、心肌肥厚及心肌梗死,是CKD患者心血管事件和死亡的强烈预测因子[5]。目前CKD 患者血管钙化的机制尚未阐明,除了传统的危险因素如糖尿病、高血压、高血脂、炎症反应等,慢性肾脏病⁃矿物质与骨代谢紊乱(chronic kidney diseases⁃mineral and bone disorder,
CKD⁃MBD)被证实发挥重要作用[6]。本研究拟通过冠状动脉多层螺旋CT(multi⁃slice spiral computed to⁃mography,MSCT)检查,探寻维持性血液透析患者冠状动脉钙化的发生情况及其相关危险因素。
1 对象和方法
1.1 对象
纳入2018年3月—2020年3月在南京医科大学第一附属医院血液净化中心规律血液透析,且透析龄≥3 个月,年龄18~80 岁的患者共188例。排除标准:接受过冠状动脉搭桥术或者冠状动脉支架植入术、严重感染、肝功能异常、恶性肿瘤、活动性自身免疫性疾病、入选前1个月发生急性心血管事件。所有患者每周透析3次,每次4 h,使用聚砜膜透析器,血泵速度250~300 mL/min,透析液流量500 mL/min。透析液常规使用1.5 mmol/L 钙浓度,15例患者因高钙血症使用1.25 mmol/L 钙浓度。本研究通过南京医科大学第一附属医院医学伦理委员会批准,研究对象均知情同意。
1.2 方法
1.2.1 临床资料收集及实验室指标测定
收集患者年龄、性别、原发病、透析龄、体重指数(body mass index,BMI)、心血管病史、糖尿病史、高血压史、收缩压、舒张压等。实验室指标:血常规、肝肾功能、血脂、碱性磷酸酶(alkaline phospha⁃tase,ALP)、钙、磷、全段甲状旁腺激素(intact para⁃thyroid hormone,iPTH)和25⁃羟维生素D(25⁃hy⁃droxyvitamin D,25⁃VitD)。所有入组者均在透析上机前当日清晨空腹采上肢静脉血,立即送本院检验科,统一由生化室专人技师当日完成。
1.2.2 冠状动脉钙化积分的测定及分组
冠状动脉MSCT 检查由头向足侧扫描,从气管隆突至心脏膈面。冠状动脉成像采用增强扫描回顾性心电门控,根据患者的心率确定扫描方式。冠状动脉钙化积分(coronary artery calcification score,CACS)测定采用Agatston 评分,由2 位放射科医生独立进行,取2 个数值的均数作为最后评分结果。采用Siemens CaScoring软件分析,钙化斑块定义为病变的CT 密度≥130 HU,且面积≥1 mm2,关注的血管包括冠状动脉左主干、左前降支、左旋支、右冠状动脉,测量发生钙化病变的面积,乘以固定系数1(由最大像素密度决定),每个断层图像独立分析,将所有断层的钙化分数相加得到的总分即为此患者的冠状动脉Agaston 评分,代表以上关注血管的总钙化负荷。根据Rumberger 冠脉钙化程度分级法,将患者分为3组:轻度钙化组(CACS<100 分)、中度钙化组(100 分≤CACS<400 分)和重度钙化组(CACS≥400 分)。冠状动脉钙化定义为CACS>100 分。
1.3 统计学方法
采用SPSS 23.0 软件进行分析。正态分布定量资料用均数±标准差()表示,非正态分布定量资料用中位数(四分位数)[M(P25,P75)]表示,定性资料用频数(n)和百分比(%)描述。3组间计量资料符合正态分布者采用单因素方差分析(ANOVA)检验,不符合正态分布者采用非参数秩和检验;计数资料采用χ2检验。Spearman 相关分析用于分析CACS 与基线指标的相关性。将单因素线性回归中P<0.05的变量纳入多因素线性回归方程用于分析冠状动脉钙化的危险因素。受试者工作特征(re⁃ceiver operating characteristic,ROC)曲线分析血清ALP水平对CACS的预测价值。多因素Logistic回归分析评估ALP与冠状动脉严重病变的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料及冠状动脉钙化情况
188例患者纳入本研究,其中男103例,女85例,年龄(50±12)岁,透析龄(86±46)个月。原发病为:慢性肾小球肾炎114例,糖尿病肾病22例,高血压肾损害6例,尿酸性肾病5例,多囊肾14例,其他不明病因27例。冠状动脉钙化的发生率为54.8%(103/188),CACS 中位数为143(0,728)分。图1 是典型病例的冠状动脉MSCT 图像。根据CACS 分为3组,轻度钙化组占45.2%(n=85),中度钙化组占17.6%(n=33),重度钙化组占37.2%(n=70),组间在性别构成比、BMI、血压、血糖、血脂、血红蛋白(Hb)、血浆白蛋白(Alb)、总胆固醇(TC)、甘油三酯(TG)、天门冬氨酸氨基转移酶(AST)、血磷、钙磷乘积、25⁃VitD 等方面均无显著性差异。与轻度钙化组比较,重度钙化组年龄、透析龄、血清钙、iPTH、ALP 等指标显著增高(P<0.05,表1)。

表1 不同冠状动脉钙化积分组患者临床资料比较Table 1 Comparisons of clinical and laboratory parameters according to tertiles of CACS

图1 典型病例的冠状动脉MSCT图像Figure 1 Representative images of coronary artery calcification by MSCT
2.2 冠状动脉钙化的相关危险因素分析
Spearman 相关分析显示,MHD 患者CACS 与年龄(r=0.292,P<0.001)、透析龄(r=0.242,P=0.001)、收缩压(r=0.167,P=0.024)、血 钙(r=0.263,P<0.001)、iPTH(r=0.191,P=0.009)、ALP(r=0.171,P=0.019)呈正相关(P<0.05),与其他指标无相关性(P>0.05)。单因素线性回归分析示年龄(P<0.001)、透析龄(P=0.001)、收缩压(P=0.024)、血钙(P<0.001)、lgiPTH(P=0.009)及lgALP(P=0.019)与CACS 具有相关性,将以上变量引入多因素线性回归方程后结果显示只有ALP 与CACS 显著相关(P=0.012,表2)。
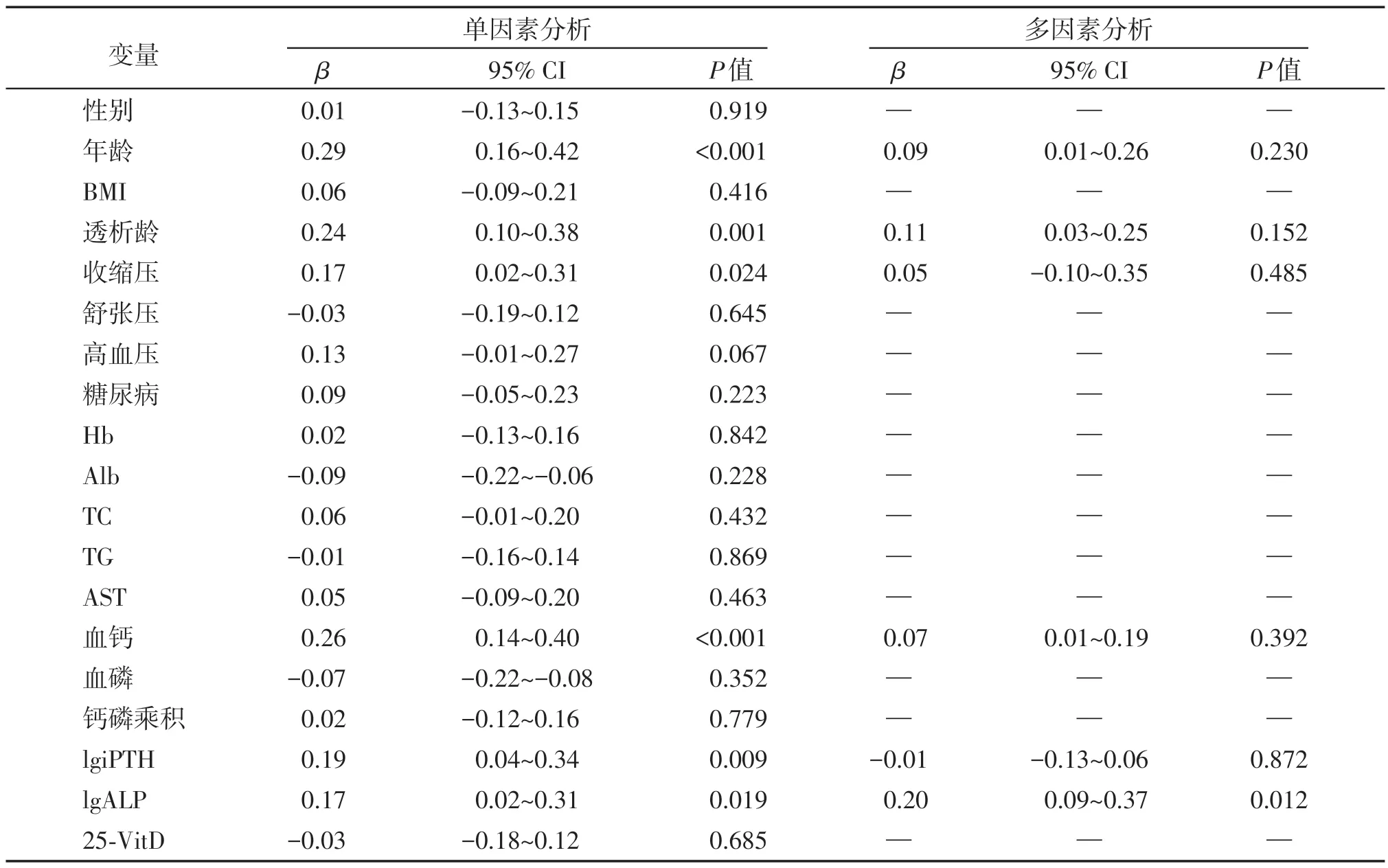
表2 冠状动脉积分的单因素和多因素线性回归分析Table 2 Univariate and multivariate linear regression analysis for CACS
2.3 ALP对MHD患者重度冠状动脉钙化的预测价值
ROC 曲线分析显示ALP 预测重度冠状动脉钙化的曲线下面积(AUC)为0.615(95%CI:0.529~0.700,P=0.009,图2),根据约登指数确定的最佳点临界值为226.5 U/L,灵敏度和特异度分别为52.9%和71.2%。多因素Logistic 回归分析显示ALP≥
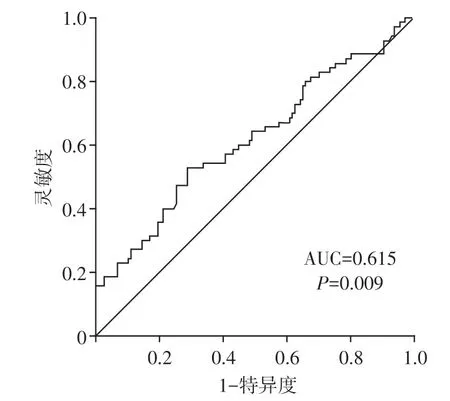
图2 血清ALP 预测重度冠状动脉钙化的ROC曲线Figure 2 ROC curve of serum ALP in predicting severe coronary artery calcification
226.5 U/L 的MHD 患者与ALP<226.5 U/L 患者相比发生重度冠状动脉钙化(CACS≥400)的比值比(OR)为2.77(95%CI:1.50~5.12,P=0.001)。经过年龄、透析龄、血钙及血iPTH多因素校正后显示ALP≥226.5 U/L 的MHD 患者与ALP<226.5 U/L 患者相比发生重度冠状动脉钙化的OR 为3.05(95%CI:1.30~7.18,P=0.011,表3)。

表3 血清ALP ≥226.5 U/L预测CACS≥400分的未校正OR及多因素校正后的OR及95%可信区间Table 3 Unadjusted and multilevel adjusted odds ratios and 95% confidence interval of having CACS≥400 in MHD pa⁃tients with serum ALP ≥226.5 U/L
3 讨论
终末期肾脏病(end stage renal disease,ESRD)患者发生CVD死亡的比例高达50%,其病死率与同年龄普通人群相比高15~30 倍[7]。而血管钙化是ESRD患者因CVD致死或致残的重要原因,是ESRD患者CVD事件发生和死亡的独立预测因子[3]。因此积极寻找血管钙化的早期标志物及干预靶点,对改善ESRD患者预后具有重要意义。
血管钙化在CKD患者中普遍存在,其中冠状动脉钙化的发生率比普通人群高2.5~5.0 倍[8]。有研究对742例中晚期肾脏病患者随访3 年,79%的患者出现不同程度的血管钙化,47%的患者出现重度钙化[9]。ESRD 患者随着肾功能的恶化发生冠状动脉钙化的范围更广,严重程度更高[10]。多层螺旋CT扫描进行Agatston 评分是测定CACS 的常用方法。有研究报道,规律血液透析患者冠脉钙化(CACS>100 分)的比例高达70%以上,其中CACS>1 000 者20.2%[10]。在本研究人群中冠状动脉钙化的发生率为54.8%,重度钙化(CACS≥400 分)的比例为37.2%。CACS≥400分是患者发生阻塞性心血管疾病及心血管死亡的风险显著增加的独立预测因子[11]。
ESRD 患者发生冠状动脉钙化的病因及其发病机制目前并不完全清楚。年轻透析患者中也同样普遍存在血管钙化,提示年龄、高脂血症、糖尿病等传统心血管危险因素并不是其发生的主要原因。近年来越来越多的研究显示矿物质和骨代谢异常(CKD⁃MBD)与CKD患者血管钙化密切相关,多种骨代谢相关因子参与调控了血管钙化的发生、发展[12]。血管钙化由一系列复杂的病理生理过程所致,其本质是血管平滑肌细胞向成骨细胞主动转化的过程[13],而血磷浓度增高是其最重要的始动因素[14]。本研究中发现血清ALP 是MHD 患者发生重度冠状动脉钙化的强烈预测因子。ALP是一组能降解蛋白质和核酸中磷酸盐的同工酶,广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织。ALP在肝脏和骨组织中富集,在肝功能正常情况下,血清ALP可以反映骨ALP的水平[15]。近年来研究显示ALP 参与血管钙化的发生发展。Lomashvili 等[16]发现血管损伤时组织非特异性碱性磷酸酶可引起无机焦磷酸盐的水解和失活。无机焦磷酸盐通过减少羟基磷灰石结晶生成从而抑制血管钙化[17]。动物模型进一步证实降低无机焦磷酸盐水平可以导致血管钙化的发生[17]。另外还有体外研究发现骨ALP 可以通过脱磷酸作用使钙化抑制因子骨桥蛋白(osteopontin)失活从而引起血管钙化[18]。血清ALP 水平在血液透析患者特别是高转运性骨病患者中高表达[19],其机制可能与升高的iPTH 相关。骨ALP 主要由成骨细胞产生并释放到血液中。在继发性甲状旁腺亢进症患者中,升高的iPTH 激活成骨细胞,并进一步激活破骨细胞,促进ALP 生成及骨吸收[20]。ALP 浓度不受肾功能影响,较iPTH更能准确地评估透析患者的骨转运状态。近年来研究显示血清ALP是血液透析患者全因死亡及心血管死亡风险的强烈预测因子[21]。既往有研究证实ALP 和透析患者的骨密度及腹主动脉钙化密切相关[22-23]。本研究发现,与钙、磷、iPTH等骨代谢相关因子相比,ALP 与血液透析患者冠状动脉钙化严重程度强烈相关。因此,ALP是MHD患者骨代谢紊乱导致的心血管疾病的重要预测因子。血清ALP的监测对及早识别ESRD患者心血管高危人群有重要意义。进一步深入了解ALP 参与血管钙化的作用机制为早期干预钙化形成,改善心血管预后提供了新的方向。
本研究存在一定的局限性。①入选的患者血清iPTH 水平整体偏高,导致血清ALP 值较高;②样本量较小,需要更大的样本量进一步验证其研究结果;③本研究为回顾性研究,需要进一步设计前瞻性的临床研究证实血清ALP 在规律血液透析患者中对冠状动脉钙化的作用。
综上所述,本研究发现年龄、透析龄、收缩压、血钙、iPTH、ALP 与MHD患者冠状动脉钙化密切相关,其中血清ALP是预测冠状动脉钙化最强烈的独立预测因子。ALP 有望成为MHD 患者血管钙化的理想预测指标及重要干预靶点。
