补骨脂富含的异戊烯基成分对CYP1A1活性的影响及分子对接验证
2021-11-02秦子飞王培乐邢晗韩立卞华杨晶张晓坚
秦子飞,王培乐,邢晗,韩立,卞华,杨晶,张晓坚
(1.郑州大学第一附属医院,河南 郑州 450052;2.河南省张仲景方药与免疫调节重点实验室,河南 南阳 473004;3.河南省精准临床药学重点实验室,河南 郑州 450052)
CYP1A1是一种重要的细胞色素P450酶,主要分布于肝脏、肠道等器官[1]。它可以通过结构中血红素的铁离子传递电子,氧化多环芳烃类物质、黄曲霉毒素等致癌物,在致癌物的活化和解毒过程中起着重要的作用[2]。此外,雌激素经CYP1A1氧化形成非致癌性的2-羟基雌激素,经CYP1B1催化生成致癌性的4-羟基雌激素。雌激素的氧化代谢产物具有DNA损伤效应,与多种肿瘤的发生有关,高4-羟基雌激素/2-羟基雌激素比值已经成为判断肿瘤形成的重要标志[3]。因此,CYP1A1在外源物清除及内源物水平稳态等方面发挥着关键调控作用。
补骨脂是我国常用传统中药,具有补肾壮阳、补脾健胃之功效,临床上常用于治疗骨质疏松、骨折等疾病[4-7]。香豆素、异戊烯基成分等是补骨脂的主要成分,也可能是其发挥药效的活性成分[8]。已有研究表明补骨脂所含的香豆素Bakuchicin(补骨脂素和异补骨脂素的结构类似物)能显著抑制CYP1A的活性,对CYP1A1和CYP1A2均表现出竞争性抑制作用,抑制常数Ki值分别为0.11、0.32 μmol·L-1[9]。此外,补骨脂富含的异戊烯基黄酮类成分的结构类似物6-Prenylnaringenin,可以通过作用于CYP1A1和CYP1B1,调节雌激素的羟基化代谢,进而起到植物雌激素样作用[10]。补骨脂富含的成分可能通过药物-药物相互作用或改变内源物代谢影响机体的生理状态。
目前,关于补骨脂富含的异戊烯基成分对CYP1A1的抑制活性评价未见报道,这也增加了其可能出现不良反应的风险。基于此目的,本实验将重点探讨补骨脂富含的异戊烯基成分对CYP1A1的抑制活性评价,并结合分子对接实验进行验证,以期发现补骨脂中具有抑制CYP1A1活性的小分子化合物,为临床解释补骨脂不良反应和合理使用提供科学依据。
1 材料
1.1 仪器
超高效液相色谱串联三重四级杆质谱联用(UHPLC-TQD-MS)仪:色谱系统为Waters ACQUITY I-Class超高效液相色谱仪(包括二元梯度泵,自动进样器和柱温箱),质谱系统为Waters TQD三重四级杆质谱,配套Masslynx 4.1数据处理系统;BP211D精密电子天平购于北京赛多利斯仪器系统有限公司;MTC-100恒温振荡器购于杭州米欧仪器有限公司;QL-861涡旋仪购于海门市其林贝尔仪器制造有限公司;3K-15高速冷冻离心机购于德国Sigma公司。
1.2 试剂与药品
补骨脂药材购于河南张仲景大药房,产自河南南阳,经王培乐博士和卞华教授鉴定为正品。补骨脂二氢黄酮、补骨脂定、异补骨脂查尔酮、异补骨脂二氢黄酮和补骨脂二氢黄酮甲醚(纯度>98%)均购于大连美仑生物技术有限公司(图1);氯化镁、NADPH、7-乙氧基试卤灵和试卤灵均购于美国Sigma-Aldrich公司;重组CYP1A1酶购于美国Corning公司;甲醇、乙腈和水均为色谱纯,购于北京迪科马科技有限公司;其他有机溶剂均为分析纯或以上。

图1 补骨脂富含的异戊烯基成分的结构
1.3 样品制备
取补骨脂粉末(过3号筛)约0.1 g,精密称定,置25 mL容量瓶中,加70%乙醇水溶液20 mL,超声30 min(30 ℃,100 kHz),待溶液冷却至常温,加70%乙醇水溶液,定容至刻度,摇匀,过0.22 μm微孔滤膜,取滤液即得。HPLC-UV法分析结果显示[11],异补骨脂二氢黄酮、补骨脂二氢黄酮、补骨脂定、异补骨脂查尔酮和补骨脂二氢黄酮甲醚含量分别为0.36、3.37、2.33、5.59、8.24 mg·g-1。分别精密称取适量补骨脂二氢黄酮、补骨脂定、异补骨脂查尔酮、异补骨脂二氢黄酮、补骨脂二氢黄酮甲醚标准品,加入容量瓶,加入适量甲醇溶液,配制成浓度为10 mmol·L-1的标准溶液。
2 方法
2.1 体外孵育体系
体外孵育体系包括Tris-HCl溶液(50 mmol·L-1,pH=7.4),氯化镁(5 mmol·L-1),底物(7-乙氧基试卤灵溶液),不同浓度抑制剂(补骨脂提取物或不同补骨脂异戊烯基成分)和CYP1A1溶液,将上述溶液混合后,在恒温(37 ℃)振荡器内,预孵育5 min,然后加入NADPH溶液(1 mmol·L-1),正式启动代谢反应[12]。孵育一定时间后,加入等体积的冰乙腈终止反应,将溶液涡旋30 s,13 800 r·min-1离心10 min,取2 μL上清液,进样UHPLC-TQD-MS分析。
2.2 抑制活性评价
7-乙氧基试卤灵(1 μmol·L-1)作为CYP1A1的探针底物,被用作评价补骨脂异戊烯基成分对CYP1A1活性的影响[12]。将7-乙氧基试卤灵分别与不同浓度补骨脂提取物(0、1、10、100 mg·mL-1)或不同补骨脂异戊烯基成分(0、1、10、100 μmol·L-1)混合孵育,以不加上述补骨脂相关成分为对照组,评价补骨脂及补骨脂异戊烯基成分对CYP1A1的抑制活性。
以不同浓度补骨脂提取物(0、1、2.5、5、10、20、25、50、100 mg·mL-1)及其异戊烯基成分(补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮浓度为0、0.1、0.2、0.4、0.8、1、10、20 μmol·L-1;异补骨脂二氢黄酮和补骨脂二氢黄酮甲醚浓度为0、1、2、4、8、10、20、40 μmol·L-1)对7-乙氧基试卤灵代谢的抑制活性为纵坐标,抑制剂的浓度为横坐标进行非线性拟合,得到各抑制剂对CYP1A1的IC50值。通常,IC50<1 μmol·L-1为强抑制活性;IC50在1~10 μmol·L-1之间为中等强度抑制活性;IC50>10 μmol·L-1,为弱抑制活性[12]。
2.3 抑制反应动力学评价
3种动力学模型包括竞争性抑制(方程1)、非竞争性抑制(方程2)和混合型抑制(方程3)。应用这3种模型对数据进行拟合,计算出各自的赤池信息量准则(Akaike information criterion,AIC)和施瓦茨信息准则(Schwarz criterion,SC)值,AIC和SC值越小,模型拟合越合适,同时获得相应合适的Ki值[12]。V代表反应速度;[S]和[I]分别是7-乙氧基试卤灵和不同补骨脂异戊烯基成分的浓度;Ki代表酶与不同抑制剂之间的亲和力;Km为米氏常数,是酶促反应达最大速度(Vmax)一半时的底物[S]的浓度;αKi是反映不同抑制剂与酶和相应底物复合物亲和力的参数;当α值远大于1时,不同抑制剂的结合阻碍了酶与底物的结合,混合抑制模型变为竞争抑制模型。
(1)
(2)
(3)
2.4 分析条件
色谱条件:BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),流动相为水(A)和乙腈(B)(二者均包含0.1%的甲酸),洗脱程序为0~0.4 min,10%B;0.4~1.4 min,10%~95%B;1.4~1.6 min,95%B;1.6~1.8 min,95%~10%B;1.8~2.0 min,10%B;流速为0.3 mL·min-1;柱温35 ℃;进样体积2 μL。质谱条件:电喷雾离子源(ESI);离子源毛细管电压3.5 kV;离子源温度350 ℃;脱溶剂气流速650 L·h-1;正离子多反应监测模式(MRM),代谢产物试卤灵的母离子→子离子对为214.050→186.020,锥孔电压为60 V,二级碎裂能为25 V。
2.5 分子对接
为进一步了解竞争性抑制成分(补骨脂二氢黄酮与异补骨脂查尔酮)与CYP1A1的相互作用机理,我们采用Autodock 4.2软件进行分子对接。从PDB蛋白晶体结构数据库中下载CYP1A1蛋白与选择性抑制剂α-萘黄酮的蛋白-配体结晶复合物(PDB:4I8V)[13-14],以此为模板,选择高精度对接模式,先将蛋白复合物中水分子和SO4等其他小分子配体去除,然后进行加氢处理,以配体α-萘黄酮所结合的口袋为参照自动生成结合活性口袋,其他参数如未加以说明,均按默认参数设置。然后将补骨脂二氢黄酮与异补骨脂查尔酮分别对接到上述活性口袋,利用可视化软件将对接后的配体-蛋白复合物进行作图,并标示在配体5 Å距离范围内的氨基酸残基。此外,应用拉马克遗传算法分别计算补骨脂二氢黄酮、异补骨脂查尔酮与CYP1A1结构对接的结合自由能,不同形式的对接结构对应不同的结合自由能,结合自由能越低表示该种对接结构越稳定,即最优结构[15];同时,我们还通过分析氢键与疏水作用揭示CYP1A1分别与补骨脂二氢黄酮和异补骨脂查尔酮的相互作用[15]。
2.6 数据处理
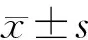
3 结果
3.1 补骨脂及其异戊烯基成分对CYP1A1活性的影响
如图2所示,当补骨脂提取物为10 mg·mL-1时,CYP1A1剩余的催化活性为对照组的62%,而当提取物浓度为100 mg·mL-1时,剩余活性仅为对照组的3%;通过数据拟合(图3),得到补骨脂提取物对CYP1A1的抑制IC50值为14.97 mg·mL-1,见表1。

图2 补骨脂提取物及5个异戊烯基成分 对CYP1A1的抑制活性
补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮对CYP1A1均表现出较强的抑制活性,当3者浓度均为1 μmol·L-1时,CYP1A1剩余的催化活性分别为对照组的21.2%、31.3%和26.1%(图2),随后计算得到IC50值分别为0.28、0.49、0.36 μmol·L-1(图3)。异补骨脂二氢黄酮和补骨脂二氢黄酮甲醚对CYP1A1表现出中等强度的抑制,即当2者浓度为1 μmol·L-1时,CYP1A1的剩余活性分别为61.3%和93.1%(图2),IC50值分别为2.24 μmol·L-1和4.07 μmol·L-1(图3)。
3.2 补骨脂异戊烯基成分对CYP1A1抑制机制
本研究仅对具有强抑制活性的补骨脂异戊烯基成分(补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮)对CYP1A1的机制进行深入探讨。根据最小AIC和SC值即为最佳抑制模型的原则(表1),补骨脂二氢黄酮和异补骨脂查尔酮对CYP1A1表现出竞争性抑制模式,而补骨脂定对CYP1A1表现出非竞争性抑制模式。此外,补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮对CYP1A1的Dixon图(图4)也为上述判断提供了强有力的证据。数据拟合得到的Ki值分别为0.12、0.59、0.23 μmol·L-1(表1)。

图3 补骨脂提取物及5个异戊烯基成分对CYP1A1的抑制曲线和IC50值

图4 补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮对CYP1A1介导的7-乙氧基试卤灵去乙氧基活性的抑制作用

表1 补骨脂异戊烯基成分对CYP1A1抑制作用的动力学参数
3.3 分子对接

图5 α-萘黄酮与CYP1A1的氨基酸残基相结合的活性位点(A)、氢键作用(B)与疏水作用(C)
3.3.1α-萘黄酮与CYP1A1的分子对接 通过分析活性位点发现,α-萘黄酮与CYP1A1氨基酸残基特异性结合的活性位点为Asp320、Phe224、Ser116、Ile386、Leu496、Thr497、Thr321、Ser122、Phe123、Ala317、Phe319、Gly316、Asp313、Ser120、Ile115、Leu312、Asn222、Asn255、Leu254和Phe258(图5A);此外,α-萘黄酮与CYP1A1氨基酸残基Ser116连接形成1个氢键,并与Phe224相连接形成1个π-π键(图5B);α-萘黄酮与CYP1A1的氨基酸残基Leu496、Thr321、Asp320、Ala317、Phe319、Phe224、Asp313、Phe258、Gly316、Ile115、Ser116、Asn255和Leu312相连接形成疏水作用(图5C)。α-萘黄酮与CYP1A1的结合自由能为-10.861 kcal·mol-1(1 kcal=4.2 kJ)。
3.3.2 补骨脂二氢黄酮、异补骨脂查尔酮与CYP1A1的分子对接 对接结果显示,补骨脂二氢黄酮与CYP1A1氨基酸残基特异性结合的活性位点为Phe123、Ser122、Phe319、Asp320、Thr321、Thr497、Val382、Leu496、Thr385、Ile386、Ala317、Phe224、Gly316、Asp313、Leu254、Leu312、Phe258、Asn255、Ile115、Ser116和Tyr259(图6A);补骨脂二氢黄酮与CYP1A1氨基酸残基Ser122相连接形成1个氢键,并与Phe123相连接形成1个π-π键(图6B);与CYP1A1氨基酸残基Asn255、Phe258、Ser116、Gly316、Phe224、Ala317、Thr497、Thr321、Val382、Leu496、Ser122、Ile386、Asp313、Phe123、Leu312和Ile115相连接形成疏水作用(图6C);补骨脂二氢黄酮与CYP1A1的结合自由能为-10.145 kcal·mol-1。
图6 补骨脂二氢黄酮与CYP1A1的氨基酸残基相结合的活性位点(A)、氢键作用(B)与疏水作用(C)
异补骨脂查尔酮与CYP1A1的氨基酸残基特异性结合的活性位点为Phe123、Tyr259、Phe258、Glu256、Ser116、Asn255、Leu254、Ile115、Ser122、Gly316、Asp313、Leu312、Asp320、Ala317、Phe319和Thr321(图7A);异补骨脂查尔酮与CYP1A1的氨基酸残基Asn255相连接形成1个氢键,并与Phe123相连接形成1个π-π键(图7B);而异补骨脂查尔酮与CYP1A1的氨基酸残基Asn255、Val382、Thr321、Ser122、Phe123、Ile115、Ser116、Phe258、Leu312、Gly316、Phe224、Ala317、Asp313、Ile386和Leu496相连接形成疏水作用(图7C)。异补骨脂查尔酮与CYP1A1的结合自由能为-8.286 kcal·mol-1。
3.4 补骨脂异戊烯基成分对CYP1A1活性的构效关系分析
根据异戊烯基成分的结构特征,我们发现,二氢黄酮类成分C环1位和2位开环形成查尔酮,会使CYP1A1的抑制活性稍微减弱;A环上C-6位或C-8位用异戊烯基基团取代,化合物对CYP1A1的抑制活性差异显著,以C-6位异戊烯基取代的化合物抑制活性更强;A环C-7位羟基甲基化也会显著降低CYP1A1的抑制活性。见图8。
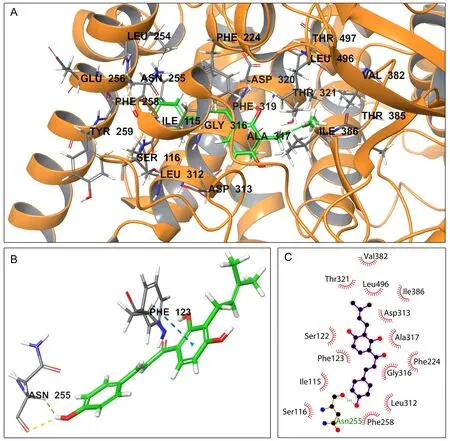
图7 异补骨脂查尔酮与CYP1A1的氨基酸残基相结合的活性位点(A)、氢键作用(B)与疏水作用(C)

图8 补骨脂异戊烯基成分对CYP1A1抑制活性的 结构选择性
4 讨论
补骨脂是一种常用中药,其富含的异戊烯基成分具有多种药理活性,如抗骨质疏松活性、雌激素受体样作用等[4-7]。目前,多数研究集中在这些成分的体内代谢物分析、药动学特征及涉及CYP酶和UGT酶的代谢研究,这些研究表明,大量的肝肠首过效应是这些补骨脂异戊烯基成分在体内吸收快、暴露量低的重要原因[16-22]。极低的生物利用度(系统暴露量)使得这些成分很难达到体外的药效浓度,这也给补骨脂药效物质的发现增加了难度。
补骨脂富含的异戊烯基成分不仅可以被CYP酶和UGT酶等催化[20-23],同时还具有抑制CYP酶和UGT酶的活性[22,24-25]。本研究发现,补骨脂异戊烯基成分对CYP1A1具有较强的抑制活性(IC50<5 μmol·L-1),这对于经CYP1A1代谢的外源物来说,很容易诱发显著的药物-药物相互作用。例如,利奥西呱及其主要代谢物是CYP1A1的强效抑制剂,与经CYP1A1介导催化的药物,如厄洛替尼或格拉司琼临床合用时需考虑相关的药物-药物相互作用[26]。同样,在其他药物与含补骨脂相关的中成药联合使用时,应重点监测可能出现的药物-药物相互作用。此外,CYP1A1还参与体内雌激素水平的稳态平衡[3],这也可能参与疾病的发生与发展。
为了评估可能存在的药物-药物相互作用,通常采用抑制剂在人血浆中的Cmax去获得[I]/Ki值,[I]/Ki<0.1则认为出现药物-药物相互作用的可能性非常低,而[I]/Ki>1则表示非常有可能出现药物-药物相互作用,[I]/Ki在0.1~1之间,则认为有中等可能出现药物-药物相互作用[22]。然而到目前为止,关于补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮在人体内的血药浓度Cmax尚未见报道,因此限制了这种预测。然而在动物实验中,大鼠灌胃给予补骨脂或者含补骨脂的中药方剂后,3个成分的血药浓度Cmax分别为0.003~0.037、0.003~0.078、0.005~1.08 μmol·L-1[16-19]。结合表1,当单体给药或大剂量提取物给药时,血药浓度增高,[I]/Ki>0.1,提示上述3种成分对CYP1A1全身代谢的抑制或清除作用影响较大,临床上潜在的药物-药物相互作用风险不容忽视。
补骨脂素同分异构体及异补骨脂素的结构类似物Bakuchicin对CYP1A表现出非常强的竞争性抑制(IC50和Ki值均小于0.50 μmol·L-1)[9]。本研究所选的5个化合物,仅有补骨脂定属于香豆素类化合物,但和Bakuchicin在整体结构上存在较大的差异(图1)。尽管如此,2者均对CYP1A表现出较强的抑制活性。我们还发现,补骨脂定对CYP1A1表现出非竞争性抑制动力学,IC50值为0.49 μmol·L-1,Ki值为0.59 μmol·L-1(表1),这与文献报道的有所差别[9],可能是由于这2个独立的实验选择了不同的特异底物造成的。酶底物选择不同,得到的抑制类型结果可能会有差异,这种现象在先前的研究也有报道,可能说明CYP1A1与底物存在2个或以上的结合位点[27]。
近年来,补骨脂及含补骨脂的中药方剂,因其能显著升高胆红素和引发急性肝损伤等,受到越来越多的关注[28-29]。考虑到胆红素在体内经UGT1A1代谢清除,而补骨脂富含的香豆素、异戊烯基成分等对UGT1A1具有显著的抑制作用[22,24-25,27],因此,有学者认为补骨脂可能是由于对UGT1A1的显著抑制导致胆红素上升,诱发急性肝损伤[27]。本研究从补骨脂异戊烯基成分抑制CYP1A1活性入手,考虑到CYP1A1在雌激素代谢中的关键作用,以及雌激素在肝脏内蓄积常引起胆汁淤积(雌激素类似物常用作胆汁淤积模型的化学诱导剂)[30],因此,补骨脂异戊烯基成分通过CYP1A1调节雌激素水平是一把双刃剑,维持雌激素稳态平衡对机体非常重要。
综上所述,补骨脂富含的异戊烯基成分对CYP1A1表现出较强的抑制活性,其中补骨脂二氢黄酮、补骨脂定和异补骨脂查尔酮作用最强(IC50<0.5 μmol·L-1且Ki<0.6 μmol·L-1);分子对接结果也证明补骨脂二氢黄酮和异补骨脂查尔酮与CYP1A1具有较强的亲和力,结合自由能分别为-10.145 kcal·mol-1和-8.286 kcal·mol-1,与α-萘黄酮(结合自由能为-10.861 kcal·mol-1)的抑制活性相当;最后,根据补骨脂异戊烯基成分的结构位点,我们总结了不同位点与CYP1A1的亲和力特征。上述结果为补骨脂的临床合理使用与预防潜在的药物-药物相互作用风险提供了实验依据。
