菖蒲郁金汤对抽动秽语综合征模型大鼠突触体SNARE蛋白复合体的影响研究
2021-11-02冯鹏孙治前罗文珍史正刚李玉霞吴丽萍尚菁田文霞陈静
冯鹏,孙治前,罗文珍,史正刚,李玉霞,吴丽萍,尚菁,田文霞,陈静
(1.甘肃中医药大学中医临床学院,甘肃 兰州 730000;2.河西学院医学院,甘肃 张掖 734000;3.甘肃中医药大学附属医院,甘肃 兰州 730020)
抽动秽语综合征(Tourette syndrome,TS)又称多发性抽动症,是发生在儿童时期以不自主的头面部、肢体和发声抽动为主要特征的常见神经精神疾病。TS因临床症状难以自控,给处于生长发育阶段的儿童在学习、生活和性格塑造等方面带来了深远的影响[1-2]。临床证据表明有2/3的TS患儿临床症状可经药物控制或缓解,但依然有近1/3的TS患儿症状波动可持续至成年,严重的患儿甚至出现自残行为[3]。如何有效控制儿童的抽动症状,并能长久地保持疗效,使患儿顺利融入学校、社会,已成为亟待解决的问题。中医药治疗TS临床疗效确切,得到了患儿家长的广泛认可[4-5]。
本课题组长期从事TS的防治研究,通过多年临床实践总结,自拟菖蒲郁金汤治疗本病,疗效确切,可明显改善抽动症状、减少抽动损害[6-8]。在对菖蒲郁金汤干预TS模型大鼠的研究中发现,菖蒲郁金汤可通过调控多巴胺(Dopamine,DA)系统发挥抗抽动的效应,但菖蒲郁金汤是如何调控DA的具体机制尚不清楚。在课题组前期研究的基础上,以突触体为研究对象,进一步明确菖蒲郁金汤抗抽动的作用机制,拟从DA神经元突触前释放角度研究菖蒲郁金汤对SANRE蛋白复合体介导的突触囊泡释放DA的影响。
1 材料
1.1 动物
SPF级健康SD大鼠240只,3周龄,体质量(60±10)g,雄性,由甘肃中医药大学动物实验中心提供,实验动物许可证号:SCXK(甘)2015-0002。所有动物饲养于甘肃中医药大学SPF级动物房,使用许可证号:SYXK(甘)2015-0005。本实验方案经过甘肃中医药大学实验动物伦理委员会审查,符合动物保护、动物福利和伦理原则,符合国家实验动物福利伦理相关规定,审查编号:2020-257。本实验实施过程中严格遵守动物使用的3R原则。
1.2 药物及试剂
硫必利,江苏恩华药业股份有限公司生产,批号:20191203,规格:100 mg,药品研磨后加生理盐水配制成3.194 mg·mL-1混合液;自拟菖蒲郁金汤(石菖蒲10 g,郁金10 g,僵蚕8 g,蝉蜕8 g,全蝎3 g,天麻8 g,远志8 g,天竺黄8 g,磁石20 g,石决明20 g,川牛膝10 g,焦山楂8 g)中药饮片由甘肃中医药大学附属医院中药房提供,处方药材煎煮制备工艺按课题组前期研究方案进行[7],浓缩药液至生药含量为5.152 g·mL-1。上述药液置于4 ℃冰箱备用。
3,3′-亚氨基二丙腈(3,3′-Iminodipropionitrile,IDPN)(美国Sigma公司,批号:MKCG8873),Percoll试剂(北京索莱宝科技有限公司,批号:1209H048),SNAP25、Synataxin-1a、VAMP-2兔来源单抗(美国Abcam公司,批号:GR153760-1、GR3344228-2、GR3259794-3),羊抗兔二抗(北京中杉金桥生物技术有限公司,批号:2004C1120),BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:20200602),逆转录试剂盒、荧光定量检测试剂盒(上海新贝生物科技有限公司,批号:F2731、F3223)。
1.3 主要仪器
透射电镜(日本Hitachi公司,型号:HT7700);超速冷冻离心机(美国Thermo Fisher Scientific公司,型号:SorvallTMWX+Ultracentrifuge Series);高速离心机(美国Beckman Coulter公司,型号:Microfuge 22R);酶标仪(美国Thermo Fisher Scientific公司,型号:Multiskan MK3);荧光倒置显微(日本Olympus公司,型号:IX51);荧光定量PCR仪(美国BIO-RAD公司,型号:IQ-5)。
2 方法
2.1 分组
由SPSS软件生成随机数,将大鼠随机分为空白组(60只)和造模组(180只),造模方法采用Diamond建立的腹腔注射IDPN方法[9],剂量为300 mg·kg-1·d-1;空白组腹腔注射等体积的生理盐水,每日1次,共7 d。造模完次日进行行为学评定,当刻板行为及运动行为评分均≥2分,表明造模成功[10],将造模成功的180只大鼠再次随机分为模型组、硫必利组及菖蒲郁金汤组,每组60只。
2.2 给药
造模完成后次日(即干预d0)开始,根据人-大鼠体表面积比换算[11],硫必利组给予硫必利药液0.048 g·kg-1·d-1,菖蒲郁金汤组予以菖蒲郁金汤药液77.28 g·kg-1·d-1(此剂量为人临床等效剂量的4倍,前期研究此剂量抗抽动效果最佳[6]),空白组与模型组给予等体积生理盐水灌胃,每天固定9:30—10:00之间进行操作,每日1次,连续4周。
2.3 刻板、运动行为评分
将动物放入1个较大的观察笼内,动物适应5 min后,按照文献的评分方法[12],在造模期间每天10:00—11:00,进行双盲观察(刻板行为测试和运动行为测试同时进行),5 min记录1次,统计其平均分。评分标准见表1。

表1 行为学评分表
2.4 样品采集、处理
在d0以及干预期间的各观察点(d7、d14、d21、d28),每组随机选取12只实验动物,其中3只腹腔注射麻醉,打开胸腔,暴露心脏,于心尖处剪开心脏,经左心室至升主动脉插管,剪开右心耳;先用生理盐水200 mL快速灌注,直至右心房流出液体变清;然后用4 ℃、4%多聚甲醛持续灌注250 mL,灌注完毕取出脑组织,剥离纹状体置于4 ℃、4%多聚甲醛中保存,用于免疫组化检测蛋白。另取3只大鼠,依前法麻醉后断头处死,剥离纹状体(全程在冰面上进行),置于冻存管中液氮保存,用于检测DA含量。剩余6只大鼠麻醉后断头处死,迅速剥离纹状体,用于制备突触体(其中3只用于mRNA的检测,另外3只用于蛋白的检测)。
2.5 突触体的制备
参考文献[13-15]中的制备方法,采用Percoll密度梯度离心法制备突触体:①在提取突触体当天先配制3%、10%、15%、23%Percoll梯度液,并按3%至23%的顺序分层加注(梯度液配制成功后,4 ℃保存,不超过24 h),以分层后在各个梯度交界处可见银白色为准。②取2.4项下的纹状体,用冰点均质缓冲液反复多次洗去血液等杂质,滤纸吸干后称质量,按1∶9(W/V)的要求将组织剪碎放入研磨管研磨,离心(4 ℃,3 600 r·min-1,10 min),取上清液,用冰点均质缓冲液稀释蛋白浓度在5~7 mg·mL-1范围内,备用。将合适蛋白浓度的上清液平铺于3%Percoll梯度液面上(切勿击穿梯度液),离心(4 ℃,18 000 r·min-1,5 min)后可见明显分为5层,提取第2层(由管底向管口),即粗制突触体,用预冷的蔗糖/EDTA缓冲液稀释10倍,离心(4 ℃,15 000 r·min-1,20 min),弃上清液,加入等渗培养液,离心(4 ℃,12 000 r·min-1,5 min),洗去Percoll所得沉淀物即为纯净突触体。
2.6 突触体的形态学电镜验证
将2.5项下制备的突触体用2.5%戊二醛固定48 h。按照透射电镜样品的制备方法[16]进行2%锇酸固定,然后在梯度酒精和丙酮中脱水,树脂浸透包埋,固化,超薄切片,醋酸铀和枸橼酸铅复染,透射电镜观察、摄片。
2.7 ELISA法检测纹状体中DA含量的变化
按照ELISA试剂盒说明书测定大鼠纹状体中DA的含量,450 nm下读取吸光值。将样品检测OD值代入标准曲线获得测定浓度,再乘以稀释倍数,计算得出DA浓度。
2.8 qPCR法检测SNAP-25、Syntaxin-1a、VAMP-2 mRNA表达
将2.5项下制备的突触体提取总RNA,参照逆转录试剂盒说明书逆转录为cDNA,反应条件为37 ℃ 15 min,85 ℃ 5 s;随后按照qPCR试剂盒说明书进行定量检测,扩增条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 20 s,循环40次,同时做熔解曲线,重复3次,实验结果取CT值进行分析。引物序列依据Gen-Bank公布的序列进行设计,引物设计由大连宝生生物工程有限公司负责完成。引物详情见表2。

表2 目的基因序列
2.9 Western blot法检测突触体内SNAP-25、Syntaxin-1a、VAMP-2蛋白表达
将2.5项下制备的突触体,按照RIPA试剂盒操作说明提取蛋白,BCA试剂盒测定蛋白浓度。按照实验操作步骤制胶、上样、电泳、转膜,5%BSA室温封闭2 h。分别加入兔源SNAP-25一抗(1∶2 000),兔源Syntaxin-1a一抗(1∶2 000),VAMP-2一抗(1∶5 000),4 ℃孵育过夜,羊抗兔二抗室温孵育2 h(1∶4 000),冲洗条带3次,每次5 min,将条带放入暗室,加入ECL发光液,压片、曝光。采用Image J对蛋白条带进行定量,以GAPDH为参照,每组实验重复3次。
2.10 免疫组织化学法检测纹状体中SNAP-25、Syntaxin-1a、VAMP-2表达
取4%多聚甲醛固定的纹状体,梯度酒精脱水后石蜡包埋,切片机连续切片,切片厚约5 μm,将切好的石蜡切片依次经过二甲苯和梯度酒精浸泡,水化后进行抗原修复,随后用3%H2O2对切片中过氧化氢酶进行失活,5%山羊血清封闭,SNAP-25一抗(1∶250),兔源Syntaxin-1a一抗(1∶200),VAMP-2一抗(1∶200),4 ℃孵育过夜,洗涤,加生物素标记的二抗,37 ℃孵育30 min,洗涤,加HRP标记的链霉素,37 ℃孵育30 min,DAB显色,洗涤,苏木素染色,PBS洗涤4次,每次5 min,甘油封片,显微镜下观察,Image J软件分析光密度值。
2.11 统计学处理
3 结果
3.1 突触体形态鉴定
实验所获取的突触体具有典型的突触体“雪人”形态结构特征[17]:结构完整,形态清晰,突触前膜、突触间隙、突触后膜清晰可见,突触线粒体轮廓完整,突触前膜附近可见大小不一、边界清楚的囊泡。见图1。

注:箭头所指为突触间隙,★为突触前膜,▲为突触后膜。图1 突触体典型的“雪人”结构(×15 000)
3.2 纹状体内DA的含量变化
干预后d0,与空白组相比,模型组、硫必利组和菖蒲郁金汤组大鼠纹状体中DA的含量均显著下降(P<0.01)。空白组和模型组各干预时间点(d7、d14、d21、d28)DA的含量与d0相比,差异无统计学意义(P>0.05)。硫必利组和菖蒲郁金汤组d7、d14、d21、d28的DA含量与d0相比,差异有统计学意义(P<0.01),2组均呈升高趋势,在各干预时间点的DA含量均高于模型组(P<0.01)。在干预d7、d14,菖蒲郁金汤组DA含量低于硫必利组(P<0.01);在干预d21、d28菖蒲郁金汤组DA含量低于硫必利组,但差异无统计学意义(P>0.05)。详见表3。

表3 各组大鼠纹状体DA含量
3.3 各组大鼠突触体内SNAP-25、Syntaxin-1a、VAMP-2 mRNA表达比较
与空白组比较,模型组大鼠突触体内SNAP-25、Syntaxin-1a、VAMP-2 mRNA表达水平在各观察点都明显降低(P<0.01)。在d7,硫必利组、菖蒲郁金汤组各指标mRNA表达与模型组之间的差异无统计学意义(P>0.05);在d14,菖蒲郁金汤组SNAP-25、Syntaxin-1a mRNA的表达高于模型组(P<0.05),VAMP-2 mRNA表达与模型组之间的差异无统计学意义(P>0.05);硫必利组各指标mRNA表达与模型组之间的差异无统计学意义(P>0.05);在d21,菖蒲郁金汤组各指标mRNA的表达高于模型组(P<0.01),硫必利组SNAP-25、Syntaxin-1a mRNA的表达高于模型组(P<0.05),VAMP-2 mRNA表达与模型组之间的差异无统计学意义(P>0.05);在d28,硫必利组、菖蒲郁金汤组各指标mRNA的表达均高于模型组(P<0.01)。硫必利组和菖蒲郁金汤组在干预期间各观察点大鼠突触体内各指标的mRNA表达水平总体呈逐渐上升的趋势。与d0相比,菖蒲郁金汤组从d14开始Syntaxin-1a mRNA的表达水平,差异出现统计学意义(P<0.05,P<0.01),从d21开始SNAP-25、VAMP-2 mRNA差异出现统计学意义(P<0.05,P<0.01)。在治疗结束后(即d28)的菖蒲郁金汤组中各指标mRNA的表达要高于硫必利组(P<0.05)。如图2所示。
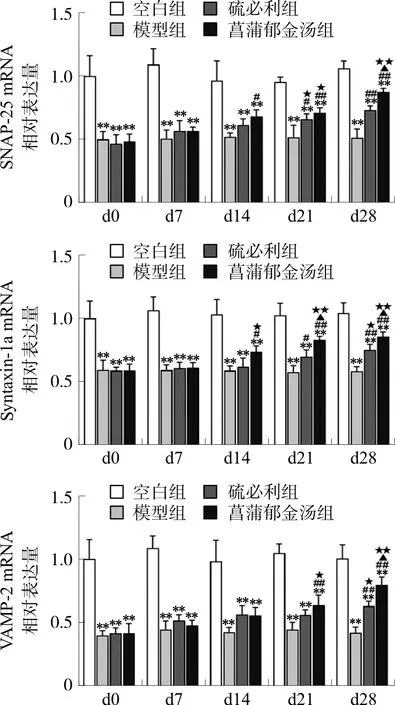
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05, ##P<0.01;与硫必利组比较,▲P<0.05;与d0比较,图2 各组大鼠突触体中SNAP-25、Syntaxin-1a、 VAMP-2 mRNA的表达情况
3.4 各组大鼠突触体SNAP-25、Syntaxin-1a、VAMP-2蛋白表达比较
Western blot结果显示,与空白组比较,模型组大鼠突触体中SNAP-25、Syntaxin-1a、VAMP-2蛋白的相对表达在各观察点降低(P<0.05,P<0.01)。与模型组比较,硫必利组及菖蒲郁金汤组突触体内各指标蛋白的相对表达在干预期间各观察点升高(P<0.05,P<0.01),总体呈上升趋势。在d28,菖蒲郁金汤组中SNAP-25和VAMP-2的蛋白相对表达量与硫必利组相比,差异无统计学意义(P>0.05),Syntaxin-1a的蛋白相对表达量高于硫必利组(P<0.05)。如图3所示。

注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05, ##P<0.01;与硫必利组比较,图3 不同时间点各组大鼠突触体中目标蛋白的表达情况
3.5 各组大鼠纹状体SNAP-25、Syntaxin-1a、VAMP-2蛋白表达的比较
免疫组化结果显示,与空白组比较,模型组大鼠纹状体的SNAP-25、Syntaxin-1a、VAMP-2蛋白的表达量显著降低(P<0.01)。与模型组比较,硫必利组及菖蒲郁金汤组SNAP-25、Syntaxin-1a、VAMP-2蛋白的表达量在干预期间各观察点显著升高(P<0.05,P<0.01),总体呈上升趋势。菖蒲郁金汤组和硫必利组从d7开始SNAP-25蛋白表达量与d0相比较,差异出现统计学意义(P<0.05,P<0.01),从d14开始Syntaxin-1a、VAMP-2的蛋白表达量与d0相比较,差异出现统计学意义(P<0.05,P<0.01)。在d21、d28菖蒲郁金汤组Syntaxin-1a的蛋白相对表达量高于硫必利组,但差异无统计学意义(P>0.05),SNAP-25、VAMP-2的蛋白相对表达量显著高于硫必利组(P<0.05,P<0.01),如图4~6。

注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与硫必利组比较,▲P<0.05; 与d0比较,★图4 各组大鼠纹状体SNAP-25蛋白的表达

注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与d0比较,★图5 各组大鼠纹状体Syntaxin-1a蛋白的表达

注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与硫必利组比较, ▲▲P<0.01;与d0比较,★图6 各组大鼠纹状体VAMP-2蛋白的表达

图7 SNARE蛋白复合体介导囊泡膜与突触前膜融合示意图
4 讨论
TS发病机制复杂,病因众多,目前的研究表明TS可能与遗传、神经递质失衡、免疫、社会心理及环境因素均有关,国际上尚未有明确的定论。在众多理论假说中,“神经递质失衡”理论在国内外得到了广泛的认可。该假说认为TS的发生与皮质-基底节-丘脑-皮质回路紧密相关,因回路富集了大量的神经递质,这些神经递质在调控人体的运动能力和情感表达方面有着重大作用,其中研究较为明确的是DA[18-20]。DA是脑内重要的神经递质,与癫痫、抑郁症、注意力缺陷多动症等的发病密切相关[21],DA系统的正常运转在其合成、释放、转运、代谢等方面受到调控,是目前包括退行性疾病在内的神经系统领域研究的重点。
DA作为神经递质承担着传递信息的重要任务,包含有DA的突触囊泡与突触前膜的融合(即“胞吐”)是完成信息传递的关键环节之一[22]。囊泡融合过程涉及多种蛋白,其中SNARE蛋白是介导囊泡融合的核心分子,也是突触小泡外排的核心驱动力[23-24]。SNARE蛋白复合体由SNAP-25、VAMP-2以及Syntaxin-1a共同组成[25],三者通过组装成为四股螺旋复合物可以拉近囊泡和突触前膜的距离,同时复合体形成过程中所产生的能量可以促进融合孔的形成,促使突触小泡与突触前膜完全融合,随后DA得以释放到突触间隙中(图7),因此SNARE复合体各组分蛋白的表达异常会直接影响DA的释放[26]。Verhage等[27]将由干扰SNARE复合体以及相关调节蛋白功能引起的脑部疾病定义为SNARE病。于佳等[28]采用蛋白质组学技术对突触体相关蛋白进行分析验证,发现可以通过调节SNARE蛋白复合体的表达进而影响神经递质的释放,这被认为是抗抑郁的新机制和新靶点。临床研究显示VAMP-2基因变异后可出现发育迟缓、孤独症、行为障碍、癫痫等[29]。裴青等[30]的实验表明Syntaxin-1a的过表达导致培养的神经元突触密度增加,而抑制Syntaxin-1a的表达则影响突触的大小。有研究观察到SNAP-25基因敲除的小鼠胞吐作用严重受损[31],而SNAP-25的表达异常可导致精神分裂症、注意力缺陷多动症的出现,说明其在神经发育中起到重要且多样的作用[32]。综合以上信息表明SNARE蛋白复合体中各组分蛋白的表达异常可能是多种神经精神类疾病发病的机制。
本研究关注点集中在DA突触前释放,并以突触体为研究对象,更加精准地反映出DA突触前释放的情况,以明确菖蒲郁金汤对TS抗抽动作用的机制。结果表明模型组由于IDPN的影响导致DA的释放量较空白组明显降低,这与之前文献的报道一致[33]。伴随着DA的降低,SNAP-25、Syntaxin-1a和VAMP-2 mRNA和蛋白的表达量都有明显的下降,并在菖蒲郁金汤的干预下有所回调,同时DA含量随着干预时间的延长而升高。实验初步证实了菖蒲郁金汤能够调控SNARE蛋白复合体的表达,改善DA神经元突触前释放的功能,从而影响脑内DA的含量,进而产生抗抽动的作用。DA的释放需要SNARE蛋白复合体的介导来完成胞吐的过程,但是SNARE复合体的组装又受到其他蛋白调控,如钙离子信号蛋白、CPX蛋白、Munc18-1、Munc13-1等,课题组将在今后的实验中进一步完善并明确其关系。
