电针预处理对脂多糖诱导的小鼠心功能障碍及炎性反应的影响
2021-11-02陈栎遥杨文秀施珺菁杨嘉丽傅淑平于美玲卢圣锋
陈栎遥,杨文秀,施珺菁,杨嘉丽,傅淑平,于美玲,卢圣锋
(1.南京中医药大学针药结合教育部重点实验室,江苏 南京 210023;2.南京中医药大学附属张家港医院,江苏 张家港 215600)
脓毒症是机体对感染反应调控失调引起的全身炎症反应综合征,可导致危及生命的多器官功能障碍,严重威胁人类生命健康[1]。心脏是易受损的靶器官之一,心功能障碍是脓毒症心肌损伤的主要表现,且与患者的高死亡率密切相关[2]。临床研究[3-4]和动物实验[5-6]表明,针刺对脓毒症有良好的治疗效应:既能提高存活率[7],也可改善脓毒症引起的脏器损伤[8-11];并初步发现,针刺足三里能够改善血流动力学和心功能[12],实现对损伤心肌的保护[13],但具体机制尚未完全阐明。脓毒症期间炎症水平的升高是先天免疫细胞(如巨噬细胞)激活后引起细胞因子释放导致的,炎性反应是诱发心肌损伤的主要因素。最近的研究提示[14],巨噬细胞存在M1型和M2型2种表型,M1型巨噬细胞分泌促炎性细胞因子发挥促炎作用,M2型巨噬细胞释放抗炎性细胞因子起抗炎作用,巨噬细胞极化平衡是有效清除毒素和组织修复的关键。因此,调控巨噬细胞极化在改善脓毒症诱导的心肌损伤中具有重要的意义。多项研究显示,电针可调控心肌损伤局部炎性反应[15-18],并有效促进巨噬细胞表型的转化[19-20]。电针预处理能否通过调控巨噬细胞表型的转化、抑制炎性反应减轻脓毒症心肌损伤?目前未见有研究报道。因此,本研究用脂多糖诱导建立脓毒症模型小鼠,以炎症为切入点,观察电针预处理对全身及局部炎症水平、心功能及心肌巨噬细胞表型的影响。
1 材料与方法
1.1 实验动物及分组
6~8周SPF级雄性C57BL/6J小鼠24只,体质量20~25 g,购自浙江维通利华实验技术有限公司,生产许可证号:SCXK(浙)2019-0001。将小鼠适应性喂养1周,室温(22±1)℃,湿度为50%~60%,12 h明/暗光照周期,自由进食和饮水。采用随机数字表法将小鼠分为对照组、模型组和电针预处理组,每组8只。所有实验操作符合科技部颁发的《关于善待实验动物的指导性意见》,并获得南京中医药大学动物伦理委员会批准(伦理批号:202101A041)。具体实验流程见图1。
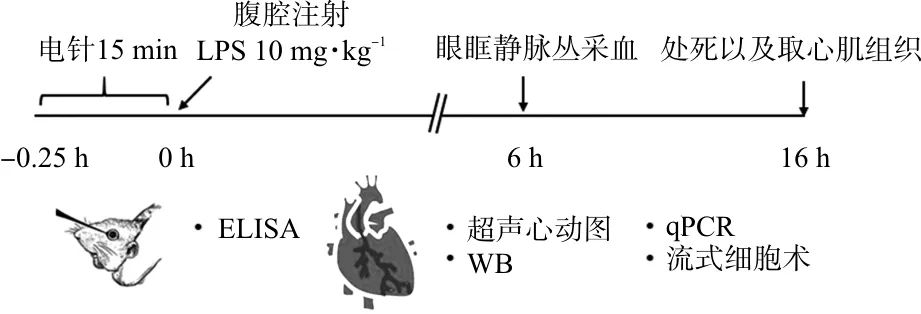
图1 实验流程示意图
1.2 主要试剂与仪器
小动物超声成像系统(意大利Esaote公司),流式细胞仪(美国Beckman公司,CytoFLEX),实时荧光定量PCR仪(美国Agilent公司,Mx3000P),多功能酶标仪(美国BioTek公司),电泳仪及转印系统(美国Bio-Rad公司),化学发光成像系统(上海欧翔公司),韩氏穴位神经刺激仪(HANS-200A,南京济生医疗科技有限公司),无菌针灸针(北京中研太和医疗器械有限公司)。
脂多糖(美国Sigma公司,O111: B4),F4/80抗体、CD11b抗体、CD206抗体(美国eBioscience公司),IL-1β、IL-6、IL-10、TNF-α抗体(英国Abcam公司),GAPDH抗体(美国CST公司),ECL超敏发光液(南京基易生物科技有限公司),TNF-α、IL-1β ELISA试剂盒(南京金益柏生物科技有限公司)。
1.3 干预方法
参照《实验针灸学》[21]进行穴位定位,电针预处理组于造模前取双侧足三里穴进行电针治疗。足三里穴:膝关节下方,腓骨头下0.3 cm处的肌沟中。用5%异氟烷将小鼠快速诱导麻醉后,以1%~2%异氟烷维持,将自制双极联体针(用医用绝缘胶带将两根规格为0.16 mm×7 mm的针灸针针柄各自缠绕至1 mm厚度后,将其并列捆在一起,露出针柄末端与针身)直刺3 mm后,连接韩氏穴位神经刺激仪,疏密波,频率2/15 Hz,强度2 mA,针刺15 min。对照组、模型组不予处理,仅抓取、固定。
1.4 模型制备
模型组、电针预处理组参照文献[22]腹腔注射10 mg/kg LPS建立脓毒症模型,对照组注射等体积生理盐水。小鼠出现肛温降低、活动减少、眼睑闭合伴黏稠分泌物、腹泻等表现为模型复制成功。
1.5 经胸超声心动图测量心功能
造模16 h后通过经胸超声心动图测定小鼠心脏功能。用M型超声记录测量左室收缩期末内径(LVESD)、左室舒张期末内径(LVEDD)。并通过系统公式计算左室射血分数(LVEF)和短轴收缩率(LVFS)。
1.6 ELISA检测
造模6 h后用毛细管眼眶静脉丛取血,常规离心后分离血清,采用ELISA法检测血清TNF-α、IL-1β水平,具体操作严格按照试剂盒说明书进行。
1.7 心肌组织中炎性因子mRNA表达检测
超声检查结束后取心脏组织,采用qPCR技术进行检测。Trizol法提取总RNA,核酸蛋白测定仪检测总RNA的质量和浓度。通过热循环仪,25 ℃ 5 min,55 ℃ 15 min,85 ℃ 5 min,逆转录合成cDNA,以GAPDH作为内参。PCR反应条件为:预变性95 ℃ 5 min;变性95 ℃ 10 s;退火55 ℃ 20 s;延伸72 ℃ 20 s。使用2-ΔΔCt方法处理数据。引物序列由上海捷瑞生物工程有限公司设计与合成,见表1。

表1 引物序列
1.8 Western blot法检测心肌组织中炎性因子蛋白含量
将各组小鼠心肌组织液氮研磨并加入RIPA蛋白裂解液后,12 000 r/min,4 ℃,离心15 min,取上清,用BCA法测定蛋白浓度后加入蛋白上样缓冲液,100 ℃加热变性,-80 ℃备用。12% SDS-PAGE凝胶电泳,转膜,5%BSA封闭1 h,加入有IL-1β、IL-6、TNF-α、IL-10、β-actin(均为1∶1 000)、GAPDH(1∶3 000)抗体稀释液的抗体盒中,4 ℃孵育过夜,次日TBST洗3次后,二抗(1∶3 000)中室温孵育1 h,TBST洗3次,ECL显色曝光。以GAPDH和β-actin作为内参,采用Image J软件分析蛋白条带灰度值,计算相对表达量。
1.9 流式细胞术分选巨噬细胞
心肌单细胞悬液制备方法参考文献[23]进行,取心脏组织用冷的PBS冲洗去除组织中的血液,将组织剪碎成小块,每个心脏用5 mL消化液消化,消化液按每1 mL RPMI-1640培养基溶液加入1.6 mg Collagenase Ⅰ及0.2 mg Dnase Ⅰ配置而成,在37 ℃温育混匀1 h后用40 μm的过滤器过滤组织,并在4 ℃以1 500 r/min离心5 min,去上清,将沉淀重悬在1 mL PBS中。加入3 mL红细胞裂解液冰上裂解3 min,离心后去上清,再使用PBS洗1次,进行细胞计数,将细胞数调整至1×106mL-1。用CD16/32抗体进行Fc受体阻断后,从小鼠心脏收集的巨噬细胞用CD11b、CD206、F4/80标记抗体进行表面染色,4 ℃避光孵育30 min。通过CytExpert软件分析结果。
1.10 统计学方法
2 结果
2.1 各组小鼠LVEF和LVFS的比较
与对照组相比,模型组LVEF及LVFS显著降低(P<0.01);与模型组相比,电针预处理组LVEF及LVFS明显增高(P<0.01)。见图2。
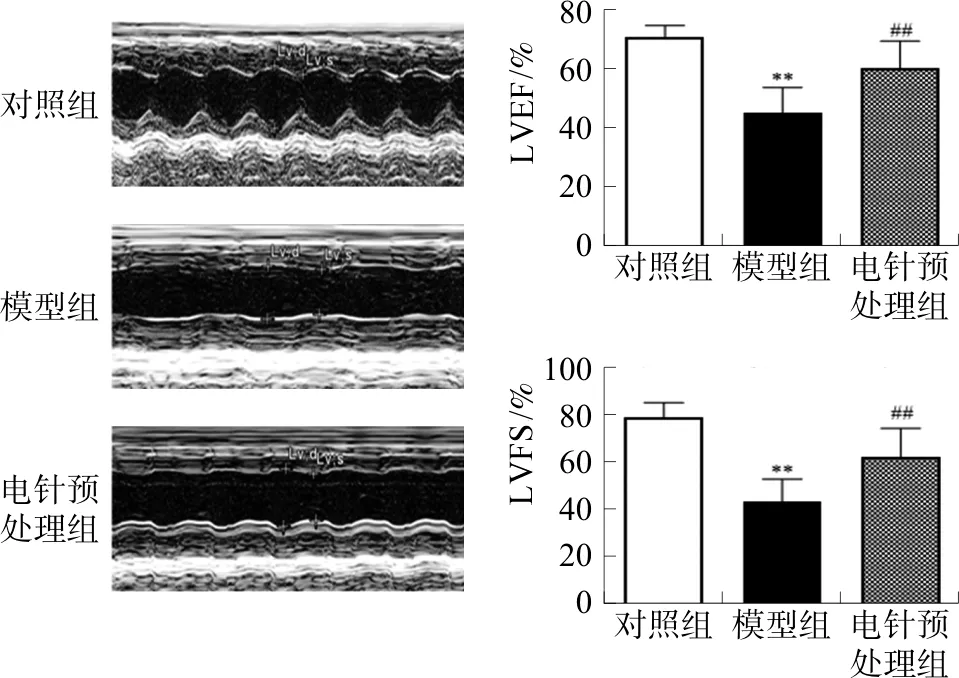
注:与对照组比较,**P<0.01;与模型组比较,图2 电针预处理对小鼠LVEF及LVFS的影响
2.2 各组小鼠血清中TNF-α、IL-1β含量的比较
与对照组相比,模型组小鼠血清TNF-α、IL-1β水平均显著升高(P<0.01);与模型组相比,电针预处理组TNF-α、IL-1β含量下降(P<0.05,P<0.01)。见图3。
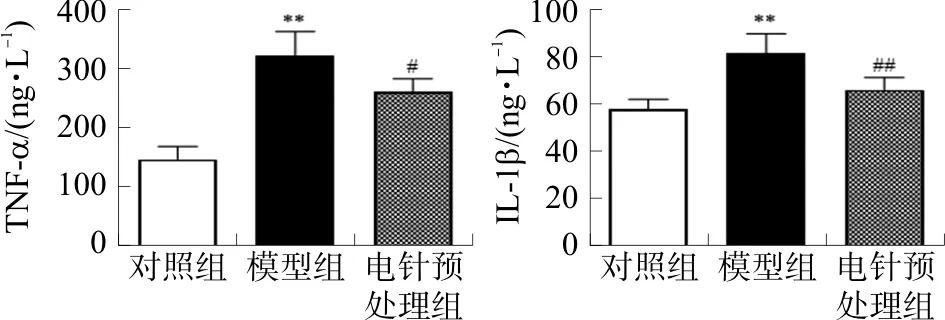
注:与对照组比较,**P<0.01;与模型组比较,图3 电针预处理对小鼠血清TNF-α、IL-1β含量的影响
2.3 各组小鼠心肌组织TNF-α、IL-1β、IL-6和IL-10 mRNA表达量的比较
与对照组相比,模型组小鼠心肌组织中TNF-α、IL-1β、IL-6、IL-10 mRNA水平均升高(P<0.05,P<0.01);与模型组相比,电针预处理组TNF-α、IL-1β、IL-6 mRNA水平下降(P<0.01),IL-10 mRNA水平明显上升(P<0.01)。见图4。
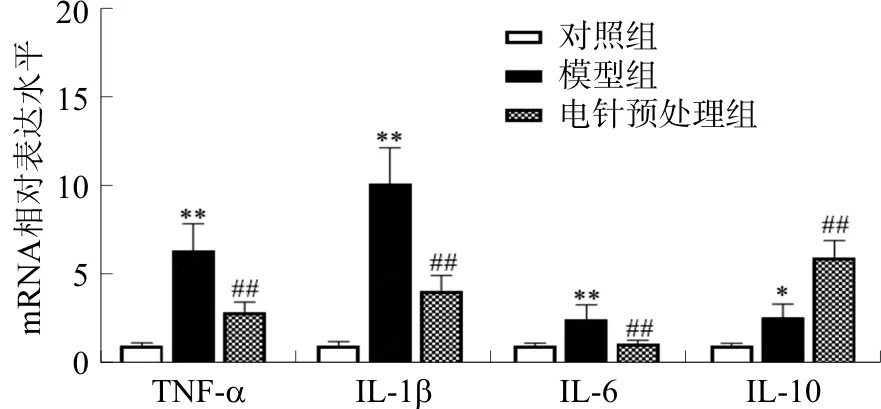
注:与对照组比较,*P<0.05,**P<0.01; 与模型组比较,图4 各组小鼠心肌组织中TNF-α、IL-1β、IL-6、 IL-10 mRNA表达量的比较
2.4 各组小鼠心肌组织TNF-α、IL-1β、IL-6和IL-10蛋白水平的比较
与对照组相比,模型组小鼠心肌组织中TNF-α、IL-1β、IL-6、IL-10蛋白含量均上调(P<0.05,P<0.01);与模型组相比,电针预处理组TNF-α、IL-1β、IL-6含量下调(P<0.05,P<0.01),IL-10含量上调(P<0.05)。见图5。
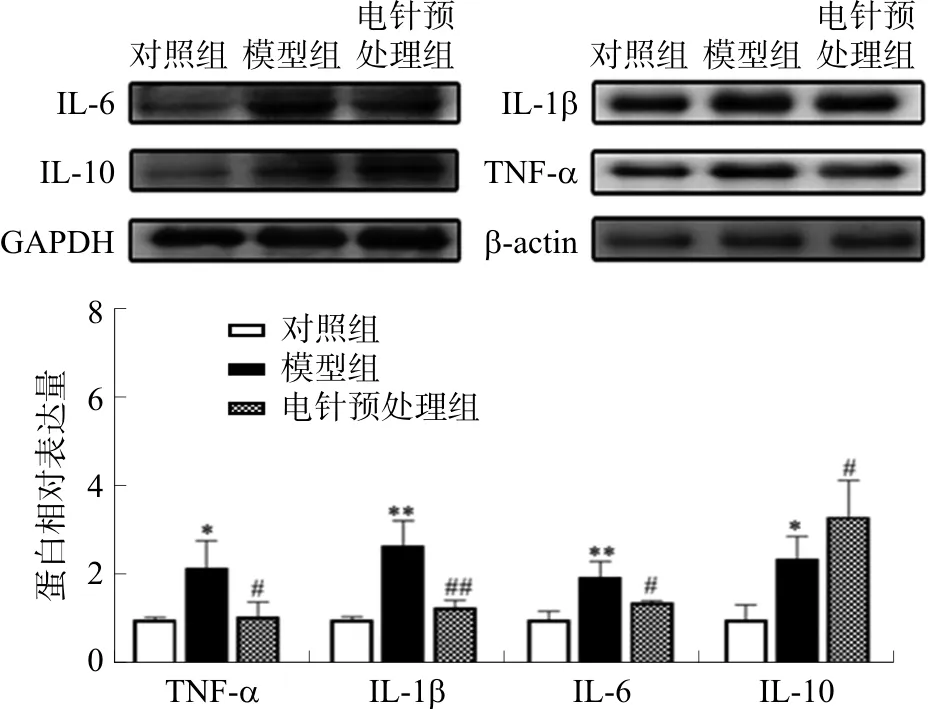
注:与对照组比较,*P<0.05,**P<0.01; 与模型组比较,图5 各组小鼠心肌组织中TNF-α、IL-1β、 IL-6、IL-10蛋白表达量的比较
2.5 各组小鼠心脏巨噬细胞数量及表型的比较
与对照组相比,模型组心肌组织中F4/80+CD11b+巨噬细胞在总细胞数中的含量明显升高(P<0.01),表达F4/80+CD11b+CD206low的M1型巨噬细胞比例上调(P<0.01),表达F4/80+CD11b+CD206high的M2型巨噬细胞比例下降(P<0.01);与模型组相比,电针预处理组巨噬细胞含量及F4/80+CD11b+CD206lowM1型巨噬细胞的比例下降(P<0.01),F4/80+CD11b+CD206highM2型巨噬细胞比例上升(P<0.01)。见图6。
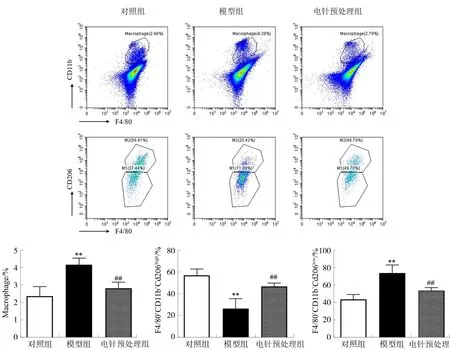
注:与对照组比较,**P<0.01;与模型组比较,图6 电针预处理对巨噬细胞总数及表型的影响
3 讨论
脓毒症是危重症患者的首要死因,心功能障碍是脓毒症预后不良的预测因素之一。脓毒症模型的制备方式主要包括外源性毒素(如LPS)的直接注射和内源性保护屏障的破坏(如盲肠结扎穿孔法)[24]。腹腔注射LPS构建的动物模型能模拟人类脓毒症的血流动力学及代谢紊乱改变,且反应时间和严重程度更加可控,故选择此法。本研究中,LPS注射2 h后小鼠出现了肛温降低、活动减少、眼睑闭合伴黏稠分泌物、腹泻等表现,符合脓毒症模型一般表现。且造模16 h后,超声心动图检测发现:模型组动物发生左心室收缩功能障碍改变——LVEF和LVFS值降低,与文献报道一致[22],提示本实验脓毒症伴心功能损伤模型建立成功。同时发现,电针预处理可以有效改善上述异常变化,并降低血清TNF-α、IL-1β水平,表明电针预处理在防治脓毒症及其诱发的心肌损伤中具有价值。
炎性反应是脓毒症心肌损伤的病理基础。细胞表面的Toll样受体识别病原体相关分子模式,激活中性粒细胞、巨噬细胞、淋巴细胞等先天免疫细胞,启动炎性通路进而导致下游炎性因子如TNF-α、IL-1β、IL-6的释放,直接引起心肌细胞损伤,使心肌收缩力下降[25-26]。此外,TNF-α、IL-1β诱导一氧化氮(NO)的产生,引起心脏产生负性变力,导致心肌组织病变[27-28]。多项研究提示[29-31],干预炎性反应能改善脓毒症心功能障碍,减轻心肌损伤。在本研究中,小鼠心肌损伤后,心肌组织中TNF-α、IL-1β、IL-6、IL-10表达水平明显上调,而电针预处理后TNF-α、IL-1β、IL-6表达下降并促进IL-10的进一步增加,提示电针预处理可能通过抑制炎症发挥心肌保护作用。
巨噬细胞在周围微环境的作用下,可以极化为M1型和M2型巨噬细胞表型并发挥不同的作用。通过不同的特异性生物标记物,可鉴别不同巨噬细胞亚型,其中F4/80、CD11b双阳标记巨噬细胞;CD206是典型的M2型巨噬细胞标记物。M1型巨噬细胞主要呈递抗原和分泌促炎因子如TNF-α、IL-1β和IL-6;而M2型巨噬细胞与组织修复相关,其分泌抑炎因子IL-10。本研究通过流式细胞术对LPS诱导的脓毒症模型心肌组织中巨噬细胞检测。结果显示,在LPS刺激下,心脏中F4/80+CD11b+总巨噬细胞含量增加,且F4/80+CD11b+CD206lowM1型巨噬细胞占比增加,表明LPS促进巨噬细胞总量增加,并向M1极化。但电针干预后,F4/80+CD11b+总巨噬细胞含量下降,且F4/80+CD11b+CD206highM2型巨噬细胞占比显著增加,提示电针预处理能抑制LPS对巨噬细胞向M1极化的诱导作用,促进其向M2型巨噬细胞极化,结合M1、M2型巨噬细胞相关炎性因子表达情况,与心肌组织流式结果一致,提示电针预处理通过促进促炎M1型向抗炎M2型巨噬细胞极化减轻炎症发挥心肌保护作用。
综上,电针预处理可通过减少心肌巨噬细胞的募集,并促进巨噬细胞向M2型极化,减轻全身和局部炎性反应,改善心功能,实现心肌保护。研究表明[6]电针足三里通过迷走神经调节多巴胺抑制LPS诱发的全身性炎症,那么电针预处理是否通过此途径实现促巨噬细胞向M2型极化,减轻炎性反应,改善LPS诱发的心肌损伤呢?此外,内关穴是心血管疾病的首选腧穴,针刺内关能减轻心肌局部炎症,同时也能有效调控巨噬细极化[19],那么刺激该穴,是否也能在此模型中发挥心肌保护作用呢?预处理产生心肌保护效应,在脓毒症发生之后用电针干预是否也同样有效?都需要我们进一步探索和明确。
