针刺抑制星形胶质细胞活化提高脑梗死超时间窗溶栓安全性的实验研究
2021-11-02徐文韬姜思媛常思琦张智慧宋扬扬张新昌倪光夏
徐文韬,姜思媛,常思琦,张智慧,宋扬扬,张新昌,倪光夏
(南京中医药大学针灸推拿学院·养生康复学院,江苏 南京 210023)
早期实施静脉溶栓是目前公认的治疗急性脑梗死的首选方案[1]。在脑梗死发生的超早期进行阿替普酶(rt-PA)溶栓治疗,可有效改善患者的神经功能。但该疗法的使用,有着严格的时间窗(3~4.5 h)[2]限制,一旦超过溶栓时间窗,溶栓治疗的效果会大幅度降低,同时会破坏血脑屏障(Blood brain barrier,BBB),增加出血性转化、脑水肿等溶栓并发症的发生率[3]。然而在现实生活中由于受到多种因素的影响,要在规定的时间窗内进行溶栓治疗难度极大。本课题组前期研究结果初步表明:用针刺早期介入到脑梗死溶栓治疗中,可通过非Caspase通路抑制细胞凋亡,延长溶栓时间窗,从而提高溶栓安全性[4]。现有研究表明,星形胶质细胞是BBB组成之一,其活化标记物胶质纤维酸性蛋白(GFAP)、水通道蛋白-4(AQP-4)在脑损伤发生过程中的作用不容忽视,且针刺脑保护效应的发挥与调控星形胶质细胞活化程度密切相关[5-7]。但针刺能否通过调控星形胶质细胞活化,减少脑梗死溶栓后BBB的破坏来提高溶栓安全性,目前还缺少深入探索。
本实验在溶栓治疗基础上配合针刺,论证及时针刺干预的作用,并从星形胶质细胞的途径探讨其可能的机制,为临床针刺提高溶栓安全性提供实验依据。
1 材料
1.1 实验动物
SPF级健康雄性SD大鼠114只,体质量(300±20)g,由浙江维通利华实验动物技术有限公司提供,实验动物许可证号:SCXK(浙)2019-0001。饲养于南京中医药大学实验动物中心,温度20~22 ℃,相对湿度40%~50%,自由摄食饮水。实验通过南京中医药大学实验动物伦理委员会审查,批准号:201906A024。
1.2 药物、试剂与仪器
注射用rt-PA(德国Boehringer Ingelheim,批号:901027),凝血酶(美国Sigma,货号:T4648-1KU),TTC(美国Sigma,货号:T8877-50G),EB(美国Sigma),BCA蛋白浓度测定试剂盒(增强型)(南京碧云天生物技术有限公司,货号:P0010),逆转录试剂盒[翌圣生物科技(上海)股份有限公司,货号:11123ES60],qPCR试剂盒[翌圣生物科技(上海)股份有限公司,货号:11202ES08],GFAP抗体(美国Affinity,货号:AF6166),GAPDH抗体(美国Affinity,货号:AF7021),AQP-4抗体(武汉三鹰生物技术有限公司,货号:16473-1-AP),β-tubulin抗体[翌圣生物科技(上海)股份有限公司,货号:30302ES20],山羊抗兔IgG(美国Abcam,货号:ab150080)。
酶标仪(美国Bio-Tek,Synergy H1),垂直电泳系统、电转膜仪、制胶器(美国Bio-Rad),实时荧光定量PCR仪(美国Stratagene,MX3000P),化学发光成像仪(上海欧翔科学仪器有限公司,Bioshine ChemiQ 4800mini),激光多普勒血流仪(英国Moor,MoorVMS-LDF1),高速离心机、电动匀浆器、移液枪(德国Eppendorf)。
2 方法
2.1 实验分组
66只大鼠适应性喂养3 d后,采用随机数字表法分为假手术组、模型组、4.5 h溶栓组、6 h溶栓组、针刺+4.5 h溶栓组、针刺+6 h溶栓组,每组11只。
2.2 模型制备
大鼠麻醉后,俯卧位固定于手术台上,头部脱毛并常规消毒。矢状位剪开顶部皮肤约1 cm,分离皮下筋膜,直至暴露前囟和颅骨。使用颅骨钻在右侧颅骨打1个小孔,以穿透颅骨但未穿透硬脑膜为宜。使用特制胶水(LOCTITE7452、LOCTITE411)将激光多普勒血流仪的探头固定于脑膜,观察大脑中动脉供血区右侧大脑皮质的局部脑血流量(RCBF),当所示数值平稳后,记录此时RCBF值并定义为基线(100%)。

图1 凝血酶诱导的改良PE-50导管制备自体血栓
参照团队前期制备大鼠自体血栓栓塞性模型的方法[8],先制备自体血栓,将凝血酶和大鼠眼眶静脉血吸入毛细玻璃管中,静置2 h后取出血栓,用注射器吸入PE-50导管中备用(见图1)。将上述大鼠仰卧固定于手术台上,大鼠体位变动会造成RCBF变化,等数值稍稳定再行颈部手术。切开颈部正中皮肤,钝性分离右侧颈总动脉(RCCA)、颈外动脉(RECA)、颈内动脉(RICA)及翼腭动脉。结扎RECA远心端,在其近心端打活结备用,动脉夹暂时夹闭RCCA近心端和RICA。在RECA上近分叉处剪一小口,经此小口处插入制备好的PE-50导管尖端,拉紧备用活结以固定导管,移去RICA上的动脉夹,经分叉处将PE-50导管缓慢向RICA入颅脑方向推进19~22 mm,当导管尖端到达大脑中动脉(MCA)的起始处时,先将导管撤回1~2 mm,再将PE-50导管中的血栓推入MCA。拔出导管,结扎RECA,松开RCCA上的动脉夹,消毒并缝合颈部切口。观察RCBF数值变化,当数值基本稳定保持于基线的20%~30%来初步认定造模成功。最后进行头部切口缝合。术后大鼠单笼饲养,注意保暖。假手术组只进行钝性分离。术后2 h大鼠苏醒,神经行为学评分为2~4分的大鼠正式入模[9-10]。
2.3 干预方法
2.3.1 针刺干预方法 针刺+溶栓组大鼠于造模后2 h给予针刺干预,并在相应时间点(造模后4.5、6 h)进行溶栓治疗。取穴:选取“醒脑开窍”针刺法主穴双侧内关、水沟。针刺方法:选用华佗牌针灸针(0.18 mm×13.0 mm),向鼻中隔方向斜刺水沟穴2~3 mm,采用雀啄手法行针1 min,留针30 min;直刺内关穴,深度为3 mm,行提插捻转泻法1 min,留针30 min。
2.3.2 溶栓方法 溶栓组大鼠在造模后相应时间点(4.5、6 h),将rt-PA稀释后按10 mg·kg-1经尾静脉缓慢注入。
2.4 Bederson法进行神经行为学评分
评分标准参考Bederson 6级5分法[9-10],对各组大鼠分别于造模后2 h和24 h各评分1次。无明显神经功能损伤症状为0分;对侧前肢无法完全伸直为1分;拉尾时,对侧前肢抓力下降为2分;可在所有方向上自发运动,只有在拉尾时向对侧转圈为3分;自发向对侧转圈为4分;死亡为5分。
2.5 TTC染色法检测脑梗死体积百分比
各组取5只大鼠于造模后24 h麻醉处死,冰上剥离大脑,去除嗅球、小脑和脑干,将脑组织置于-30 ℃冰箱快速冷冻15 min后切成厚度均匀的8片。将脑切片置于2%TTC染色液中,避光,37 ℃恒温孵育15 min,期间翻动脑片1~2次。染色后正常脑组织为红色,梗死区域为白色。小心将脑切片置于深色背景上,按顺序排列,纸巾吸取周围多余染色液。相机拍摄后输入计算机,运用Image J图像处理软件计算,脑梗死体积百分比=梗死体积/全脑体积×100%。
2.6 EB渗透法测定BBB通透性
各组取3只大鼠,处死前2 h尾静脉注射2%EB溶液(0.4 mL·100 g-1),循环2 h后心脏灌注250 mL提前预冷的生理盐水,当右心房流出的液体变清澈以及肝脏、四肢变白即可取材。将大脑切成左右两半,滤纸吸干表面水分并称质量。将称质量后的右侧大脑半球浸入甲酰胺(1 mL·100 mg-1),随后进行匀浆。60 ℃水浴箱中孵育24 h,以13 000 r·min-1的速度离心20 min,小心取得上清液。利用酶标仪,在620 nm波长处测量吸光度。根据EB标准曲线,获取上清液中EB的含量。
2.7 干湿质量法测定脑含水量
各组取3只大鼠,造模后4 h麻醉处死,冰上剥离大脑,去除嗅球、小脑及脑干,将大脑切成左右两半,滤纸吸干表面水分。称取右侧大脑半球质量(湿质量),随后将其放入100 ℃烤箱中干燥,并在24 h后再次称取右侧半球质量(干质量)。根据公式:脑含水量=(湿质量-干质量)/湿质量×100%。
2.8 机制研究
2.8.1 实验分组、模型制备与干预方法 48只大鼠被随机分为假手术组、模型组、6 h溶栓组、针刺+6 h溶栓组,每组12只。造模和干预方法同2.2、2.3。
2.8.2 标本采集 造模后24 h麻醉处死动物,冰上剥离右侧大脑半球梗死皮层区域,迅速置于冻存管中,移至-80 ℃超低温冰箱冷冻保存备用。
2.8.3 qPCR检测大脑皮层中GFAP、AQP-4 mRNA表达 Trizol法提取大脑皮层总RNA,分光光度计检测总RNA浓度。逆转录(20 μL体系)获得cDNA后,实时荧光定量PCR仪进行扩增。扩增条件:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,40个循环。引物由上海捷瑞生物工程有限公司设计合成,引物序列见表1。反应结束后,以GAPDH为内参,采用2-ΔΔCt法分析mRNA相对表达量。

表1 引物序列
2.8.4 Western blot检测大脑皮层中GFAP、AQP-4蛋白表达 采用RIPA蛋白裂解液提取大脑皮层总蛋白。BCA法检测蛋白浓度。蛋白定量后,配置SDS-PAGE进行电泳、转膜、封闭。分别加入一抗:GFAP一抗(1∶1 000)、AQP-4一抗(1∶2 000)、β-tubulin一抗(1∶5 000)、GAPDH一抗(1∶5 000),4 ℃孵育过夜。次日洗涤后加入羊抗兔二抗(1∶10 000)室温孵育2 h,充分洗涤,化学发光,显影,定影。通过Image J软件处理得到各蛋白的目的条带与内参条带的灰度比值。每组实验重复2次。
2.9 统计学方法
3 结果
3.1 模型制备过程中脑血流变化
模型制备过程中,右侧脑血流波动变化,主要分为3个阶段。①造模前,钝性分离右侧RCCA、RECA、RICA,脑血流水平虽有所波动但总体维持在较高水平;②夹闭右侧RCCA及RICA后,脑血流突然下降,之后大体保持平稳;③注射血栓,堵塞MCA后,脑血流将进一步下降,当数值基本稳定保持于初始值的20%~30%时,初步认为造模成功。见图2。
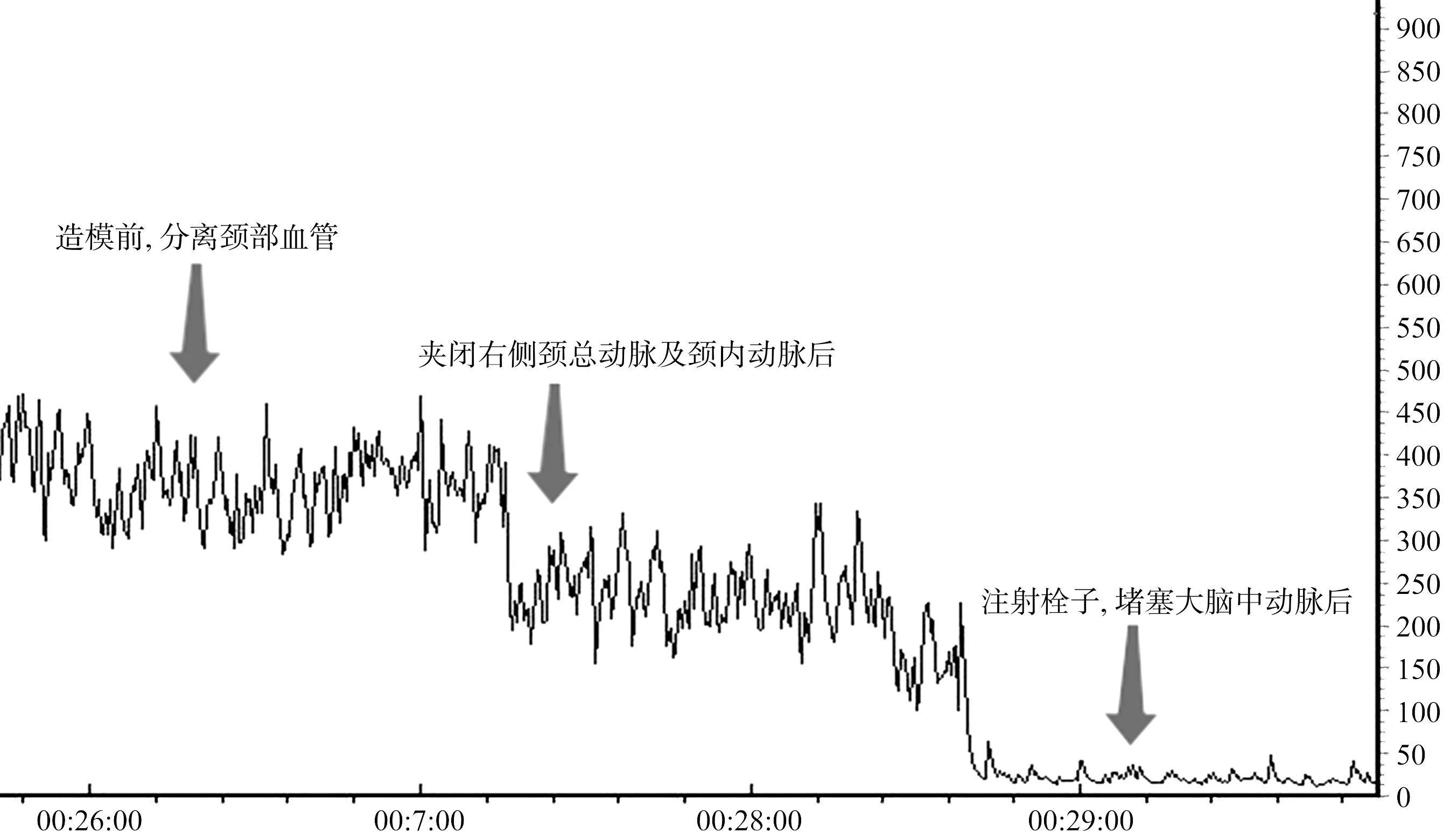
图2 模型制备过程中脑血流变化
3.2 针刺对脑梗死大鼠溶栓后神经行为学评分的影响
造模后2 h神经行为学评分结果显示:假手术组未出现神经功能缺损情况,其余各组评分均明显高于假手术组(P<0.01),干预各组与模型组差异无统计学意义(P>0.05)。造模后24 h神经行为学评分结果显示:模型组大鼠的神经行为学评分明显高于假手术组(P<0.01);4.5 h溶栓组与针刺+4.5 h溶栓组大鼠的神经行为学评分差异无统计学意义(P>0.05),均明显低于模型组(P<0.01);与模型组、6 h溶栓组相比,针刺+6 h溶栓组大鼠的神经行为学评分均明显降低(P<0.05,P<0.01)。见图3。

注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与6 h溶栓组比较,图3 各组大鼠造模后2 h和24 h神经行为学评分比较
3.3 针刺对脑梗死大鼠溶栓后脑梗死体积百分比的影响
模型组大鼠脑梗死体积百分比明显高于假手术组(P<0.01)。4.5 h溶栓组与针刺+4.5 h溶栓组大鼠的脑梗死体积百分比差异无统计学意义(P>0.05),均显著低于模型组(P<0.01)。与模型组、6 h溶栓组相比,针刺+6 h溶栓组大鼠的脑梗死体积百分比均明显降低(P<0.05)。见图4~5。

图4 各组大鼠TTC染色图

注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05, ##P<0.01;与6 h溶栓组比较,
3.4 针刺对脑梗死大鼠溶栓后BBB通透性的影响
模型组大鼠的EB含量明显高于假手术组(P<0.01)。4.5 h溶栓组与针刺+4.5 h溶栓组大鼠的EB含量差异无统计学意义(P>0.05),均明显低于模型组(P<0.01)。与模型组相比,6 h溶栓组大鼠的EB含量升高(P<0.01),针刺+6 h溶栓组大鼠的EB含量降低(P<0.01)。针刺+6 h溶栓组大鼠的EB含量明显低于6 h溶栓组(P<0.01)。见图6~7。

图6 各组大鼠EB图

注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01; 与6 h溶栓组比较,
3.5 针刺对脑梗死大鼠溶栓后脑含水量的影响
模型组大鼠的脑含水量明显高于假手术组(P<0.01)。4.5 h溶栓组与针刺+4.5 h溶栓组大鼠的脑含水量差异无统计学意义(P>0.05),均明显低于模型组(P<0.01)。与模型组相比,6 h溶栓组大鼠的脑含水量升高(P<0.01),针刺+6 h溶栓组大鼠的脑含水量降低(P<0.05)。针刺+6 h溶栓组大鼠的脑含水量明显低于6 h溶栓组(P<0.01)。见图8。
3.6 针刺对脑梗死大鼠溶栓后大脑皮层GFAP、AQP-4 mRNA表达的影响
本研究已经证实针刺可将安全溶栓时限提高到6 h,因此选用6 h溶栓组进行后续机制研究。模型组大鼠大脑皮层GFAP、AQP-4的mRNA表达水平均明显高于假手术组(P<0.01)。与模型组相比,6 h溶栓组大鼠大脑皮层GFAP、AQP-4的mRNA表达水平升高,差异均无统计学意义(P>0.05)。与模型组、6 h溶栓组相比,针刺+6 h溶栓组大鼠大脑皮层GFAP、AQP-4的mRNA表达水平明显降低(P<0.01)。见图9。

注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05, ##P<0.01;与6 h溶栓组比较,

注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01; 与6 h溶栓组比较,
3.7 针刺对脑梗死大鼠溶栓后大脑皮层GFAP、AQP-4蛋白表达的影响
与假手术组相比,模型组大鼠大脑皮层GFAP、AQP-4的蛋白表达水平均明显升高(P<0.05,P<0.01)。与模型组相比,6 h溶栓组大鼠大脑皮层GFAP、AQP-4的蛋白表达水平升高,差异均无统计学意义(P>0.05)。与模型组、6 h溶栓组相比,针刺+6 h溶栓组大鼠大脑皮层GFAP、AQP-4的蛋白表达水平均降低(P<0.05,P<0.01)。见图10。

注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较, #P<0.05;与6 h溶栓组比较,图10 各组大鼠大脑皮层GFAP、AQP-4蛋白 表达结果比较
4 讨论
2019年美国心脏学会/美国卒中学会指南推荐4.5 h内进行rt-PA静脉溶栓治疗急性脑梗死[11]。溶栓疗法的使用突破了以往的治疗效果。在脑梗死发生的超早期进行rt-PA溶栓治疗,如使用得当,可迅速消除患者肢体功能障碍等症状,显著提高患者的神经功能和日常生活能力。但是临床使用rt-PA静脉注射存在着非常严格的时间窗(3~4.5 h)[2]限制,大部分患者及家属会延误静脉溶栓治疗的最佳时间[12]。一旦超过时间窗界限,不仅达不到预期的溶栓疗效,还会进一步破坏BBB,增加出血性转化[13]、脑水肿[14]等溶栓并发症的风险。本实验发现大鼠发生脑梗死后,会出现神经功能损伤、脑组织破坏、BBB通透性增加以及脑组织水肿等症状;溶栓时间窗内(4.5 h)进行单纯溶栓治疗或针刺配合溶栓治疗,均具有较理想的脑保护效应且作用相仿。而在脑梗死发病6 h进行溶栓,更易产生出血性转化、脑水肿等溶栓副作用,降低了溶栓安全性;但是针刺及时介入后,在脑梗死发病6 h进行溶栓,能够显著改善神经功能,减小脑梗死体积百分比,降低BBB通透性,减轻脑水肿等,仍具有安全性的效应。因此,针刺早期介入到脑梗死溶栓治疗中,可提高溶栓安全性,延长溶栓时间窗。
星形胶质细胞是中枢神经系统内数量最多、分布最广的一类胶质细胞,生理条件下,可发挥代谢支持、控制神经递质传递、调节BBB等作用,维持大脑正常功能[15-17]。作为BBB组成部分之一,星形胶质细胞对维持BBB结构功能具有重要作用。脑缺血再灌注后,星形胶质细胞活化增殖,在梗死灶周围及远离的脑区形成大量的反应性星形胶质细胞,早于巨噬细胞和反应性小胶质细胞产生大量的炎症介质,启动炎症级联反应,从而破坏BBB,造成缺血再灌注期损伤[18-19]。因此,可通过抑制星形胶质细胞活化来保护BBB。GFAP是星形胶质细胞特异性标记蛋白,正常脑组织中仅有少量表达。当脑缺血再灌注发生后,受损区域脑组织的星形胶质细胞被激活,此时GFAP表达量会增加,故其表达量的增加通常作为中枢神经系统损伤后星形胶质细胞活化增生的标志[20]。AQP-4是中枢神经系统最主要的水通道蛋白,广泛存在于星形胶质细胞中[21],可介导星形胶质细胞调节水在脑、血管和脑室之间的交换,并参与脑缺血后星形胶质细胞激活,是决定星形胶质细胞结构功能的重要分子。研究表明,下调AQP-4表达,可削弱脑内星形胶质细胞激活,减轻脑水肿损伤[22]。
本研究中qPCR和Western blot实验结果提示:模型组GFAP、AQP-4表达均明显高于假手术组,说明脑梗死发生后星形胶质细胞大量活化,破坏脑组织;造模后6 h予以单纯溶栓治疗,星形胶质细胞仍在活化,说明超时间窗溶栓不能发挥脑保护的作用,会影响溶栓疗法的应用;在造模后2 h予以针刺配合6 h内溶栓治疗能够显著降低GFAP、AQP-4表达,表明针刺可抑制星形胶质细胞活化,保护BBB,减少超时间窗溶栓的并发症,提高超时间窗溶栓安全性。
本研究证实了针刺早期介入能够通过抑制星形胶质细胞活化提高超时间窗溶栓安全性,更好地发挥脑保护作用,为临床治疗脑梗死提供新的思路。此外,星形胶质细胞活化增生的标志AQP-4与GFAP之间的交互作用仍不明确,有待进一步研究。
