EN2沉默对肝癌HepG2细胞凋亡以及PTEN/PI3K/Akt信号通路的影响*
2021-11-02计张奕崔溪溪李玉芳
徐 燕 杨 蕴 计张奕 崔溪溪 李玉芳
昆山市第一人民医院肿瘤科 (江苏 昆山, 215300)
肝细胞癌(HCC)是最常见消化道恶性肿瘤之一,严重危害患者身心健康。因此,探究肝癌发生、发展的确切机制对肝癌的靶向治疗至关重要[1]。Engrailed-2(EN2)基因属于非Ⅰ类同源异型盒家族成员,近期研究显示其在乳腺癌组织中表达水平高于正常组织[2],而在肾癌中表达水平低于正常组织[3],在肿瘤的发生、发展中发挥双向调控作用[4]。目前,该基因在肝癌中的研究不多,本研究通过体外培养肝癌HepG2细胞,同时沉默EN2表达,探究沉默EN2后对肝癌细胞凋亡的影响以及可能的作用机制,为肝癌的靶向治疗提供一定的参考。
1 材料与方法
1.1 实验细胞 肝癌细胞系HepG2购于中国科学院上海生物细胞研究所,保存在-80℃冰箱内。
1.2 试剂与仪器 RPMI培养基、青霉素与链霉素、胰酶、DMSO(Gibco,美国);胎牛血清(fetal bovine serum,FBS)、MTT、Lipofectamine 2000转染试剂盒(Invitrogen,美国);兔抗EN2、辣根过氧化物酶标记(Horse radish peroxidase,HRP)IgG、十号染色体上缺失的磷酸酯酶和张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)、单抗(BD,美国);CCK8检测试剂、蛋白提取试剂盒(Taraka,日本);p-PI3K、p-Akt、β-actin抗体(R&D,美国);定量PCR仪、流式细胞仪(Backman,美国);凝胶成像仪、垂直电泳槽购于(Bio-rad,美国)。
1.3 实验方法
1.3.1 细胞培养 将细胞从-80℃冰箱取出后置于37℃水浴中迅速解冻,添加含FBS的RMPI 1640培养基,1 000 rpm离心后,舍弃上层培养液加入PBS溶液清洗细胞,置于37℃ 5% CO2培养箱内添加含FBS的RMPI 1640培养基培养细胞,当80%细胞融合时,添加胰酶进行消化,随后添加含10%FBS、双抗的RPMI 1640培养基进行传代培养,培养至第三代用于后续研究。
1.3.2 细胞转染 取对数期肝癌细胞系HepG2,接种细胞6孔板内,每孔内细胞密度均调整为5×105个/ml,加入不含FBS的RPMI 1640培养基内培养1 h,严格按照Lipofectamine 2000转染试剂盒转染,细胞分为三组:空白对照组(Control组):将转染试剂转染至HepG2细胞;阴性转染组(NC-siRNA组):将阴性序列NC-siRNA转染至HepG2细胞;EN2-siRNA组:将EN2-siRNA序列转染至HepG2细胞,每组均设定6个重复孔,转染后添加10%FBS、双抗的RPMI 1640培养基培养6~8 h,更换上层培养液为含FBS的RPMI 1640培养基,继续培养48 h,收集细胞,进行后续检测。
1.3.3 CKK-8法检测细胞增殖情况 分别收集三组转染后细胞,密度调整为1.0×105个/孔,接种至96孔细胞培养板,分别培养24、36、48、72 h添加CKK-8试剂,避光孵育4 h,用酶标仪检测492 nm溶液吸光度,计算EN2-siRNA对细胞增殖抑制率的影响,细胞抑制率(%)=(空白组吸光度-实验组吸光度)/空白组吸光度×100%。每个浓度设置6个重复,实验重复三次。
1.3.4 细胞克隆形成实验 收集转染后细胞,调整细胞密度为200个/孔,接种细胞培养板放置培养箱中培养10~14 d,待细胞出现克隆时(直径超过1 mm计数),加入固定剂(甲硫醇:冰醋酸=1∶7)常温下固定15 min后,采用0.1% Gimsa溶液染色30 min,PBS清洗、干燥后拍照肉眼统计细胞克隆形成数目。
1.3.5 流式细胞术检测细胞凋亡 各组细胞转染后密度调整为2×105个/孔接种细胞培养板中,培养48 h后,离心收集细胞,添加Annexin-V、PI染液,室温下避光孵育15 min。通过30 μm筛网过滤单个细胞,Annexin-V和PI双重染色坏死细胞,Annexin-V染色凋亡细胞,置于流式细胞仪分析细胞凋亡情况,细胞凋亡率=凋亡细胞数量/细胞总数×100%。
1.3.6 流式细胞术检测细胞周期阻滞 各组细胞转染后密度调整为2×105个/孔接种细胞培养板中,培养48 h后,置于冰冷乙醇中4℃环境中固定30 min,添加400 μg/mL RNA酶以及40 μg/ml PI,于37℃孵育30 min。置于流式细胞仪中分析细胞各时期DNA含量变化情况。
1.3.7 蛋白免疫印迹(WB) 加入RIPA裂解液裂解细胞,提取细胞总蛋白,BCA法测定蛋白浓度,上样等量蛋白,SDS-PAGE电泳分离蛋白,转移PDVF膜上封闭后用PBS溶液清洗后加入添加一抗稀释液(稀释倍数1∶500),37℃孵育2 h,添加HRP标记IgG二抗(稀释倍数:1∶5 000)室温下孵育1 h,以β-actin蛋白表达作为内参,采用凝胶分析仪软件评估蛋白表达水平。
1.4 统计学方法 本研究所有数据均使用统计学软件SPSS 20.0进行分析。计量资料均采用平均值±标准差表示,两组间比较行t检验,多组间对比采用单因素方差分析,进一步两两对比采用snk-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 EN2沉默后转染鉴定 Control组转染后并未发出绿色荧光,NC-siRNA组、EN2-siRNA组发出大量荧光。荧光显微镜检测结果显示,转染后HepG2细胞发出绿色荧光,转染效率达到80%以上,见图1。

图1 各组EN2沉默后转染情况 (×100)
2.2 EN2沉默后对肝癌HepG2细胞EN2蛋白的影响 EN2-siRNA组细胞EN2蛋白表达显著低于Control组、NC-siRNA组(P<0.05),见图2,表1。

图2 WB检测EN2沉默后EN2蛋白表达图

表1 各组细胞中EN2蛋白表达比较
2.3 EN2沉默对肝癌HepG2细胞增殖的影响 随着时间的延长,EN2-siRNA组细胞增殖抑制率逐渐升高,EN2-siRNA组不同时间点细胞增殖抑制率均显著高于Control组和NC-siRNA组(P<0.05),见表2。

表2 EN2沉默对不同细胞组不同时间点肝癌HepG2细胞增殖的影响比较
2.4 EN2沉默对肝癌HepG2细胞克隆数量的影响 EN2-siRNA组细胞克隆数量形成数目显著低于Control组和NC-siRNA组(P<0.05),见图3,表3。

图3 各组细胞克隆形成情况

表3 各组细胞克隆数量情况比较
2.5 EN2沉默对肝癌HepG2细胞凋亡的影响 EN2-siRNA组HepG2细胞凋亡率显著高于Control组和NC-siRNA组(P<0.05),见图4,表4。

图4 EN2沉默后肝癌HepG2细胞凋亡情况流式细胞图

表4 各组细胞凋亡率情况比较
2.6 EN2沉默对HepG2细胞周期的影响 EN2-siRNA组细胞G1期细胞比例显著高于Control组、NC-siRNA组,S期细胞比例显著低于Control组、NC-siRNA组(P<0.05)。三组细胞G2期无显著变化(P>0.05),见图5,表5。

图5 EN2沉默后HepG2细胞周期的变化细胞流式图

表5 各组细胞周期变化情况比较
2.7 EN2沉默后对肝癌HepG2细胞PTEN/PI3K/Akt信号通路的影响 EN2-siRNA组细胞p-PI3K、p-Akt蛋白表达显著低于Control组、NC-siRNA组,PTEN蛋白高于Control组、NC-siRNA组(P<0.05),见图6,表6。
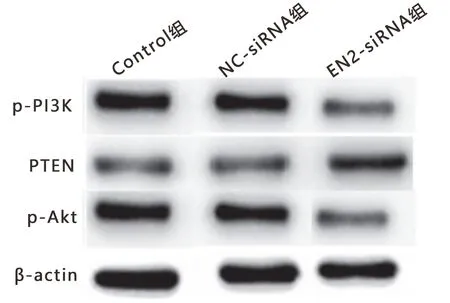
图6 EN2沉默后p-PI3K、PTEN、p-Akt蛋白表达图

表6 各组细胞中p-PI3K、PTEN、p-Akt蛋白比较
3 讨论
HCC病死率在所有恶性肿瘤中位列第二,患者在早期无特异临床症状,且肿瘤高转移性,侵袭性导致肿瘤侵润组织,已转移组织难以完全清除,严重影响患者生存质量[5,6]。传统临床治疗方法如手术切除结合辅助放化疗,虽具有一定的临床疗效,但仍有部分患者治疗后出现复发或转移,肝癌仍是威胁人类生命健康的恶性肿瘤之一[7]。流行病学调查显示,肝癌患者治疗后5年内生存率不足20%,预后极为不佳[8]。因此,探究肝癌的发病机制,以此寻找新型治疗靶点,探索新型治疗策略,可为HCC提供新的治疗思路。
EN-2为同源异型盒基因亚家族成员,在胚胎神经发育以及成人神经系统维持中发挥重要调控功能,大量证据显示EN-2表达水平的异常可造成细胞的过度增殖,引发肿瘤[9,10]。EN-2在肿瘤中发挥双向调控功能,在一部分肿瘤中扮演抑癌基因的角色,而在另一部分肿瘤中演原癌基因的角色[11]。Espíndula等[12]研究显示EN2在乳腺癌细胞中表达水平明显高于正常细胞,且在动物中证实小鼠乳腺细胞中过表达EN2后,小鼠出现乳腺细胞循环时间短以及细胞间连接缺失等肿瘤特征。Morgan等[13]研究显示膀胱癌细胞中EN2呈高表达,干扰EN2的表达后能够显著抑制细胞增殖、促进凋亡。郭琦[14]发现抑制EN2表达后能够减缓前列腺癌细胞增殖、迁移,且同时可上调 PAX2蛋白表达。Lai等[15]研究显示在肾透明细胞癌组织中EN2呈现低表达或缺失表达,而在正常肾组织中呈高表达,且随着分化程度升高,表达水平逐渐升高,提示在肾癌中EN2可能扮演抑癌基因的作用。然而在肝癌中发挥促癌还是抑癌作用,目前尚不明确。本研究发现NC-siRNA、EN2-siRNA组肝癌细胞发出较强率绿色荧光,EN-2蛋白表达水平显著降低,提示转染成功。进一步研究显示EN2-siRNA组细胞增殖抑制率显著升高,细胞凋亡率显著升高,提示EN-2沉默后可有效抑制肝癌细胞增殖,诱导其凋亡。
无限增殖为肿瘤细胞特征之一,根本原因在于肿瘤细胞周期失调。苌新伟等[16]研究显示下调EN2表达,可抑制肝癌细胞HepG2增殖和侵袭。徐银等[17]体外培养肾小管上皮细胞时沉默EN2基因后,则细胞增殖受到抑制,细胞周期阻滞于G1期。本研究显示EN2-siRNA组G1期细胞比例显著高于NC组、Control组,S期细胞比例显著低于NC组、Control组,提示EN2沉默后能够引发肝癌细胞HepG2阻滞于G1期,推测EN2沉默后可能通过细胞周期阻滞,发挥肿瘤细胞抑制作用。
PTEN位于人染色体10q23.3,大量证据显示其属于抑癌基因,在甲状腺癌、前列腺癌、膀胱癌等多种肿瘤中PTEN均呈低表达[18,19]。吴金柱等[20]通过免疫组化实验发现PTEN在正常肝组织完全表达,在肝癌组织中呈现低表达,PTEN阳性表达率与肿瘤组织学分级呈正相关,提示PTEN在肝癌中发挥抑癌基因的作用。PTEN/PI3K/AKT广泛参与细胞凋亡,PI3P为PI3K的底物,PTEN可使PIP3脱磷酸化,进而抑制PI3K/AKT通路,过往研究显示,PTEN丢失后可使AKT持续磷酸化,激活PI3K/AKT通路,进而发挥肿瘤细胞抗凋亡作用。LI等[21]研究显示干扰EN2基因表达后能够显著升高PTEN表达,提示EN2可能通过抑制PTEN蛋白的表达进而促进肿瘤细胞的增殖、侵袭。基于以上研究推测EN2干扰EN2基因表达后对PTEN/PI3K/AKT通路会有一定的影响。本研究结果显示干扰EN2基因表达后能够显著升高PTEN表达,提示EN2沉默后可通过上调PTEN蛋白的表达,抑制PI3K/AKT通路蛋白的表达,促进细胞凋亡。
综上所述,EN2沉默后可促肝癌HepG2细胞凋亡,可能通过上调PTEN蛋白、抑制PI3K/AKT通路,然而EN2沉默后是否同通过其它途径影响肝癌的发生发展还有待后续深入研究。
