复肝春3号方对肝硬化腹水大鼠血管活性物质、水通道蛋白的影响*
2021-11-02管佳畅张志威毛宇湘
管佳畅 张志威 毛宇湘△
1.河北医科大学第四医院中医科 (河北 石家庄, 050011) 2.河北省中医院脾胃病二科
肝硬化是临床常见的慢性进行性肝病,由一种或多种病因长期或反复作用于肝脏导致,是一种慢性、进行性、弥漫性的肝病终末阶段。肝硬化早期表现隐匿,不易察觉,晚期以肝功能减退和门脉高压为主要临床表现,常出现多种并发症,如腹水、消化道出血、肝性脑病等。腹水是肝硬化失代偿期最突出的临床表现,大约75%以上失代偿期患者会出现腹水[1]。腹水的形成不但影响患者生活质量,而且增加了自发性腹膜炎、上消化道出血、肾功能衰竭或肝性脑病等风险,提示预后不良。因此对肝硬化腹水形成机制的研究一直是临床研究的热点、难点。目前对于肝硬化腹水主张综合治疗,而中医药作为综合疗法中的重要组成部分,因其整体观念强,能够调理机体的内环境,提高机体免疫功能,缓解临床症状体征,改善生活质量,防治并发症,且无创伤、毒副作用小,价格便宜等,越来越受到中西医临床重视。 毛宇湘教授以中医理论为指导,并结合多年临床实践经验,研制出由醋鳖甲、生牡蛎、赤芍、蜜紫菀等中药组成的具有软肝活血、开肺利水功效的复肝春3号方(FGC-3),临床疗效显著[2]。本研究拟通过观察FGC-3对肝硬化腹水大鼠血清血管活性物质(NO、ET-1)、水通道蛋白AQP8水平的影响,以探索其利水机制。
1 材料与方法
1.1 实验材料
1.1.1 动物 清洁级雄性Wistar大鼠75只,体重(200±20 g),购于河北省实验动物中心,许可证号SCXK(冀2013-1-003),合格证号1509127。实验动物饲养于河北省实验动物中心动物实验室,使用IVC实验动物饲养笼具,每笼3只,饲养温度22~24℃,相对湿度40%~60%,每天明暗时间交替各12 h。普通全价颗粒饲料购自河北省实验动物中心。饮水瓶、瓶塞、笼具均经灭菌处理,造模期间以15%食用酒作为饮料让大鼠自由饮用,自由进食。实验人员严格按要求进出实验室并规范操作,妥善处理死亡动物,并做记录。以上实验动物饲养及操作条件均符合《实验动物质量管理办法》和《河北省实验动物管理办法》的要求。
1.1.2 实验药品 FGC-3颗粒剂由醋鳖甲2袋(批号1027064,相当于饮片20 g)、防己1袋(批号1027479,相当于饮片10 g)、泽兰2袋(批号1027204,相当于饮片20 g)、赤芍1袋(批号1027457,相当于饮片10 g)、生白芍1袋(批号1017947,相当于饮片10 g)、蜜紫菀1袋(批号1024779,相当于饮片10 g)、当归1袋(批号1027479,相当于饮片10 g)、生牡蛎1袋(批号1027079,相当于饮片20 g)、桔梗1袋(批号1005479,相当于饮片10 g)等药组成,由广东一方制药有限公司提供。复方鳖甲软肝片(批号0927236,内蒙古福瑞医疗科技股份有限公司,规格:0.5 g×48片,批准文号:国药准字Z19991011)。
1.1.3 试剂及仪器 CCl4(天津市永大化学试剂公司),橄榄油(上海德丽莎食品有限公司),白酒(乙醇体积分数为50%) 石家庄酒厂,一抗(北京博奥森生物技术有限公司),二抗、DAB(北京中杉金桥生物技术有限公司),正常山羊血清、辣根酶标记链霉卵白素工作液(美国Invitrogen公司),NO测试盒(南京建成生物工程研究所),ET-1试剂盒(美国Cloud-Clone Corp.公司),全自动生化分析仪(日本HITACHI 7600型),显微镜(日本奥林巴斯 BX51T-PHD-J11),多功能真彩色细胞图象分析管理系统(美国Media Cybernetics),酶标仪(美国BIO-TEK ELx800型)。
1.2 实验方法
1.2.1 肝硬化模型的建立及动物分组给药 选取清洁级雄性Wistar大鼠75只,适应性喂养1周。随机选取8只大鼠为空白对照组(N组),标准饮食喂养14周后处死,留取标本。剩余大鼠用改良的CCl4-乙醇综合法进行肝硬化腹水造模,经腹部皮下注射40% CCl4-橄榄油溶液,每4 d 1次,首次剂量为0.5 ml/100 g,从第2次开始注射剂量改为0.3 ml/100 g,每次注药时严格测量体重,以15%乙醇(由上述白酒加蒸馏水配制,下同)作为饮料,饲料均为普通饲料,持续10周。通过查腹水征及腹腔诊断性穿刺确定41只大鼠存在腹水,随机分为5组进行药物治疗,灌胃剂量为1 ml/100 g。模型组(M组,n=9):灌服生理盐水;FGC-3高剂量组(G组,n=8):用FGC-3制剂灌胃,剂量为52 g/kg体重;FGC-3中剂量组(Z组,n=8):用FGC-3制剂灌胃,剂量为26 g/kg体重;FGC-3低剂量组(D组,n=8):FGC-3制剂灌胃,剂量为16.25 g/kg体重;复方鳖甲软肝片组(F组,n=8):用复方鳖甲软肝片溶液灌胃,剂量为26 g/kg体重。每日1次,共4周。治疗期间造模组仍以40% CCl4-橄榄油溶液按0.3 ml/100 g体重于大鼠腹部皮下注射,每周1次,至14周实验结束,处死大鼠,留取标本。
1.2.2 取材 药物干预1个月后,所有大鼠禁食12 h以上,称重大鼠后摘眼球取血,收集约5 ml血液于无菌试管中,离心,分离血清,密封,-40℃冻存,以备血清ELISA检测。颈椎脱臼法处死各组大鼠,剖开大鼠腹腔,抽取腹腔积液;观察肝脏的颜色、质地,取大鼠肝组织,置于冻存管,并迅速将其低温保存于液氮罐内,用于检测AQP8。选取同一部位肝组织,浸泡于4%中性甲醛固定液中,以做HE染色切片。
1.2.3 观察指标与方法 ①一般情况:观察各组大鼠的精神状态、活动度、皮毛色泽、饮食、二便、体重变化及死亡情况。②腹腔积液量:脱颈处死大鼠后,沿腹中线剪开3.0 cm,以无菌注射器抽取腹腔内液体,记录腹腔积液量。③肝功能指标:以全自动生化仪检测天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(Alb)。④肝纤维化指标:放射免疫法测定透明质酸酶(HA)、层黏连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)。⑤血清NO:严格按试剂盒操作说明书用硝酸还原酶法测定其吸光度(OD)值。⑥血清ET-1:严格按试剂盒操作说明书用ELISA法定量测定其OD值。⑦免疫组化测定肝组织AQP8使用形态学图像分析系统对照片进行分析,测定阳性反应物的积分光密度(IOD)值。

2 结果
2.1 一般情况 本实验造模大鼠死亡率为20.9%,腹水形成率为61.19%。N组大鼠精神状态良好,活动正常,皮毛、饮食、二便无明显改变,体重逐渐增加。M组大鼠出现明显的腹部胀大、精神萎靡、易惊、活动减少、皮毛干枯毛躁泛黄易脱落、饮食减少、尿量减少、大便灰白、体重先减轻后增加。第1~4周组大鼠体重逐渐下降10~30 g,第5周无明显变化,个别大鼠体重下降约10 g,第6~10周约80%大鼠体重逐渐上升20~60 g。经治疗,G、Z、D、F组大鼠上述情况均有不同程度改善,体重增加,其中G组大鼠改善最明显,其次为Z组,D组、F组相比无明显差异。
2.2 肝组织外观形态的比较 肉眼观察大鼠肝组织,N组肝脏质地好,色鲜红,表面光滑,边缘锐利,大小适中;M组肝脏质脆,色暗红或褐色,表面凹凸不平,可见大小不等的结节,边缘较钝,体积变小;D组肝脏肿大、质脆,色褐色,表面粗颗粒状,边缘较钝;G、Z、F组肝脏肿大,色深红,表面尚光滑,可见不同程度细小颗粒状区域,边缘较锐利。
2.3 各组大鼠腹水量的比较 见表1。
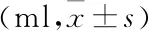
表1 各组大鼠腹水量情况比较
2.4 各组大鼠肝功能指标情况 见表2。

表2 各组大鼠肝功能情况比较
2.5 各组大鼠肝纤维化指标 见表3。
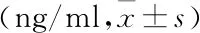
表3 各组大鼠肝纤维化指标情况比较
2.6 FGC-3颗粒剂作用各组大鼠后对NO、ET-1、AQP8 IOD值的影响 见表4。
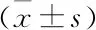
表4 各组大鼠NO、ET-1、AQP8 IOD值的比较
2.7 光镜下观察 见图1。 N组大鼠肝小叶结构清晰,肝细胞形态正常,围绕中央静脉呈放射状整齐排列,未见炎症、变性或坏死等病理改变。M组多数正常肝小叶结构明显破坏,出现广泛的变性、出血、炎症等病理改变,典型假小叶广泛形成。与M组比较,各治疗组肝脏结构均见不同程度减轻,G组最明显。G组肝小叶结构轻度破坏,可见纤维组织增生,未见假小叶,脂肪变性消失,肝细胞轻微充血肿胀,较少炎性细胞浸润。Z组可见纤维间隔减少,少量假小叶形成,脂肪变性基本消失,可见少量炎性细胞浸润。D组肝小叶结构破坏,假小叶形成明显,可见大量炎性细胞浸润,可见变性、出血等病理改变,较M组有改善,但程度不明显。F组肝小叶结构中度破坏,部分假小叶形成,可见炎性细胞浸润。

图1 各组大鼠的肝脏病理(HE染色)
3 讨论
我国是慢性病毒性肝炎大国,仅慢性乙型肝炎病毒感染者就达9 300万人;且随着人们生活条件的改善,酒精性肝病、脂肪性肝病的患病率日益增高;大气环境的改变,药物的不合理应用导致的药物性肝炎、自身免疫性肝炎、隐源性肝炎的患病率也逐渐升高,这些肝脏疾病均可导致肝细胞发生变性、坏死、再生,反复进行,进而导致肝脏弥漫性纤维化、再生结节和假小叶形成,发展为肝硬化[3]。 肝硬化是消化系统的常见病,年发病率为17/100 000,且多见于20~50岁的男性,其中城市男性50~60岁的患病者的病死率高达112/100 000,我国肝硬化患者大多数为肝炎后肝硬化,少部分为酒精性肝硬化和血吸虫性肝硬化。有资料表明,腹水形成后1年死亡率15%,2年死亡率44%,5年生存率为14%~88%[4]。因此对肝硬化腹水形成机制的研究一直是临床研究的热点、难点,其对指导临床用药,进而改善肝硬化腹水患者生活质量及寿命有重要意义。
现代医学认为肝硬化腹水的形成是门静脉高压和肝功能减退共同作用的结果,其过程复杂,可涉及多种因素,主要有门静脉压力增高、血浆胶体渗透压下降、神经体液因素、肝肠淋巴液形成增多而漏入腹腔形成腹水等[5]。一方面,肝硬化时会出现全身血流动力学的变化,形成心输出量增加、低外周血管阻力的高动力循环状态,目前多数学者认为,这是由于肝功能减退和侧支血管开放,使得肝脏对部分血管活性物质(如NO、ET)灭活减少所致。这些血管活性物质可能介导了肝硬化门静脉高压症高动力循环状态的形成、维持和发展过程,参与了腹水的形成[6,7]。另一方面,则是与某些体液因素相关,如抗利尿激素、AQP等。AQP是一组对水有高选择性的细胞跨膜转运蛋白,是跨膜水转运的重要通道[8]。肝细胞上有多种AQPs,其中以AQP8的表达最高。AQP8表达缺乏可能导致肝细胞损伤、水液代谢失调,从而引起肝硬化、腹水等相关疾病的发生[9]。
肝硬化腹水,属于中医“鼓胀”范围。诸多医家将鼓胀的病因归结于酒食不节、情志刺激、虫毒感染、病后续发四个方面,其病机为肝、脾、肾受损,气滞、血瘀、水停腹中。病理因素不外乎气滞、血瘀、水湿,三者各有侧重,又相互为因,错杂为病。对其治疗,历代医家多从肝脾肾论治。病性总属本虚标实,表示为主者当根据气、血、水的偏盛,分别采用行气、活血、祛湿利水或暂用攻逐之法;本虚为主者,当根据阴阳的不同,分别采取温补脾肾或滋养肝肾法,同时配合行气活血利水,以补虚不忘实,泻实不忘虚为原则[10]。毛宇湘教授结合多年治疗肝硬化腹水的临床经验,提出肝硬化腹水从肺论治的理论,这是由肺的生理特性和生理功能决定的。肺为华盖,为水之上源,主通调水道,通过肺的宣发肃降实现;肺主气,人体的整个水液代谢过程,也都要依赖于气的推动而完成。《素问·经脉别论篇》中有云:“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺,通调水道,下输膀胱,水精四布,五经并行……”,强调肺在水液疏布方面的作用。相对应的肝硬化腹水的治疗原则即为宣肺利水,《素问·汤液醪醴论》中有“平治于权衡,去宛陈莝……开鬼门,洁净府”的论述,此处的开鬼门,即为宣肺利水。
在此理论指导下,毛宇湘教授结合多年治疗肝硬化腹水的临床经验,提出顽固性肝硬化腹水从肺论治的思路,并研制出具有软肝活血、开肺利水功效的复肝春3号方,方中醋鳖甲、生牡蛎为君,软肝为本,二者均入肝经血分,味咸,咸能软坚散结。肝为血脏,体阴用阳,且血瘀是肝硬化腹水中的一个重要病理因素,故用当归、白芍养血柔肝,赤芍等活血化瘀;又肺为水之上源,主通调水道,故用桔梗、蜜紫苑开肺气,理三焦,通调水道,共为臣药。泽兰、防己等利水消肿,为佐使药。本研究显示FGC-3可明显改善肝硬化腹水大鼠的一般情况,减少腹腔积液量,减轻肝组织炎症及肝纤维化程度,降低模型大鼠血清NO、ET-1水平,提高肝硬化腹水大鼠AQP8的表达,可能是其利水的作用机理。
