腹腔镜内镜联合手术应用于胃肿瘤的现状和展望
2021-10-22冯学乾刘海鹏朱小轩魏浩旗陈康黄泽平陈晓
冯学乾,刘海鹏,朱小轩,魏浩旗,陈康,黄泽平,陈晓
【提要】 腹腔镜与内镜联合手术(LECS)是一种将腹腔镜胃切除术与内镜黏膜下剥离术相结合,以适当的、最小的手术切缘切除胃肿瘤的手术方法。LECS的概念最初发展自经典的LECS,其主要用于胃黏膜下肿瘤切除术。无论肿瘤的位置如何,包括食管胃交界处,经典的LECS都是一种安全可行的胃黏膜下肿瘤切除技术。然而,经典的LECS存在腹腔感染风险、肿瘤细胞在腹腔内扩散和播种的局限性。随着LECS的不断改进和发展,如倒置的LECS、非暴露的内窥镜倒置手术、结合腹腔镜和内窥镜治疗肿瘤的非暴露技术和封闭的LECS,几乎解决了上述这些缺点。这促进了LECS用于胃上皮肿瘤的适应证不断扩大,同时也开始应用于其他器官(如十二指肠、结肠和直肠)。随着不断的探索与实践,LECS也可以联合前哨淋巴结导航手术用于部分早期胃癌的治疗。
大多数胃肿瘤,如胃癌和黏膜下肿瘤,在黏膜侧的胃腔内能被内镜精确定位,而在胃腔外则不能。因此,传统腹腔镜胃壁外楔形切除术很准确地定位胃腔内肿瘤切除线,而这些过度或不恰当的切除线可能导致术后胃的解剖结构和功能改变,进而导致胃瘫,或切除边缘阳性导致术后局部复发从而追加手术[1-2]。因此,通过内镜精确定位切割线对胃肿瘤局部安全切除具有重要意义[3]。腹腔镜和腔内内镜胃楔形切除术已经在一些研究中描述[4-5],然而,在这些研究中,腔内内镜仅用于观察肿瘤的位置,作用只是确保适当的切除边缘,而不用于准确定位切割线。因此开发了一种腹腔镜内镜联合手术(laparoscopic endoscopic cooperative surgery,LECS),即结合内镜黏膜下剥离(ESD)精确定位切割线的技术和腹腔镜胃壁楔形切除术,并成功应用于切除胃黏膜下肿瘤(submucosal tumors,SMTs)。2008年首次报道LECS之后,许多临床工作者已将这个手术方式应用于临床工作中[6-12]。他们认为LECS对于胃黏膜下肿物切除是安全可行的,并且无论肿瘤位置如何,LECS都可以用于大多数患者。应用LECS,可以保留部分胃壁的血管和神经,保持胃的正常蠕动,提高患者术后的生活质量[6]。LECS最初的适应证是胃黏膜肿瘤,不伴有溃疡,将这种手术方式命名为经典LECS[13]。随后,LECS的适应证不断扩大包括胃上皮肿瘤、伴有溃疡的胃黏膜肿瘤和不伴淋巴结转移的胃癌等[14]。与此同时一些改进的LCES术式应用于临床,如倒置的LCES[14]、非暴露内镜下胃壁翻转手术(non-exposed endoscopic wall-inversion surgery,NEWS)[15-19]、非暴露技术的腹腔镜和内镜联合入路(clean non exposure technique,CLEAN-NET)[20]和封闭的LCES[21]。目前这些改良的术式已成功应用于胃上皮肿瘤患者。如今,LECS的概念也应用于其他器官,如十二指肠[22]、结肠和直肠[23]。然而,这些改良的LECS术式在其他器官中的有效性和安全性还没有得到充分的研究。在这篇综述中,我们描述了胃肠道中经典的LECS以及改进的LECS的概念,并讨论了其现状和未来的发展潜力。
1 经典LCES
Hiki等[6]在2008年介绍了这种方法,LECS是一种结合腹腔镜胃部分切除术和ESD的手术方式,腹腔镜内镜联合手术主要用于胃SMTs的切除,如胃间质瘤的手术治疗等。由于内镜治疗早期胃癌的近期疗效显著,可提高肿瘤治愈性切除率,手术安全性高,且能显著提高患者术后远期生存质量[24],因此在这个手术过程中,内镜同时入路可使外科医生根据适当的切线切除胃壁,切缘不会过多或不足。LECS为胃SMTs的治疗性切除提供了足够的边缘,从而优化了切除面积。以上所述的优势正是LECS相对于其他手术方法的最大优势。即使胃SMTs位于食管胃结合部(eastro-esophageal junction,EGJ)附近,LECS也可以避免近端胃切除术。手术医生站在病人的右侧,第一助手站在病人的左侧,腹腔镜医生站在病人的足侧,内窥镜医生站在病人的头侧,摄像头端口插入脐部,在10 mmHg气腹下的腹腔镜图像辅助下,在右上、右下、左上和左下象限放置四个附加端口(一个12 mm端口和三个5 mm端口)。通过腔内内镜和腹腔镜确定肿瘤的位置,肿瘤周围的血管准备用止血夹和超声刀处理。术中应尽量减少对血管和神经创伤,以防止胃瘀血、缺血及术后胃瘫。然后,通过内镜将10%甘油注射到黏膜下层,使用标准针刀进行一个小的初始切割,并使用IT-2刀(KD-611L;Olympus,T okyo,Japan)插入黏膜下层,用IT-2刀将预先标记的区域沿圆周切开,然后将一把标准的针刀推向浆膜,在腹腔镜图像中可以看到标准针刀的刀尖位于浆肌层下,用于穿透浆液肌层,然后用IT-2刀或超声激活装置从穿孔点开始进行浆膜剥离,沿黏膜下切口线切开浆膜层。通过借助内镜和腹腔镜可以准确定位合适的切除线。在腹腔镜的帮助下,尽可能多使用内窥镜设备进行浆肌层切口,其余部分解剖通过腹腔镜进行,切除肿瘤后,将肿瘤收集到标本袋中并取出,再使用腹腔镜吻合器关闭切口线以及缺损胃壁。最后,通过内镜和腹腔镜确认下没有出血后结束手术。经典LECS已经被证实是治疗胃间质瘤等胃黏膜下肿瘤的一种安全、有效的手术方式[7-9,11,12,25-26],同时LCES也用于早期十二指肠癌[27]的切除。
经典LECS的好处是从黏膜侧确定切除线,从而达到完整和最小切缘的切除。通过确定黏膜表面的切除线,可以准确地切除病变,保证切缘病理上完全阴性。此外,经典LECS在技术上比改良LECS操作更容易。因此,经典LECS可以应用于包括EGJ在内的任何部位的肿瘤。在位于食管交界处的胃黏膜下肿瘤患者中,可以最大限度地发挥LECS的优势,避免常规的全胃切除或近端胃切除。Hoteya等[8]人报道了用经典LECS治疗位于食管交界处的胃黏膜下肿瘤的可行性和安全性。因为经典LECS在术中胃壁开放,因此可能造成肿瘤和胃液污染腹腔,从而引起腹腔感染和肿瘤的播散。因此,经典LECS只能应用于胃黏膜下肿瘤。
2 倒置的LCES(Inverted LECS)
为防止胃内容物外溢,2012年Nunobe等[14]在1例早期胃癌切除术中应用了一种与经典LECS不同的手术方式,从而降低了肿瘤细胞在腹腔内扩散的风险。倒置的LECS手术是经内镜确定切除线后,缝合线穿过已经确定好的切除线,然后提起缝合线将肿瘤周围的胃壁呈冠向上牵引,这一步骤极大减少了胃内容物溢出的风险。最后通过内窥镜和腹腔镜进行全层切除,在此过程中,肿瘤翻转面向胃壁,防止胃液污染和肿瘤与腹壁的接触,将肿瘤切除后经口取出肿瘤。这项技术在理论上最大限度地减少了胃内容物溢出到腹腔的风险,而且防止肿瘤接触任何腹部组织。这种方法也需要在手术过程中打开胃壁,因此不能排除胃内容物污染的轻微风险。既往有研究报道,内镜下黏膜剥离术治疗胃癌未见胃穿孔后肿瘤腹膜播散,即使长期观察也未见[28]。从肿瘤学的观点来看,目前倒置的LECS是安全的;另一方面,Han等[29]报道在胃癌手术中,通过对胃腔内的细胞学清洗可以检测到癌细胞。因此,不打开胃壁的LECS是防止癌细胞扩散到腹膜腔的最好方法。
3 腹腔镜辅助下全层切除术
Abe等[30]报道了腹腔镜辅助下的全层内镜切除术(laparoscopy-assisted endoscopic full thickness resection,LAEFR),它基于与LECS相同的原理,但不是黏膜下剥离,首先内镜在肿瘤周围行全层切除,而腹腔镜通过牵拉胃壁方便显露。当完成2/3切除后,由于CO2扩散到腹膜,致使内镜的手术视野暴露受到阻碍,然后腹腔镜完成全层切除,手术标本经口部取出,通过腹腔镜缝合缺损的胃壁。有学者研究表明ESD与腹腔镜术(laparoscopic,LAP)治疗直径≤5 cm的胃间质瘤是安全、有效的,两者疗效相似,但ESD创伤更小、术后恢复更快、住院费用更低[31],而这种内镜联合腹腔镜的技术不但扩大手术适应证,而且治疗效果显著。目前该技术已成功应用于20例胃间质瘤[30,32]等良性胃黏膜下肿物患者和24例早期胃癌患者[33-35]的治疗,并取得了显著的效果。对于早期胃癌,我们采用腹腔镜对前哨淋巴结进行选择性淋巴结清扫。与此同时,在以上研究中,LAEFR并没有出现相关并发症[30,32-35]。
4 非暴露内镜下胃壁翻转手术
NEWS是一种新的全层切除技术,为治疗早期胃癌的一种微创手术。在此过程中,黏膜标记首先被放置在肿瘤周围,然后在内镜导航下通过腹腔镜进行浆膜标记,然后通过内窥镜将靛胭脂染料、透明质酸钠溶液沿肿瘤周围向黏膜下层注射,经腹腔镜在浆膜斑纹周围进行环状浆膜切开,胃壁肌层线性缝合,使病变倒向胃内。在缝合前,通过腹腔镜手术将海绵插入倒置病变的缝合层和浆膜层之间作为间隔物,在随后的内镜操作中,这种间隔物对黏膜提供反向牵引并保护缝线。最后,内镜在倒置病变周围做黏膜周和黏膜下组织切口,将切除的标本和间隔物经口取出,并用内镜夹封闭黏膜边缘。该技术的优势在于,浆膜层和黏膜层都可以在腹腔镜或内镜的直接可视化下精确切除。该技术最初由Goto等[15]于2011年在猪模型中描述,并成功应用于6例胃间质瘤,其中有2例患者在剥离过程中无意损伤了胃黏膜,其他不良事件均未发生[18]。同时它与选择性淋巴结清扫术联合应用于早期胃癌的切除[17]。
5 清洁无暴露技术
Inoue等[20]开发了一种浆肌层切开后非暴露的全层切除方法,从而保留了黏膜的连续性,起到屏障的作用,可防止胃内容物流入腹膜腔。这种技术称为清洁无暴露技术(CLEANNET)。在这种术式中,经内镜标记后,黏膜层通过缝合线固定在浆肌层上,沿着留置缝线的外侧进行腹腔镜下的浆肌层剥离,直至全层标本被拉起,周围的黏膜也随之被拉起,黏膜层的连续性使用腹腔镜吻合器将全层标本切开,并留有足够的手术边缘。这是一种独特的手术方法,也是一种有吸引力的全层切除胃壁的非暴露技术。然而,如果肿瘤位于贲门或胃上三分之一的后壁,使用该术式可能会有困难。此外,在此过程中,切口线最终从浆膜侧确定。因此,与其他改良的LECS过程相比,适当的切除线可能很难确定,特别是对于上皮性肿瘤,如胃癌。
6 封闭的LCES(Closed-LECS)
Kikuchi等人[21]开发了一种新的无暴露的全层切除术称为“封闭的LECS”。在这个过程中,首先在肿瘤的周边做黏膜标记,然后用内镜沿着周围标记切开,然后在内镜光源的引导下做出与黏膜下剥离线相对应的浆膜斑纹,然后,在浆膜表面缝线的中心放置海绵状间隔物,进行浆膜缝合,将标记的病变部位和间隔物倒置进入胃内。最后,通过内窥镜进行全层切除。切除后的标本和海绵垫片经口收集。封闭的LECS在确定适当的切除线方面是有利的,因为切除线是由内镜确定的,这一过程类似于经典的LECS和倒置LECS。在封闭的LECS中,一个限制是肿瘤的大小,因为切除的标本是经口取出的,仅适用于≤30 mm的胃黏膜下肿瘤。
7 各种LECS的优缺点(表1)

表1 各种LECS的优缺点
8 LECS的未来展望
如我们所述,LECS已经可以安全应用于胃黏膜下肿瘤患者,改进的LECS术式(如Inverted LECS、NEWS、CLEANNET和Closed LECS)主要针对胃上皮肿瘤治疗,也可以应用于早期胃癌,以及在技术上难以用EMR/ESD治疗的患者。如果肿瘤超出EMR/ESD适应证,则有淋巴结转移的可能,必须行胃切除加淋巴结清扫术。Goto等报道了早期胃癌联合前哨淋巴结导航手术(sentinel lymph node navigationsurgery,SNNS)的研究[16,36]。前哨淋巴结(sentinel node,SN)是第一个从原发肿瘤接受淋巴引流的淋巴结。因此,我们可以从前哨淋巴结状态预测其他淋巴结的病理状态。如果检测到前哨淋巴结并确认为肿瘤转移阴性,则可以避免不必要的淋巴结清扫。胃癌联合前哨淋巴结导航手术治疗效果已在多项前瞻性多中心试验中得到验证[37-39]。当改良的LECS与SNNS同时进行时,我们可以为早期胃癌的手术根治提供一种微创手术技术,入路流程见图1。相信随着研究的进步,大数量的临床研究病例资料的收集,LECS的应用范围将会进一步扩大。相信随着临床微创技术的逐渐发展成熟,微创外科时代的来临,临床医师共同追求的“更小创伤、更少疼痛和更快恢复”的目标将会不断实现。
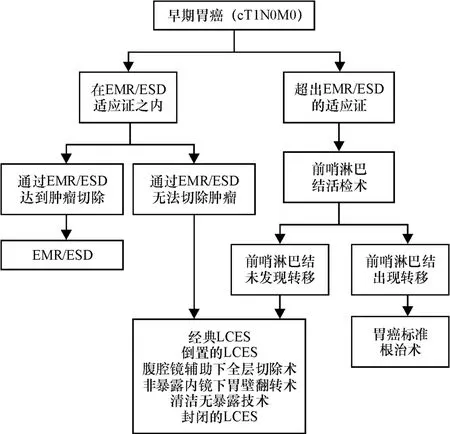
图1 早期胃癌手术入路流程图
