无创诊断指标联合抗gp210对原发性胆汁性胆管炎肝纤维化的预测价值
2021-10-22王静刘晓峰李文波帖君
王静,刘晓峰,李文波,帖君
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种进行性、自身免疫性、慢性胆汁淤积性肝病,其特征是免疫介导的门脉炎症和肝内胆管进行性破坏[1-3],最终发展为肝硬化[4]。PBC的诊断通常基于胆汁淤积相关血清学指标和抗线粒体抗体(antimitochondrial antibodies,AMA)或特异性抗核抗体(antinuclear antibody,ANA)的检测。PBC的病程进展个体差异很大,症状隐匿且非特异[3,5]。肝纤维化进展阶段对于PBC的预后评估和监测治疗应答反应非常有价值[6],特别是对熊去氧胆酸(ursodeoxycholic acid,UDCA)治疗反应不佳的高危患者,评估肝纤维化程度是制定治疗方案、评价疗效的重要手段。最近,一项基于全球PBC研究组数据库的研究再次强调了将肝纤维化进展阶段纳入PBC个体风险分层的必要性[7]。
肝穿刺活检仍是诊断PBC肝纤维化分期的金标准。然而,它是一种侵入性检查手段,并且存在导致并发症甚至死亡的风险[8]。根据最新的指南[1-3],在诊断PBC或监测病情进展时通常不推荐肝活检。因此,通过简单可靠的无创方法评估PBC肝纤维化程度具有重要意义。瞬时弹性成像(transient elastography,TE)测量肝脏硬度值成为评估肝纤维化的热点[1]。然而,其准确性是在有限的证据资料中建立[9-10],并且依赖于专业设备和专家解读经验,因此并不适用于基层医疗机构。
早期研究报告了基于常规血清学检测的简单且经济的无创诊断指标,如天冬氨酸氨基转移酶与丙氨酸氨基转移酶比值(AST to ALT ratio,AAR)[11]、天冬氨酸转氨酶与血小板计数比值指数(AST-to-platelet ratio index,APRI)[12]、基于4因子的纤维化指数(fibrosis index based on 4 factors,FIB-4)[13-14]、Forns指数[15]、LOK指数[16]和FibroIndex[17]。这些方法已被证实可用于预测慢性病毒性肝炎和非酒精性脂肪肝的肝纤维化程度。然而,无创血清标志物在PBC的肝脏病理组织学分期中是否具有准确的预测价值目前仍存在争议[6]。这些指标对PBC肝纤维化或肝硬化的诊断性能仍值得深入探讨。抗gp210和抗sp100是PBC特异性ANA。尽管之前的研究报道了抗gp210在PBC患者中的诊断和预后价值[18-19],但其作为肝脏组织学分期生物标志物的作用仍有待证明。
因此,在这项双中心回顾性研究中,我们评估了一些无创诊断指标(如AAR、APRI、FIB-4和LOK指数)联合或不联合抗gp210用于评估初治PBC患者肝纤维化的诊断效能。此外,我们在抗gp210阳性PBC患者中探索了这些无创标志物与肝脏组织学分期之间的关系,试图验证一种简单、可靠、无创的方法用于评估PBC肝纤维化程度。
1 资料与方法
1.1 一般资料
收集解放军第九六〇医院消化内科(中国济南)和空军军医大学西京消化病医院(中国西安)2005年12月至2020年12月初诊未经治疗的PBC患者208例,并均经肝穿刺活检确诊。其中,男性43例,女性165例,平均年龄为(52.35±8.64)岁,194例(93.3%)AMA阳性,抗gp210阳性患者91例(43.8%),抗sp100阳性患者24例(11.5%)。根据Scheuer分期将患者分为四组:其中Ⅰ期24人,Ⅱ期102人,Ⅲ期57人,Ⅳ期25人。
该研究是根据赫尔辛基宣言进行的回顾性研究,肝活检获得每位患者的书面知情同意,研究方案获得解放军第九六〇医院伦理委员会批准。
1.2 患者纳入与排除标准
根据EASL指南和美国肝病研究协会制定的PBC诊断标准[1,3]纳入患者,即需符合以下任意2项:①碱性磷酸酶(alkaline phosphatase,ALP)或γ-谷氨酰转移酶(gammaglutaryl-transferase,GGT)升高超过6个月;②血清AMA和/或M2亚型阳性;③组织病理学显示小叶间胆管损伤,符合非化脓性胆管炎。排除标准:①合并病毒性肝炎、人类免疫缺陷病毒感染等感染性疾病;②其他肝病如酒精性/非酒精性肝病、Wilson′s病、药物性肝损伤、自身免疫性肝炎(autoimmune hepatitis,AIH)/原发性硬化性胆管 炎(primary sclerosing cholangitis,PSC)重叠综合征患者,以及表现出高转氨酶和免疫球蛋白(immunoglobulin,Ig)G水平等特征的提示AIH/PBC重叠综合征的患者;③炎症性肠病或乳糜泻等其他慢性疾病;④肝脏或肝外恶性肿瘤。
1.3 肝穿刺活检和组织学评估
肝穿刺活检在局部麻醉下由彩色多普勒超声引导进行。肝脏样品经福尔马林固定和石蜡包埋用于组织学分析。常规苏木精-伊红染色用于评估肝脏炎症和纤维化分期。活检标本由两名经验丰富的病理学专家进行评估,他们对彼此的诊断和患者的临床信息均不知情。组织学特征评估包括胆管损伤、胆管减少、淋巴细胞聚集、肉芽肿形成和胆汁淤积,并评估界面性肝炎以排除PBC/AIH重叠综合征。参照Scheuer分期标准:Ⅰ期,胆管炎期,炎症局限于汇管区;Ⅱ期,小胆管增生期,损伤涉及周围实质,胆管减少出现代偿反应;Ⅲ期,瘢痕期,伴有桥接纤维化;Ⅳ期,肝硬化期,明显肝硬化伴再生结节。
1.4 患者临床特征和血清学指标
所有患者在肝活检前均进行常规临床检验检查,并在活检前不超过3d采集血样。利用Hep-2细胞和大鼠组织切片的间接免疫荧光检测血清AMA。通过免疫印迹分析(EUROIMMUN 检测试剂盒;EUROIMMUN,Medizinische Labordiagnostika AG)检测抗-gp210和抗-sp100。通过免疫比浊法评估血清免疫球蛋白水平。
从病历信息系统中提取患者基线时的人口统计学和临床特征资料,包括年龄、性别、症状、生物化学指标、免疫学指标等,包括自身免疫性抗体、IgG、IgM、白细胞(white blood cell,WBC)、中性粒细胞(neutrophil,NEU)、红细胞(red blood cell,RBC)、平均红细胞体积(mean corpuscular volume,MCV)、血红蛋白(hemoglobin,HGB)、总胆汁酸(total biliary acid,TBA)、总胆固醇(cholesterol,CHO)、甘油三酯(triglyceride,TG)、球蛋白(globulin,GLB)、白蛋白(albumin,ALB)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、ALP、GGT、总胆红素(total bilirubin,TBIL)和国际标准化比值(international normalized ratio,INR)等。
1.5 无创诊断模型计算公式
根据文献[11,13,15-16]中公式计算无创血清学诊断指标,包括AAR、APRI、FIB-4和LOK:AAR =AST/ALT;APRI=[(AST/ULN)×100]/PLT(其中ULN是AST的正常值上限);FIB-4=(年龄×AST)/(PLT×ALT1/2);LOK=-5.56-0.0089×PLT+1.26×AST/ALT+5.27×INR。
1.6 统计学分析
使用SPSS 21.0(IBM,Armonk,NY,USA)软件进行统计分析。呈正态分布的计量资料以表示,组间比较采用t检验或单因素方差分析,呈偏态分布的计量以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料以n(%)表示,组间比较采用χ2检验和Fisher精确检验。以P<0.05为差异有统计学意义。单因素和多因素逻辑回归分析确定与肝纤维化相关的变量,候选变量包括与纤维化严重程度相关的参数以及之前研究中报告的参数。在单因素分析中具有显着差异(P<0.05)的变量纳入多元逻辑回归模型中。
通过计算受试者工作特征(receiver operating characteristic,ROC)曲线下面积来评估诊断效能,根据Youden指数计算识别肝纤维化的最佳截断值,计算敏感度、特异度、阳性和阴性预测值以及似然比,计算诊断的准确性。
2 结果
2.1 不同肝脏组织病理学分期患者临床特征比较
我们将患者分为两组:早期纤维化(ScheuerⅠ和Ⅱ期)和进展期纤维化(ScheuerⅢ和Ⅳ期)。在208名PBC患者中,126名(60.58%)患者被定义为早期纤维化,其余82名(39.42%)患者被定义为进展期纤维化。不同肝脏组织病理学分期的PBC患者临床特征见表1。女性分别占早期和进展期患者的78.6%和80.5%,没有观察到显著的组间差异(P>0.05)。早期和进展期患者的平均年龄分别为(51.40±8.97)岁和(53.76±8.00)岁,组间差异无统计学意义(P>0.05)。血清HGB、MCV、ALT、AST、TP、GLB、ALP、GGT、TBA、CHO、TG、BUN、CRE、FIB、TT、IgM、IgG、AMA、ANA、抗sp100抗体均无明显组间差异(P>0.05)。与早期患者相比,进展期患者的WBC、NEU、RBC、PLT和ALB显著降低(P<0.05),TBIL、APTT、INR水平显著升高(P<0.05)。进展期患者中49例(59.8%)抗gp210阳性,早期患者中42例(33.3%)抗gp210阳性(P<0.01)。与早期患者相比,进展期患者表现出显著更高的AAR(P=0.000)、APRI(P=0.000)和FIB-4(P=0.000)水平(表1)。
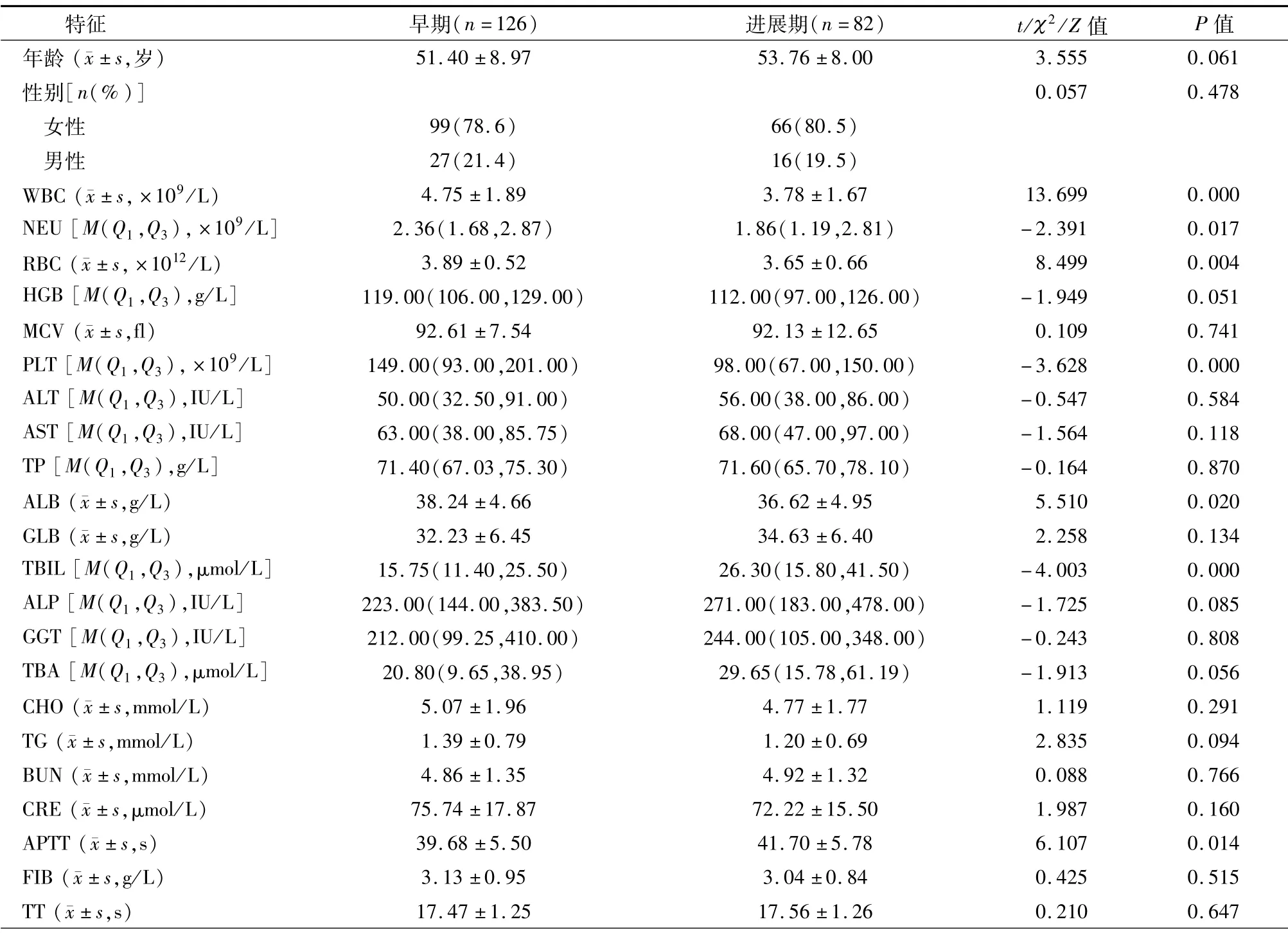
表1 早期和进展期PBC患者的临床特征及单因素分析
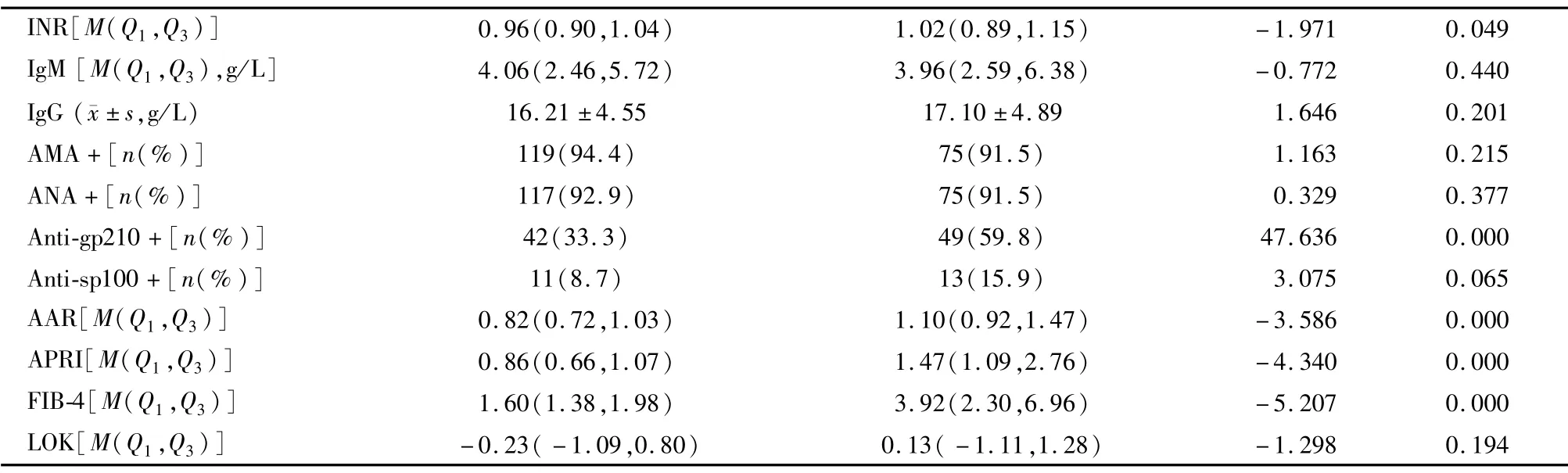
续表1
2.2 PBC患者肝纤维化分期相关变量的Logistic回归分析
单因素分析显示,WBC、RBC、PLT、ALB、TBIL、APTT、INR和抗gp210是PBC患者出现进展期肝纤维化的可能危险因素。结合文献报道,将可能影响PBC患者肝纤维化进展的因素进一步纳入多因素回归分析,以PBC患者肝纤维化分期为因变量,赋值如下:早期=0,进展期=1,以WBC、RBC、PLT、ALB、TBIL、APTT、INR和抗gp210为自变量,其中自变量赋值如下:抗gp210(-)=0,抗gp210(+)=1。结果显示,PLT水平降低、APTT延长和抗gp210阳性表达是PBC患者肝纤维化进展的独立危险因素(表2)。
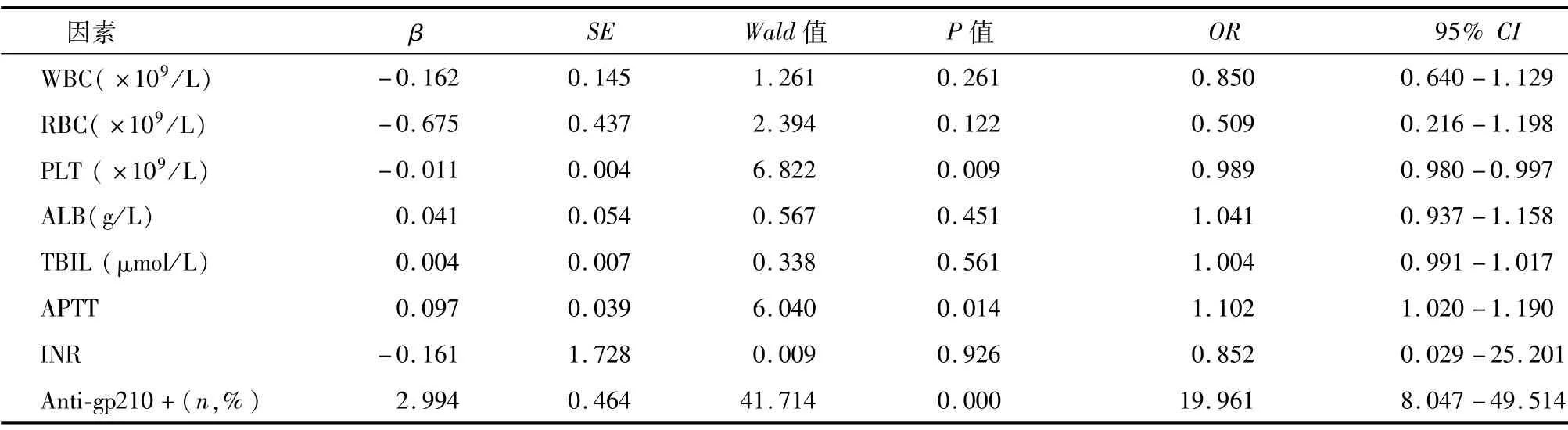
表2 PBC患者肝纤维化进展的多因素Logistic回归分析
2.3 AAR、APRI、FIB-4、LOK联合或不联合抗gp210对PBC患者进展期肝纤维化的诊断效能对比
ROC曲线分析显示,AAR、APRI、FIB-4和LOK预测诊断PBC进展期肝纤维化的AUC均<70%(图1A和表3);而AAR、APRI、FIB-4和LOK联合抗gp210预测诊断晚期肝纤维化的AUC分别为0.798(95% CI:0.735-0.860)、0.816(95% CI:0.758-0.875)、0.834(95% CI:0.779-0.888)和0.778(95% CI:0.713-0.844)(图1B和表3)。
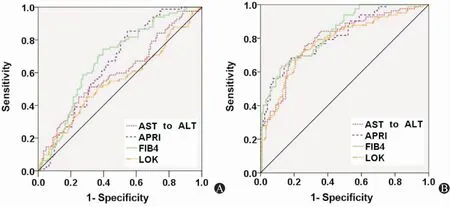
图1 AAR、APRI、FIB-4、LOK联合或不联合抗gp210预测诊断PBC患者进展期肝纤维化的ROC曲线 A:AAR、APRI、FIB-4、LOK单独诊断效能;B:AAR、APRI、FIB-4、LOK联合抗gp210的诊断效能
2.4 AAR、APRI、FIB-4和LOK对抗gp-210阳性PBC患者进展期肝纤维化的诊断效能
在抗gp-210阳性患者中,AAR、APRI、FIB-4和LOK值在肝纤维化进展期显著升高(AAR:P=0.001;APRI:P=0.000;FIB-4:P=0.000;LOK:P=0.016;表3和图2)。AAR、APRI、FIB-4和LOK预测诊断抗gp-210阳性PBC患者进展期肝纤维化的AUC分别为0.748(95% CI:0.633-0.863)、0.812(95% CI:0.709-0.915)、0.874(95% CI:0.798-0.951)和0.674(95%CI:0.548-0.799)(图3和表3)。APRI和FIB-4在预测抗gp210阳性PBC患者进展期肝纤维化的准确性较好。然而,AAR、APRI、FIB-4和LOK用于预测抗gp-210阴性患者进展期肝纤维化的AUC均<70%(表3)。
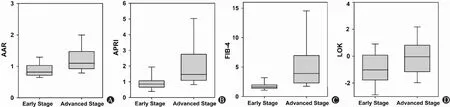
图2 抗gp210阳性PBC患者不同病理学分期AAR、APRI、FIB-4和LOK的箱式图
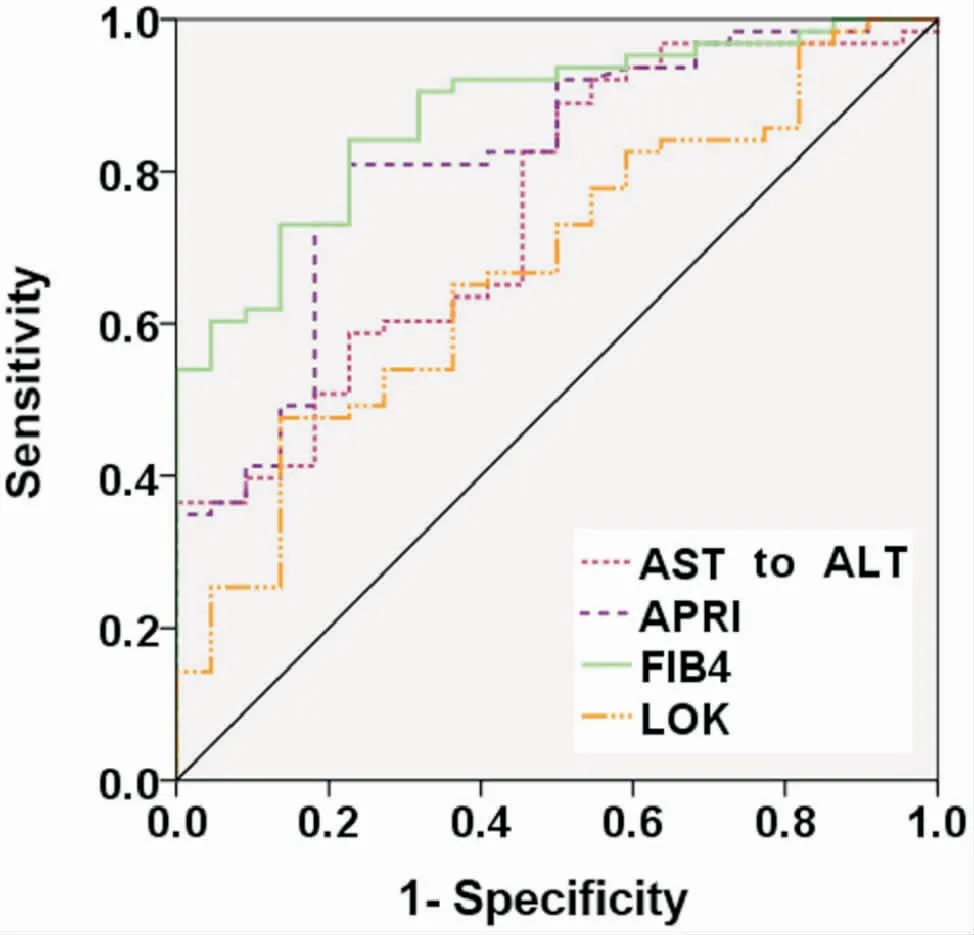
图3 AAR、APRI、FIB-4、LOK诊断抗gp210阳性PBC患者进展期肝纤维化的ROC曲线
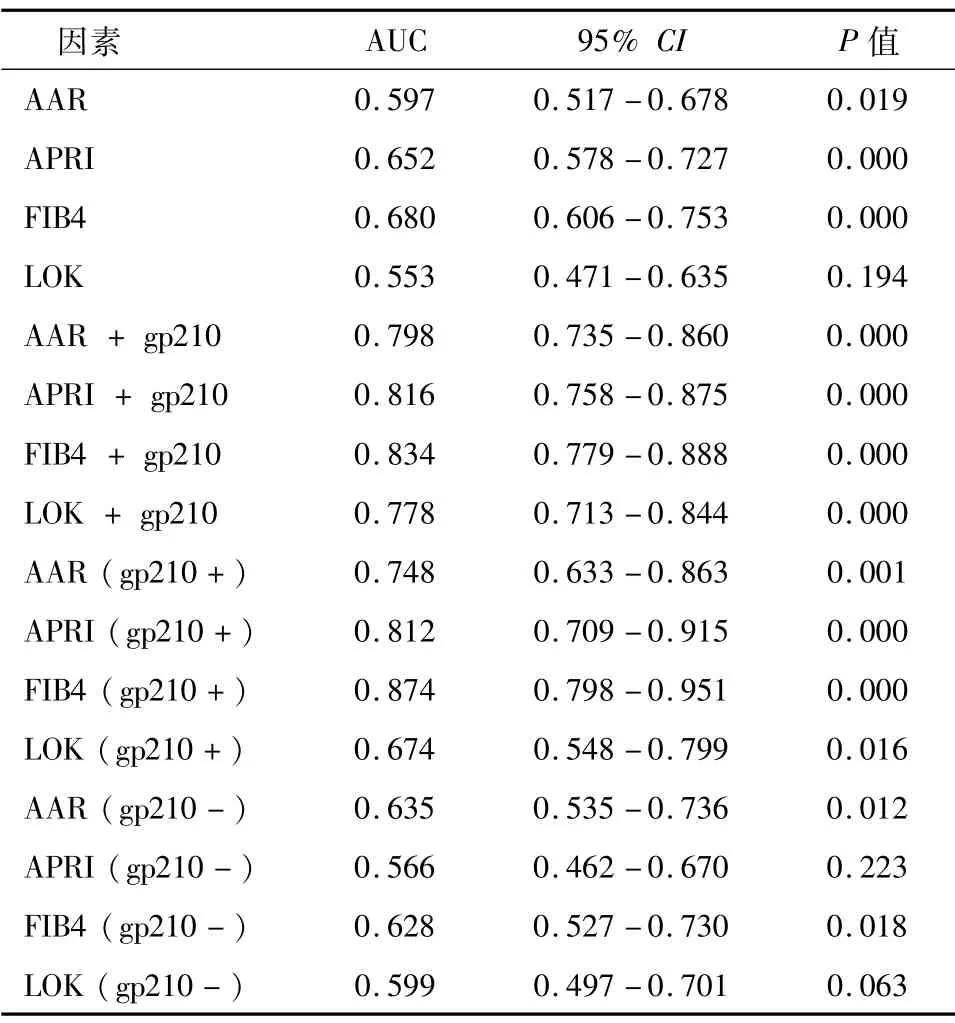
表3 AAR、APRI、FIB-4、LOK联合或不联合抗gp210对PBC患者进展期肝纤维化的诊断效能
在本研究中,抗gp210阳性PBC患者有91例,其中早期肝纤维化42例,进展期肝纤维化49例。分别选择两个临界值(使其特异性达到约95%)以确定早期肝纤维化或进展期肝纤维化。对于AAR、APRI和FIB-4,分别应用较低的临界值(≤0.760、0.734、1.484),此时的敏感性分别为36.4%、31.8%、40.9%,分别有88.3%、90.9%和89.5%的患者被准确诊断为早期肝纤维化;同样,分别应用AAR、APRI和FIB-4较高的临界值(≥1.324、1.999、3.295),其敏感性分别为36.5%、36.5%、60.3%,分别有89.0%、89.0%、93.1%的患者被准确诊断为进展期肝纤维化(表4)。
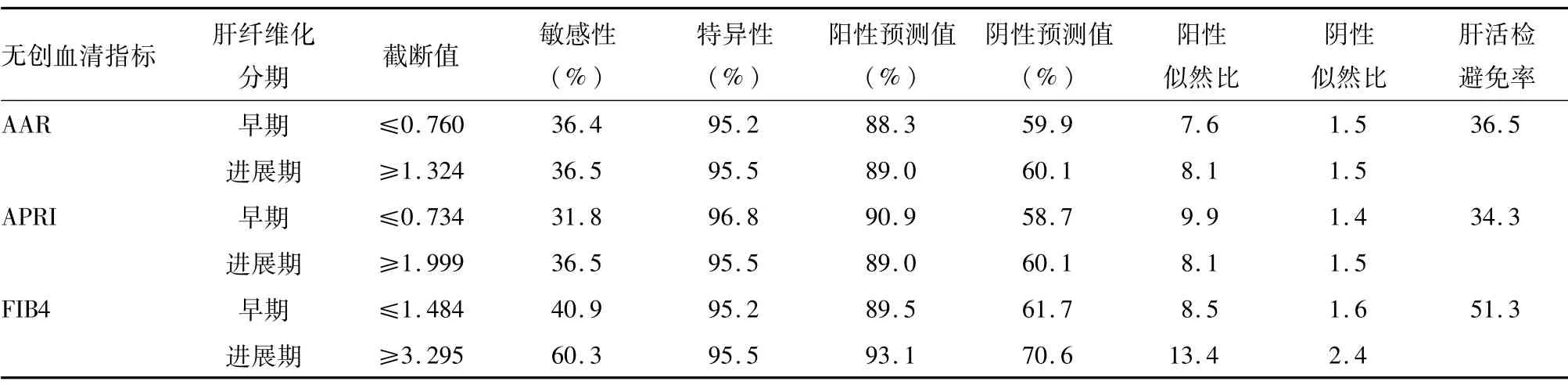
表4 AAR、APRI、FIB-4对抗gp-210阳性PBC患者进展期肝纤维的化的诊断效能
3 讨论
在这项双中心回顾性研究中,我们分析了抗gp210和无创诊断标志对PBC患者肝纤维化分期的诊断价值。当与抗gp210联合诊断时,AAR、APRI和FIB-4具有更好的诊断效能。在抗gp210阳性PBC患者中,APRI和FIB-4在预测肝纤维化分期方面表现出较高的特异性和敏感性。
与Yang等[20]研究一致,我们的研究队列中抗gp210阳性率(43.8%)与日本(26.1%)[21]和西方国家(16%)[22]之前报告的阳性率相比相对较高,其中一个导致患者异质性的原因可能是就诊于三级中心的患者往往病情更为严重[20]。因此,我们可以在一个具有更多抗gp210阳性PBC患者的相对较大的队列中全面探讨抗gp210的作用。在以前的研究中,抗gp210被认为是PBC肝功能严重受损和长期预后更差的预测指标[20-22]。我们的研究证实了抗gp210在预测PBC进展期肝纤维化中的作用。另外,抗gp210也可作为评估PBC治疗反应和长期预后的有价值的标志物。
开发替代肝活检的无创诊断标志物具有非常重要的意义。近年来,有横断面研究验证了增强型肝纤维化评分(enhanced liver fibrosis,ELF)[23]和瞬时弹性成像(transient elastography,TE)[24]测量肝脏硬度预测肝纤维化程度的准确性。然而,这些方法的系统评估和最佳应用范围目前仍是一个需要验证的问题[1-2]。已报道的几种无创标志物,如紫藤凝集素阳性mac-2结合蛋白(wisteria floribunda agglutininpositive mac-2 binding protein,WFA-M2BP)[14]、富含亮氨酸的α2糖蛋白(leucine-rich alpha 2 glycoprotein,LRG)[25]、和嗜酸性粒细胞强效趋化因子(potent chemokines for eosinophils)[26],也可作为预测肝纤维化的手段。然而,这些指标的测量缺乏标准化,并非所有实验室都可以检测。
由于AST、PLT、GGT和CHO在大多数医院和实验室中都是常规检测项目,因此它们的测量结果可靠且足够准确。许多模型(不同的标准)如AAR、APRI、FIB-4、LOK、Forns指数和FibroIndex被证明可以预测病毒性肝炎肝硬化的程度。由于本研究中不同Scheuer分期之间的血清GGT和CHO水平没有显著差异,因此我们没有测试Forns指数和FibroIndex的预测价值。实际上,在我们的队列中,单独使用这些无创标志物预测PBC肝纤维化阶段的敏感性和特异性效能较低,这与先前的研究一致[6,14,26]。然而,当与抗gp210联合诊断,或用于抗gp210阳性PBC亚组的诊断时,它们显示出更高的诊断效能,尤其是FIB-4,显示出较高的特异性和敏感性。在基线特征方面,抗gp210阳性组具有较高的胆红素水平,这在一定程度上提示抗gp210可能与PBC患者胆汁淤积状态相关,而不是与门静脉高压状态(包括较低的白蛋白水平和较低的血小板计数)相关。因此,抗gp210阳性与AAR、APRI、FIB-4和LOK作为诊断标准之间没有重叠效应。
当然,我们应该注意到这项研究有几个局限性。主要限制是这项研究的回顾性和双中心性质,仍需要在不同的队列中进一步验证。第二个限制是,除了PLT、ALP和抗gp-210外,我们没有研究与肝脏病理组织学分期相关的其他指标;在抗gp210阴性患者中仍需要进一步评估。此外,我们中心的另一项研究报道,维生素D水平与PBC患者的疾病严重程度和对UDCA的治疗应答相关[27]。基线水平维生素D的缺乏可能会增加患者对UDCA不完全应答的风险。因此,其他指标如维生素D,与肝脏组织学分期的相关性需要进一步确认。第三,抗gp210和间接血清标志物在预后中的作用需要在未来进一步验证。
综上所述,这项研究探讨了非侵入性标志物和抗gp210对PBC肝脏纤维化严重程度的预测价值。AAR、APRI和FIB-4与抗gp210联合,对评估PBC肝纤维化严重程度具有较高诊断效能。由于其在抗gp210阳性患者中的高诊断敏感性和特异性性,FIB-4可作为预测PBC肝纤维化严重程度的有价值的补充诊断手段。此外,由于FIB-4公式中的参数通过常规实验室检测很容易获得,因此可作为基层医疗机构确定初诊PBC患者纤维化阶段的替代标志物。
