5例原发性甲状腺淋巴瘤的临床报道并文献复习
2021-10-20张定喜孔伟博马超
张定喜,孔伟博,马超
(许昌市人民医院 普通外科,河南 许昌 461000)
原发性甲状腺淋巴瘤(primary thyroid lymphoma,PTL)是一种相对少见的甲状腺恶性肿瘤,定义为原发于甲状腺内淋巴组织的恶性肿瘤,伴或不伴颈部区域淋巴结浸润,占甲状腺恶性肿瘤的1%~5%,其在所有结外恶性淋巴瘤中的占比不足7%[1-2],具体发病机制尚未明确,可能与桥本甲状腺炎(Hashimoto thyroiditis,HT)及自身免疫疾病相关[3],PTL多见于老年女性,男女比例为1∶3~1∶4[4],临床特点及影像学表现多无特异性,多表现为甲状腺迅速增大导致的相关压迫症状,细针穿刺活检是诊断PTL的重要手段,但准确率较低,临床容易误诊、漏诊而延误治疗。本研究回顾性分析许昌市人民医院普外科收治的5例PTL患者的临床资料,并复习国内外相关文献,分析其发病机制、临床表现、诊断、治疗和预后情况,以期为临床医生对该病的规范诊疗提供参考。
1 临床资料
1.1 一般资料收集许昌市人民医院2014年1月至2020年12月经穿刺活检或术后病理证实的5例PTL患者。具体临床资料见表1。其中男2例,女3例,年龄52~64岁,中位年龄61岁,病程10 d~1 a,中位病程4个月。所有患者均因短期内迅速增大的颈部包块入院。患者术前均常规行甲状腺功能、喉镜、彩超和CT等检查,喉镜检查示1例单侧声带麻痹,彩超检查示2例甲状腺弥漫性增大,3例考虑颈部淋巴结转移,颈部CT示1例气管受压移位,4例行细针穿刺细胞学检查(fine needle aspiration cytology,FNAC),其中2例考虑恶性肿瘤,1例考虑淋巴瘤,1例穿刺无法诊断。
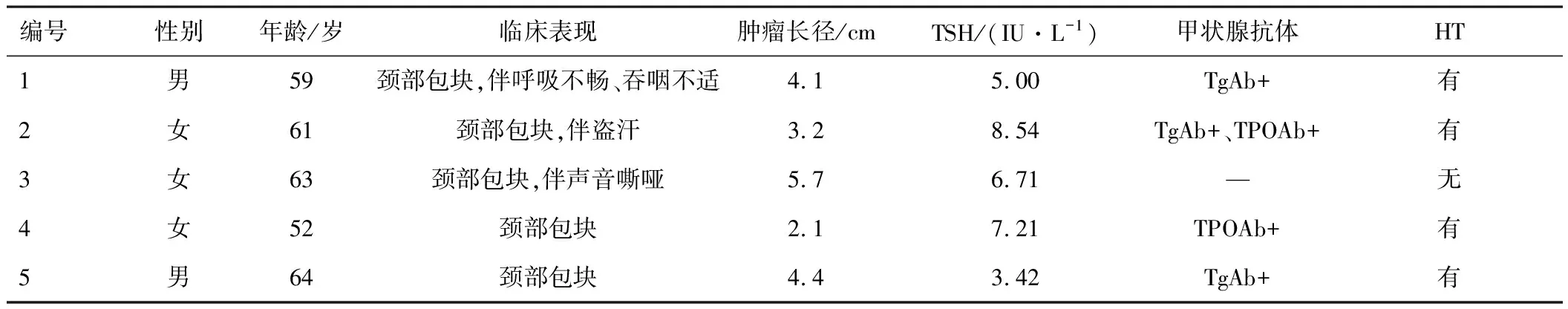
表1 5例PTL患者的临床资料
1.2 治疗情况所有患者均接受手术治疗,诊断、分期及手术方式见表2。4例患者进一步行全身化疗,其中1例行CHOP方案(环磷酰胺、阿霉素、长春新碱、泼尼松联合治疗),3例行R-CHOP方案(CHOP联合利妥昔单克隆抗体)。另外1例患者仅手术切除肿瘤,拒绝进一步治疗。化疗患者中有2例接受放疗,照射区域主要包括颈部、甲状腺区域及上纵隔。
1.3 病理结果所有患者均常规送术中冰冻检查,其中3例为甲状腺炎,1例考虑淋巴瘤,1例不排除淋巴瘤,术后常规病理均确诊为PTL,其中4例患者伴HT。所有患者均行免疫组化检查,最终确诊弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)3例,黏膜相关淋巴组织(mucosa-associated lymphoid tissue,MALT)淋巴瘤2例。见表2。
1.4 随访情况采用电话和门诊复查相结合,所有患者全部获得随访,随访时间10~77个月,中位随访时间为37个月,随访时间截止至2020年12月,术后生存期超过5 a者2例,超过1 a者2例,随访不足1 a者1例,至今均无瘤生存。见表2。
2 讨论
PTL是一种相对少见的甲状腺恶性肿瘤,通常发生于50~70岁的老年女性,男女比例为1∶3~1∶4,多为B细胞来源的非霍奇金淋巴瘤,最常见的病理类型为DLBCL和MALT淋巴瘤[1],MALT淋巴瘤通常表现为惰性,而DLBCL则具有更强的侵袭性。短期(一般在发病最初的6个月)内迅速增大的颈部肿块是其典型临床表现,可伴有声音嘶哑、吞咽困难、呼吸困难等伴随症状,10%的患者可出现发热、盗汗、体质量减轻和颈部淋巴结肿大等B型症状[5]。实验室检查多无特异性,约1/10的患者伴有甲状腺功能减退。本研究中患者性别、高发年龄与既往文献[1,4]报道相符,5例均因颈部包块短期内增大就诊,其中3例有呼吸不畅、吞咽不适及声音嘶哑等症状,符合PTL的典型临床表现。
目前PTL具体发病机制尚未明确,通常认为是由于慢性抗原刺激和自身抗体产生进而诱导淋巴组织恶变。因HT的慢性炎症刺激和自身抗体的产生,可导致甲状腺淋巴细胞组织增生,继而发生恶变[6],故HT是PTL的公认危险因素。HT患者罹患PTL的危险系数比正常人高60~80倍[7],高达86%的PTL有HT的患病基础[8]。本研究中4例患者术后病理证实合并HT,与文献报道[6,8]相符合。因此,老年患者在HT基础上出现短期内迅速增长的甲状腺肿物时需警惕PTL的可能,并尽早行FNAC或手术活检以明确诊断。
PTL的临床体征、影像学检查等均缺乏特异性表现,通常难以与HT、甲状腺未分化癌相鉴别,早期诊断困难,但如果超声提示患者在HT基础上存在单发低回声结节时应高度警惕PTL的可能[9],最终确诊依靠病理诊断。有研究认为FNAC检查对PTL的诊断有较高价值[10],结合免疫表型检测可进一步提高诊断准确率,但目前细胞学病理诊断相对困难,导致了FNAC诊断效能较差[11]。也有研究报道,FNAC活检准确率取决于DLBCL与MALT淋巴瘤的比例,DLBCL的占比与FNAC的活检准确率成正比[12]。本研究中有4例患者行术前FNAC检查,病理回示可疑淋巴瘤1例,占25%,分析其原因可能是FNAC所获得组织量较小,若穿刺部位不理想,容易漏诊或误诊,且组织结构上很难区分PTL、HT与甲状腺未分化癌,因此FNAC检查仅能对PTL诊断起到提示作用,最可靠的依然为完整切除瘤体行术后常规病理及免疫组化检查。
因缺乏大量的临床随机对照研究,PTL的最佳治疗方式仍存在争议[1]。Graff-Baker等[13]认为,外科手术在PTL治疗中的重要性逐年降低,PTL手术治疗占比已由1973—1987年的81%下降至1997—2005年的61%。手术应更多地应用于早期肿瘤、病理活检或缓解症状中[14],对于MALT淋巴瘤(ⅠE期)局限于甲状腺被膜内的肿块,单纯手术切除即可取得较好疗效,对于MALT淋巴瘤分期ⅡE及以上和侵袭性更强的DLBCL,通常推荐化疗和局部放疗相结合的综合治疗。已有研究表明,局部放射治疗和化疗的综合治疗可以迅速缓解压迫症状[15]。如病变局限于颈部及纵隔,可以采用局部放射治疗,对于局部放疗的剂量,有研究表明,大剂量(>40 Gy)放射治疗可明显改善患者的总体预后生存期[7]。目前,CHOP仍是全身化疗的首选方案,对于CD20(+)的患者,还可采用联合利妥昔单克隆抗体的R-CHOP方案,该方案对初治、复发或化疗抵抗的患者均可取得较好疗效[16]。本研究5例患者均行手术治疗,与文献报道[1,16]存在冲突,可能与PTL临床误诊率较高、多数患者需依靠术后病理确诊相关。
PTL预后在很大程度上取决于组织学分类和疾病分期[17],一项基于3 466例PTL患者的随访研究发现[2],PTL患者的总体中位生存期为11.6 a,5 a生存率为75%,10 a生存率为59%,Ⅰ、Ⅱ和Ⅲ~Ⅳ期的5 a生存率分别为86%、81%和64%。按组织学分类分析,MALT淋巴瘤患者的5 a生存率可达96%,恶性程度更高的DLBCL则为75%。PTL的预后不良因素包括高龄(>80岁)、B型症状、β2微球蛋白增高、淋巴结转移、高水平乳酸脱氢酶、病理分型为DLBCL型等[16]。
PTL是一种极为罕见的甲状腺恶性肿瘤,多为B细胞来源的非霍奇金淋巴瘤,DLBCL和MALT淋巴瘤是最常见的组织学类型。PTL临床表现多无特异性,误诊率及漏诊率较高,HT是PTL的公认危险因素,故对于老年HT患者出现迅速增大的颈部肿块,伴颈部淋巴结肿大或气管受压时,需高度警惕PTL的可能性。超声检查、FNAC等有助于疾病诊断,确诊依赖于病理组织学和免疫组织化学检查,实验室及影像学检查和FNAC诊断价值有限。目前推荐局部放化疗为主的综合治疗,外科手术仅以早期肿瘤、切除活检和缓解压迫为目的,预后在很大程度上取决于组织学分类和疾病分期。
