CXC类趋化因子配体2通过募集肿瘤相关中性粒细胞促进肿瘤微环境中口腔鳞癌细胞侵袭能力的研究
2021-10-19贾馨雨郭治辰孙杨龚忠诚
贾馨雨 郭治辰 孙杨 龚忠诚
已有研究发现炎症中细菌微生物和肿瘤的发展密切相关,影响了肿瘤的生长、侵袭和转移[1]。牙龈卟啉单胞菌(P.gingivalis)是牙周炎主要的病原体。它能侵入上皮细胞,干扰宿主免疫反应和细胞周期[2], 被认为是一种特定且独立的促瘤微生物因子。P.gingivalis经常在OSCC患者的口腔中被检测出来[3-4],有报道称P.gingivalis菌群的失调与OSCC之间存在显著关系。它可以进入OSCC细胞胞质,与OSCC细胞相互作用,形成OSCC肿瘤微环境(tumor-microenvironment,TME),加重慢性炎症,从而加速肿瘤细胞的增长[5-7]。CXC类趋化因子配体2(CXC-lingand,CXCL2),是TME中释放的趋化因子之一。可通过与其特异性受体CXCR2结合激活下游的信号通路引发相关反馈,从而产生生物学效应及功能,促进中性粒细胞趋化、肿瘤细胞生长、维持牙周组织稳态。中性粒细胞(polymorphonuclear leukocytes,PMN)是应答最快的炎性细胞。通过炎症反应,大量PMN被细胞因子聚集至TME中转化为肿瘤相关中性粒细胞(tumor-associated neutrophils,TANs)[8]。当P.gingivalis感染OSCC后形成口腔TME,能够招募大量炎性细胞和炎性介质,而这浸润的细胞又可以进一步的释放多种趋化因子来影响肿瘤的增殖、生长、侵袭、血管生成及转移[9]。其中TANs的趋化一般是认为通过受体CXCRl/CXCR2来实现的[10]。TANs是CXCL2的选择性靶标,它们通过黏附分子CD11b及CD66b的表面来促进它们的活化。本研究探讨CXCL2通过募集TANs促进TME中TSCCA的侵袭力。
1 材料与方法
1.1 主要试剂与仪器
试剂:P.gingivalis(中国北纳生物有限公司);P.gingivalis及细胞荧光染料(上海碧云天生物科技有限公司);TSCCA舌鳞状细胞(上海宾穗生物科技有限公司);胎牛血清(Gibco公司,美国);TRIZOL REAGENT RNA抽提试剂(Invitrogen公司,美国);CCK-8试剂盒、蛋白浓度检测试剂盒(BCA法)(武汉戴安生物科技有限公司);中性粒细胞试剂分离盒(北京索莱宝科技有限公司);蛋白分子量Marker(Fermentas,美国)。
仪器:倒置显微镜(CTR400)、共聚焦显微镜(LASAF_CIP_HWS3)(LEICA,德国);高速离心机(Eppendorf,德国);-80 ℃低温冰箱、酶标仪(Thermo,美国);-20 ℃/4 ℃双极冰箱(青岛海尔);CFX 96 Real-Time System、ChemiDoc MP Imaging System、印迹转移电泳系统(BIO-RAD,美国),电子天平(上海赛多利斯)。
1.2 方法
1.2.1 TSCCA细胞与TANs培养 将冻存的细胞融化于37 ℃水浴锅内,2 min内完成溶解,把融化的细胞转移至15 mL离心管内,1 000 r/5 min离心机离心,使用1 000 μL的移液枪吸弃上清液,使用完全培养基将沉淀细胞悬浮后转移至10 cm培养瓶内,轻轻吹打使细胞均匀,放置于37 ℃、5%CO2恒温培养箱内,过夜培养至贴壁。抽取OSCC患者静脉血使用中性粒细胞试剂盒分离TANs至15 mL离心管内, 方法同上转移至10 cm培养瓶内。
1.2.2 TSCCA细胞与P.gingivalis共培养 将P.gingivalis送上海生工生物有限公司使用16SrRNA对P.gingivalis进行基因测序,验证实验所用菌株是否为标准菌株ATCC33277。用含10%胎牛血清的哥伦比亚液体培养基在厌氧环境下摇菌30 h,用含10%胎牛血清的1640培养基稀释菌液,当A450值=1,菌液的浓度约为:1×109CFU/ml时,共培养模型以(细菌/细胞)感染复数(Multiplicity of infection, MOI)MOI=50(最佳感染复数)建立,将细菌细胞共培养模型置于5%CO2培养箱共培养。染色后通过激光共聚焦显微镜验证P.gingivalis与TSCCA是否共培养成功。
1.2.3 Western blot蛋白印迹试验 提取TSCCA+P.gingivalis组,TSCCA组蛋白后,用BCA法测定蛋白浓度,高温变性处理,12%SDS-PAGE胶分离蛋白,然后将蛋白质转移到PVDF膜上,5%脱脂奶粉封闭2 h,用1∶1 000的抗P.gingivalis(cell signaling technology)、GAPDH(cell signaling technology)抗体完全覆盖PVDF膜,4 ℃过夜,将膜取出,用TBSB洗3×10 min;室温下二抗孵育2 h,TBSB洗3×10 min,使用化学显影液成像。以上实验重复3 次,并使用Image J软件进行蛋白条带分析。
1.2.4 总RNA提取和实时荧光定量PCR(qRT-PCR) 使用TRIzol试剂(Invitrogen)按照说明书提取TSCCA+P.gingivalis+TANs组,TSCCA组,TSCCA+P.gingivalis组,TSCCA+TANs组总RNA,使用反转录试剂盒合成cDNA,利用cDNA模板进行实时定量PCR,引物序列如下,牙龈卟啉单胞菌正向链5′-TCGGTAAGTCAGCG GTGAAAC,16SrRNA 反向链3′-GC-AAGCTGCCTTCGCAAT。CXCL2正向链5'- GGGUUG-ACUUCAAGAACAUTT-3',反向链5'-AUGUUCUUGA-AGUCAACCCTT-3'。CXCR2正向链5'-CTTTTCTACTAGA-TGCCGC-3'反向链5'- AGATGCTGAGACATAT-GAATTT-3',GADPH:5'-AAGGTCGGTGTGAACGGATT-TG-3',反向链5'-TCTAGACCATGTAGTTGAGGTCA-3'。实验重复3 次,取均值,基因相对表达量以2-△△CT计算。
1.2.5 Transwell趋化实验 实验分为3 组,TSCCA+P.gingivalis组、TSCCA组、P.gingivalis组,将各组细胞上清液放入下室,上室均放入200 μL含2×104个/孔TANs细胞悬液放入室温放置1 h。用结晶紫对下层膜进行染色,通过显微镜观察和拍照,实验重复3 次,取均值。
1.2.6 划痕实验 实验分为TSCCA+P.gingivalis+TANs组、TSCCA组、TSCCA+P.gingivalis组TSCCA+TANs组、TSCCA+P.gingivalis+TANs+SCH527123组(其中SCH527123使用浓度为3 nm),以上5 组细胞接种于6 孔板,待细胞长满孔板底,用10 μL的无菌移液枪头垂直孔板底部形成划痕。于0 h用倒置显微镜拍照,记录变化,24 h后PBS冲洗各组细胞3 次,去除划痕处TANs,用倒置显微镜拍照,记录变化,实验重复3 次,取均值。
1.2.7 CCK-8增殖实验 分别将5 组细胞接种细胞悬液 100 μL于 96 孔板,预先放置于37 ℃,5%CO2饱和湿度的培养箱内培养,避光下在每孔内加10 μL的CCK-8试剂,把培养板放置培养箱内1~4 h。在450 nm波长处测定吸光值。
1.2.8 Transwell侵袭实验 预先在Transwell小室中铺Matrigel基质胶1∶8风干后,分别将5 组细胞上清液500 μL放入下室,上室放入200 μL含2×104个/孔TSCCA细胞液,放入室温放置1 h,用结晶紫对下层膜进行染色,通过显微镜观察和拍照并计数。实验重复3 次,取均值。
2 结 果
2.1 TSCCA、TANs、P.gingivalis培养
TSCCA及TANs培养图片(图 1)。使用16SrRNA对P.gingivalis进行基因测序,与标准菌株ATCC33277对比吻合度高达99.93%,显示菌株为牙龈卟啉单胞菌标准菌株ATCC33277(图 2)。使用SYPO9绿色荧光标记P.gingivalis,DAPY蓝色荧光标记细胞核(nu-cleus),Mitotracker red红色荧光标标记线粒体(mitochondria),共培养合并(merge)图,其中绿色荧光标记的细菌进入TSCCA胞质中(图 3)。Western blot, qRT-PCR验证共培养模型其结果显示P.gingivalis+TSCCA共培养组中P.gingivalis蛋白含量及mRNA含量明显高于其余对照组(P<0.001)共培养模型成功建立(图 4)。

图 1 TSCCA和TANs细胞形态

图 2 16SrRNA基因测序

图 3 激光共聚焦验证共培养模型

图 4 Western blot,qRT-PCR验证共培养模型中P.gingivalis表达水平
2.2 Transwell趋化实验
Transwell趋化实验测各组中TANs迁移能力。结果:TSCCA+P.gingivalis组迁移细胞数明显高于其余组,利用Image J软件进行分析(P<0.001) (图 5)。
2.3 qRT-PCR检测CXCL2,CXCR2mRNA含量
qRT-PCR实验检测TSCCA+P.gingivalis+TANs共培养组中CXCL2及其受体CXCR2表达均高于其余组,其CXCL2,CXCR2 mRNA含量明显升高(P<0.001)(图 6)。
2.4 划痕实验,Transwell实验,CCK-8实验检测各组细胞迁移、侵袭、增殖能力
检测TSCCA+P.gingivalis+TANs共培养组迁移率,细胞侵袭数量,增殖能力与其余组相比明显升高(P<0.001)。而加入了SCH527123抑制CXCL2与其受体CXCR2结合后迁移、侵袭、增殖能力明显降低(图 7)。

图 5 检测各组TANs的趋化能力

图 6 检测各组中CXCL2和CXCR2的mRNA水平含量
3 讨 论
诸多研究表明CXCL2在恶性肿瘤中高表达,CXCL2表达水平的增高与恶性肿瘤多种特性相关,例如:迁移、增殖、侵袭,提示CXCL2是一种肿瘤促进因子。Paul等[11]研究表明,在黑色素瘤中CXCL2可能有使非肿瘤细胞向肿瘤细胞转化的功能,其原因可能与其通过旁分泌对肿瘤血管生成及通过自分泌影响黑色素细胞有关。Oue等[12]的研究表明CXCL2与口腔癌恶性程度呈正相关, CXCL2可能通过调节RANKL表达而参与旁分泌环并参与小鼠癌症相关的骨破坏。结合过往经验,建立了口腔TME模型并对CXCL2在TSCCA中的作用起到了有用的见解。
本实验发现,P.gingivalis与TSCCA体外共培养成功后形成的口腔TME对TANs的趋化能力明显高于单纯TSCCA组及P.gingivalis组,提示口腔TME中TSCCA可趋化、募集TANs至口腔肿瘤部位。McDonald等[13]的研究表明,当TANs响应炎症被调用时,TANs数量随着口腔细菌的增加而增多,与本研究结果相符。而实验组TSCCA+P.gingivalis+TANs中其CXCL2, CXCR2含量明显升高,提示CXCL2、CXCR2在实验组中作为重要介质存在并发挥作用,猜测是实验组中TANs的出现使得CXCL2、CXCR2含量明显升高。Pelus等[14]研究表明CXCL2作为TANs的有效趋化因子可将TANs导向炎症部位,与本研究结果相符。
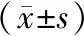
表 1 CCK-8增殖实验检测TSCCA细胞增殖情况
为进一步研究其所发挥的作用,通过划痕实验、侵袭实验,CCK-8增殖实验发现实验组中TSCCA细胞的迁移、侵袭、增殖能力明显增强,而加入了SCH527123抑制剂抑制CXCL2与其受体CXCR2结合后,迁移、侵袭、增殖能力明显降低,提示CXCL2与口腔TME中TSCCA成正相关,其可以在口腔TME中与CXCR2结合并与募集而来的TANs共同促进TSCCA的迁移、增殖、侵袭。证明实验组中CXCL2对肿瘤细胞迁移、侵袭、增殖起着至关重要的作用。尚琨[15]在研究CXCL2与其结肠癌关系时发现,炎症因子的表达增加,可能通过激活NF-κB信号通路,引起趋化因子CXCL2的表达增多,使趋化表达CXCR2的中性粒细胞向炎症部位聚集,并且通过其自身合成分泌的MMP-9和中性粒细胞弹性蛋白酶NE,促进肿瘤血管新生和肿瘤细胞增殖,从而导致结肠癌的发生,与本研究符合。
结合本实验:口腔TME在对TANs产生作用的同时,TANs也产生趋化因子CXCL2等物质参与局部TME的重塑[16],如CXC家族等细胞因子都可由TANs分泌进入TME,参与其组成[17],甚至还可通过分泌更多的细胞因子趋化更多的TANs进入口腔TME中形成正反馈,弥补消耗的TANs,以维持P.gingivalis感染的口腔TME中TANs数量相对稳定[18-19]。在口腔TME中高表达的CXCL2促进TSCCA细胞的迁移、侵袭、增殖与其TANs的稳定募集有关,其募集过程促进了CXCL2的表达。并且可以初步推断出,CXCL2与TANs在口腔TME中存在相互促进关系,来调节肿瘤细胞增殖、侵袭、迁移能力。所以,研究CXCL2,TANs及口腔TME三者对TSCCA的作用,对口腔鳞癌的诊断及预后有重要意义。
