肝移植患者术后门静脉血栓发生病因及预后分析
2021-10-19李丽昕李志杰白瑛刘鸿凌李洪苓任敏娟安子瑞刘振文王洪波
李丽昕 李志杰 白瑛 刘鸿凌 李洪苓 任敏娟 安子瑞 刘振文 王洪波
肝移植是治疗终末期肝病的有效手段,门静脉血栓(portal vein thrombosis,PVT)形成是肝移植后并不常见的血管并发症,它有导致肝功能异常甚至移植肝失功风险,增加围手术期患者并发症和病死率[1]。近年来,随着手术技术的成熟,PVT患者术后也可以得到很好的受益,对移植术后长期存活影响较小[2-4]。本研究探讨肝移植后PVT发生的病因。
资料与方法
一、 研究对象
回顾性分析2015年11月至2019年2月解放军总医院第五医学中心401例肝移植患者,术前均签署知情同意,符合伦理学规定,供体均为DCD来源。男性330例,女性71例,年龄为(51.0±0.3)岁,范围为23~70岁。病毒性肝炎肝硬化241例,酒精性肝病70例,自身免疫性肝病37例,其他(药物性肝衰竭,布加综合征,非酒精性脂肪肝,肝豆状核变性,不明原因肝病,胆管癌等)53例。其中合并肝细胞癌186例。
二、 术前门静脉评估
门脉血栓经术前超声、CTA以及术中取栓证实,术前合并PVT患者66例(16.4%)。按Yerdel 血栓分级标准分为4级:Ⅰ级,局限于门静脉的微小或部分血栓,栓塞程度小于管腔内径的50%;Ⅱ级,门静脉管腔栓塞程度超过50%,包括完全栓塞,伴或不伴有肠系膜上静脉轻微栓塞;Ⅲ级,门静脉和近端肠系膜上静脉完全闭塞;Ⅳ级,门静脉和肠系膜上静脉近端、远端同时完全闭塞。患者移植前血栓I级58例,Ⅱ级5例,Ⅲ级3例,Ⅳ级0例,既往有25例脾切除或脾栓塞手术史,5例TIPS手术史。
三、 手术方式
401例患者中,肝肾联合1例,采用经典原位肝移植393例,背驮式8例,术中PVT通过解剖肝门或超声测量门静脉血流来发现或证实。对于术前诊断Ⅰ和Ⅱ级门静脉血栓患者,采取血栓剥离和血栓切除术。术中受体门静脉至少游离至胰腺上缘,用血管阻断钳尽量钳夹血栓根部以下,门静脉壁外翻后行静脉内取栓或血栓切除术,肝素水冲洗,再行门静脉端端吻合。Ⅲ级血栓可使用供者髂静脉或颈静脉血管通过胰腺前胃十二指肠后与远端的肠系膜上静脉架桥吻合,但血管路径较长且易受压,容易再次形成血栓;对于Ⅳ级血栓,既往公认为是肝移植禁忌,但近年来报道供体血管可与受体门静脉系较粗大的分支或曲张静脉行门静脉重建,保证有足够入肝血流,取得了较好效果[5-6]。当供、受体门脉口径差异较大时,则需先将供、受体门脉成型后再行吻合。对于存在门腔分流患者,术中尽可能寻找并结扎,保证门脉血流量,并应用超声监测门静脉血流量。
四、 术后处理
抗排斥方案常规采用他克莫司胶囊、吗替麦考酚酯分散片和甲强龙的基础免疫抑制方案。对于术中取栓患者,若术后无出血迹象,且血小板计数>60×109/L,予拜阿司匹林肠溶片100~300 mg/d,口服,维持1年以上。多普勒超声监测门脉血流,第1周1 d 1次,第2周2 d 1次,1个月后2周1次,3个月后1月1次,1年后3月1次。对于血栓形成高危患者,建议3~6个月复查腹部增强CT。
五、 伦理学审查
本研究方案经由解放军总医院第五医学中心伦理委员会审核批准。(2015150D)
结 果
一、 一般资料
401例患者,术后随访平均时间49个月(23~62个月),发现PVT者15例,发生率3.7%,其中男性9例,女性6例,平均年龄50.8岁(35~63岁)。术前病因:乙肝肝硬化9例、丙肝肝硬化1例、乙丙重叠感染肝硬化1例、自身免疫性肝炎肝硬化2例、肝豆状核变性1例,酒精性肝硬化1例。
二、术后血栓发生的病因分析
15例患者肝移植后血栓发生的中位时间为5个月(3 d~19个月),服用抗排斥药物他克莫司胶囊平均剂量为4.5 mg/d(0~8 mg/d),发现血栓时血小板中位数为75×109/L(17×109~641×109/L),术后超过1个月患者未再监测凝血指标。临床表现主要包括肝功能变化伴或不伴凝血酶原时间延长、胸腹水新发或加重、静脉曲张破裂出血、肠壁水肿,甚至移植物失功。
肝移植前影响因素:术前已存在PVT 12例、有脾切除或脾栓塞手术史4例、自然形成的门腔分流3例;术中影响因素:外科吻合操作技术(供/受体门静脉直径不匹配、预留门静脉较长、旋转、扭曲、血管壁内翻以及吻合口狭窄)、术中门脉取栓操作引起门脉内膜损伤;术后影响因素:术后早期机体处于高凝状态,包括抗凝血酶恢复较慢、血小板高于参考值3例、术后早期全身炎症反应、抗排斥药物不良反应。
三、治疗及预后
发现血栓后依据具体情况及时给予介入治疗(胃冠状静脉栓塞、粗大的门腔分流道栓塞、门脉支架植入)11例、服用拜阿司匹林肠溶片11例、利伐沙班4例抗凝等治疗。其中3例患者经治疗后检查腹部CT仍存在门静脉血栓,部分血流通畅,无明显临床症状,长期服用拜阿司匹林肠溶片(300 mg/d,1年后逐渐减量)治疗;其余12例患者血流完全通畅。目前15例患者随访至今长期存活,与PVT形成相关病死率为0。见表1。
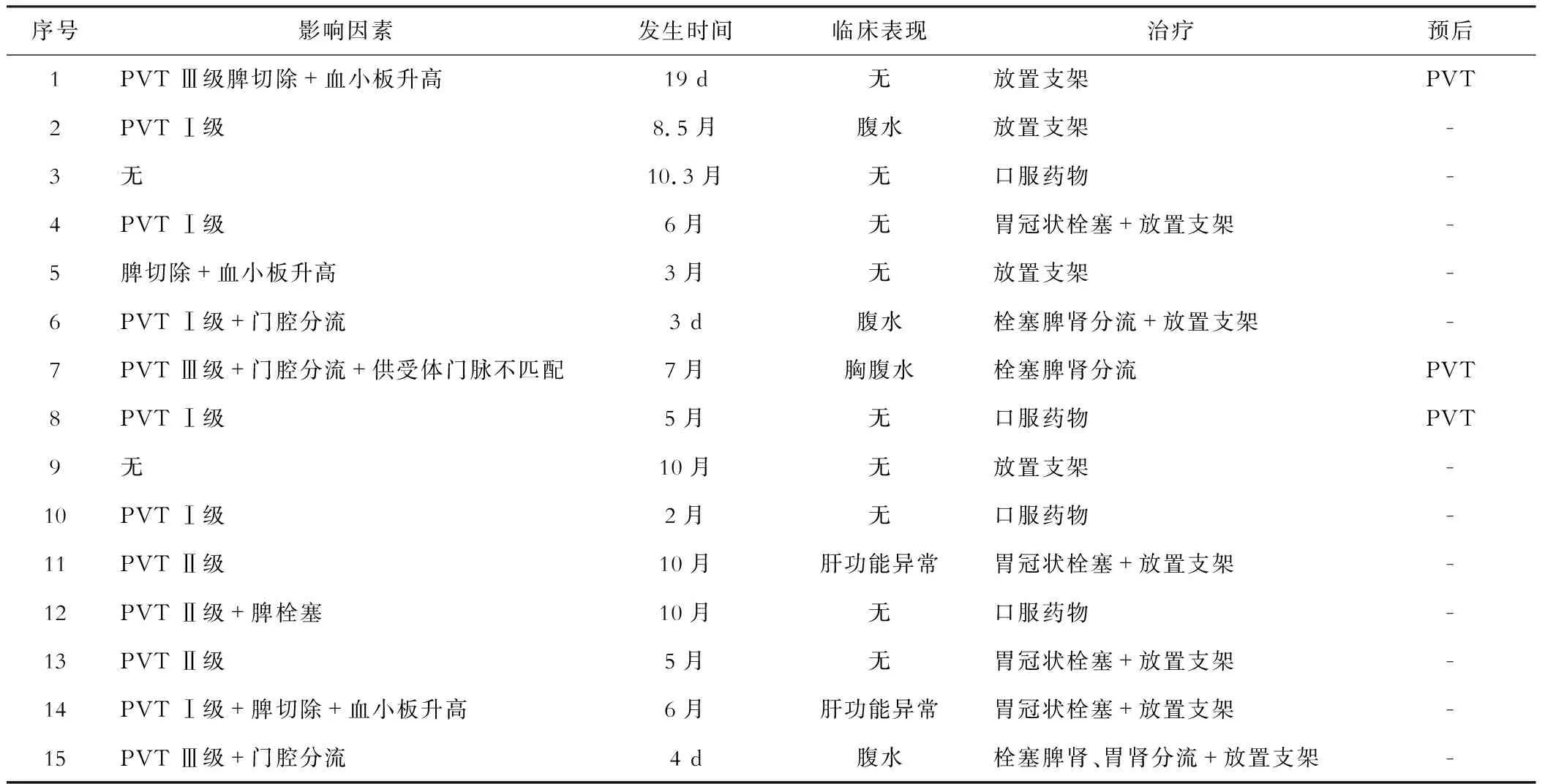
表1 肝移植后15例PVT患者的临床资料
讨 论
文献报道成人肝移植后PVT的发生率为2%~3%,其原因主要与受体术前已存在PVT、脾切除或脾栓塞史、自然形成门腔分流以及术后高凝状态有关,少部分与外科吻合操作技术相关[7-9]。这些因素可单独或合并出现,多因素共同协同作用常见。
本研究发现合并血栓患者术后PVT发生率高达18%,高于既往研究报道[10-11]。由此可见,术前PVT是肝移植后形成PVT主要病因。原因包括:术中取栓造成门脉血管内膜损伤;门静脉行端端吻合,破坏血管内膜连续性;血栓取出不彻底,部分残留等。因此术中需注意取栓动作轻柔,尽量保护内膜,术后尽早给予阿司匹林预防[3,8]。脾切除术也是引起肝移植术后门静脉血栓的因素之一,患者常伴门静脉高压,导致血液动力学改变,造成解剖结构破坏;同时血小板继发升高,沿脾静脉残端生成血栓,逐渐向门静脉延伸,引起PVT。术前存在严重脾肾分流患者,术中未能完全结扎分流管路,术后早期容易形成PVT。因此,术前要对受体门体间分流程度要有准确预判,术中尽量寻找并结扎门腔分流和粗大的侧支循环,确保门静脉血流充足[9,12]。
移植术后肝功能好转,凝血因子以及血小板逐渐恢复,血浆中蛋白C 和抗凝血酶Ⅲ水平恢复相对较慢,导致高凝状态,另外,全身炎症反应、免疫抑制剂使用等都容易形成PVT[3,7]。为预防血栓形成,使体循环血液处于轻度低凝状态,常用药物是前列腺素E、低分子肝素等[8]。手术本身也可引起吻合口狭窄,如门脉吻合口缝线过紧、预留门静脉较长、旋转、扭曲等导致门脉血流呈湍流或返流,容易引起PVT[10,12]。术中需准确评估门脉预留长度,修整时减少对门静脉的钳夹,吻合前门脉断端使用肝素冲洗,吻合时采用血管外翻缝合法,在门脉吻合完成后留宽1 cm处打结,尽量减少相关并发症。肝脏血管超声对于早期发现PVT非常重要,高危风险患者可行CT检查,门静脉造影是诊断血管并发症的金标准,可准确显示狭窄位置、范围和程度等[13]。
PVT临床表现主要取决于栓塞程度与起病急缓程度。临床上可引起门脉高压、胸腹水,移植物衰竭、出血,甚至死亡[5,8,14]。肝移植术后迟发型PVT可导致门静脉高压甚至肝硬化。故移植术后患者需按时随访,定期复查相关检查。
PVT治疗需依据血栓形成时间、栓塞程度、症状以及经验而定。常用方法包括系统抗凝、门脉插管溶栓、支架植入、外科切除血栓、再次肝移植[12-15]。对于术后出现附壁血栓轻微、血流通畅、移植物功能良好、无症状患者,加强抗凝治疗。对于术后早期PVT形成而导致管腔大部分或完全闭塞者,为防止肝功能恶化,建议介入治疗。随着技术发展,经导管血管内介入是治疗移植术后门静脉并发症的一线方法,成功率高达60% ~100%,优势在于减少创伤、降低手术相关并发症、以及避免再次移植[11,15]。本研究中2例患者术后3 d超声检查时发现门静脉血流异常,急诊行经皮经肝门静脉造影,显示门静脉主干闭塞,粗大的
脾肾分流支显影,用弹簧圈栓塞分流道,门脉主干放置支架,再次造影血流通畅,术后予尿激酶经门静脉插管持续泵入治疗1次,后改用阿司匹林口服,至今无并发症发生。
综上所述,肝移植患者发生PVT主要与术前PVT、脾切除或脾栓塞手术史、严重的门腔分流、术后高凝状态以及手术有关[1,4,11]。明确诊断者,可通过系统溶栓、门静脉插管溶栓、支架植入、手术切除血栓等方法,进行处理。伴有症状患者,必须尽早干预,使患者长期获益[10,13]。
