HBV-C基因型复制细胞系的构建与鉴定
2021-10-19李瑞明杨燕曾宪煌孟忠吉
李瑞明 杨燕 曾宪煌 孟忠吉
乙型肝炎病毒(hepatitis B virus, HBV)感染是导致慢性肝炎、肝硬化和肝细胞肝癌的重要原因之一[1-2]。核苷(酸)类似物[nucleos(t)ide analogues, NAs]广泛应用于乙型肝炎的治疗,大多数患者需要长期治疗甚至终身治疗,但是随着治疗时间的延长,产生HBV耐药性突变的风险会随之增加[3-5]。本研究旨在建立HBV临床分离株的体外复制稳定表达系统,研究其特征及其耐药机制,并针对不同患者体外筛选有效的抗HBV药物。
材料与方法
一、 实验材料
乙肝病毒全长基因组PCR扩增产物由本研究所从乙型肝炎患者血清中克隆扩增获得,在之前的文章中已经报道[6],参照Gunther等[7]设计引物及Durantel等[8]的HBV全长PCR参数,扩增出HBV全长基因组DNA。
质粒pcDNA3.0(-)-EGFP-ΔCMV由本研究所构建并保存,通过反向PCR删除了CMV启动子,并在转录终止序列BGH-pA的下游插入完整的绿色荧光蛋白(EGFP)表达框(图1);大肠杆菌DH5a感受态购自北京天根生化科技有限公司。
PCR扩增仪(美国Bio-Rad),酶标仪(德国Eppendorf),定量PCR仪(美国ABI stepone plus),Chamber Slides(美国Thermo Fisher Scientific);限制性内切酶T4 DNA连接酶购自New England Biolabs公司;高保真DNA聚合酶、DIG DNA Labeling and Detection Kit购自罗氏公司;DMEM培养基、脂质体Lipofectamine 2000、胎牛血清、G418(50 mg/mL)购自Invitrogen公司; DNA提取试剂盒、PCR产物纯化试剂盒、定量PCR试剂盒购自北京天根生化科技有限公司;HBsAg和HBeAg EILISA检测试剂盒购自科美公司;HBcAg和HBsAg抗体购自北京中杉金桥生物技术有限公司。
人肝癌细胞系HepG2和HepG2.2.15细胞系均为本室保存。
二、研究方法
(一) 引物设计 使用Vector Nti设计所需要引物,并由擎科生物公司合成。扩增0.2拷贝HBV 引物序列:pcDNA-232-HBV-2795-NotI-U tacggg-ccagatatacgcggccgcggatcctgcgcgggacgt,pcDNA-1255-HBV-169-SacI-D aagccatagagcccaccgagctcagatctcgaa-tagaaggaaaaaagtc。扩增1.0拷贝HBV引物序列:HBV-X15-BamHI-U cgcggatcctgcgcgggacgtcctttgtc-ta,HBV-X15-BamHI-D cgcggatccagttggcagcacaccc-tagcagc。
(二) 0.2拷贝及1.0拷贝HBV基因组的扩增 取2 μg HBV全长基因组PCR产物经SapI 37℃酶切4 h,纯化后取100 ng回收产物T4 DNA连接酶16℃过夜连接得到环状HBV全长基因组。取0.5 μL环状HBV全长基因组(稀释为200 pg/μL)为模板, 引物(10 μmol/L)各1.5 μL,参照Roche高保真试剂盒说明配制反应体系,PCR扩增HBV全长基因组DNA及0.2拷贝基因组,0.8%琼脂糖凝胶电泳检查PCR产物。
(三) HBV复制型质粒p1.2×HBV-EGFP的构建 0.2拷贝HBV基因组PCR产物经纯化后与骨架质粒pcDNA3.0 (-)-EGFP-ΔCMV各2 μg分别用限制性内切酶NotI-HF/SacI-HF 37℃酶切4 h,回收酶切产物及载体,T4 DNA连接酶16℃过夜连接,连接产物转化DH5a感受态细菌,在Amp抗性平板上筛选阳性克隆。挑取阳性克隆行菌落PCR,0.8%琼脂糖凝胶电泳检查PCR产物,选取阳性菌落培养过夜抽提质粒测序。将上述构建的0.2拷贝质粒2 μg用限制性内切酶BamHI 37℃酶切4 h,回收载体,加入小牛肠碱性磷酸酶(CIP) 0.4 μL,37℃反应1 h充分去磷酸化,过柱纯化;同时将1.0拷贝HBV基因组扩增产物2 μg用限制性内切酶BamHI 37℃酶切4 h并过柱纯化;将载体与插入片段用T4 DNA连接酶16℃过夜连接,连接产物转化DH5a感受态细菌,在Amp抗性平板上筛选。挑取阳性克隆做菌落PCR,0.8%琼脂糖凝胶电泳检查PCR产物,选取阳性菌落培养过夜抽提质粒,送上海生工测序。
(四) 细胞培养、质粒转染及G418筛选 HepG2细胞用含10%胎牛血清(FBS)、100 IU/mL青霉素、100 μg/mL链霉素的DMEM培养液,在37℃、5%CO2孵箱中培养。质粒转染参照LipofectamineTM说明书进行。在24孔板中按1.0×105/孔接种HepG2细胞,培养24 h,每孔转入0.5 μg p1.2×HBV-EGFP质粒,继续培养48 h,传代至T25培养瓶加入含700 μg/mL G418筛选培养基继续培养2~3周,挑选阳性克隆,进一步传代培养保种。收集细胞系培养上清和细胞,备检。
(五) HBsAg和HBeAg的酶联免疫吸附(ELISA)检测 培养上清中的HBsAg和HBeAg水平,采用ELISA试剂盒参照说明书进行检测。
(六) HBV DNA的Realtime PCR检测 采用天根DP315病毒基因组提取试剂盒抽提细胞培养上清总DNA,Realtime PCR检测HBV DNA水平,引物序列:PGP_v1 cacctctgcctaatcatctc和BC1_v2 ttatacgggtcaatgtccat,扩增参数:95℃预变性2 min,95℃变性15 s,60℃退火延伸20 s,循环40次。
(七) 核衣壳相关HBV复制中间体的提取和Southern杂交 核衣壳相关HBV复制中间体的提取见参考文献[6]。核衣壳相关HBV复制中间体以1.0%的琼脂糖凝胶分离,然后于转移缓冲液(0.5 mol/L NaOH,1.5 mol/L NaCl)中转印到Gene Screen Plus尼龙膜上,与DIG标记的HBV全长探针杂交,采用成像系统分析杂交信号。
(八) HBsAg和HBcAg的免疫荧光检测 在8孔chamber slide中每孔接种10 000个细胞,37 ℃培养24 h后按标准免疫荧光程序检测HBcAg、HBsAg,共聚焦显微镜采集图像。
结 果
一、成功构建HBV-C基因型临床分离株1.2×HBV复制型质粒p1.2×HBV-EGFP p1.2×HBV-EGFP包含的HBV来源于临床分离株(GeneBank序列号为:KM213037.1)[6]。构建的p1.2×HBV-EGFP质粒经测序验证序列无突变,其中HBV序列(nt1402-nt3215-nt1989)包含C基因启动子和增强子II,可以启动包括pgRNA在内的HBV mRNA转录。另外,该1.2×HBV复制型质粒在HBV表达框下又有EGFP表达框,可以表达EGFP(图1)。
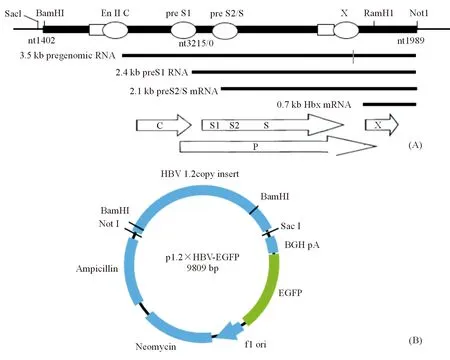
(A)1.2×HBV 基因结构及mRNA示意图;(B)p1.2×HBV-EGFP质粒结构示意图
二、成功建立C基因型临床分离株HBV复制细胞系HepG2X15
G418筛选3周后得到一个稳定表达绿色荧光蛋白的阳性克隆,继续筛选传代至第10代,在荧光显微镜下可以观察到几乎所有的细胞都呈绿色(图2),得到一株HBV-C基因型复制细胞系,命名为HepG2X15细胞系,冻存保种。

图2 HepG2X15细胞的绿色荧光蛋白的表达(40×)
三、HepG2X15细胞表达高水平HBsAg和HBcAg
免疫荧光结果显示,所有EGFP阳性细胞都能检测到高水平HBsAg和HBcAg,而且HBsAg和HBcAg在胞浆和胞核均可见,但是以胞核表达为主(图3)。
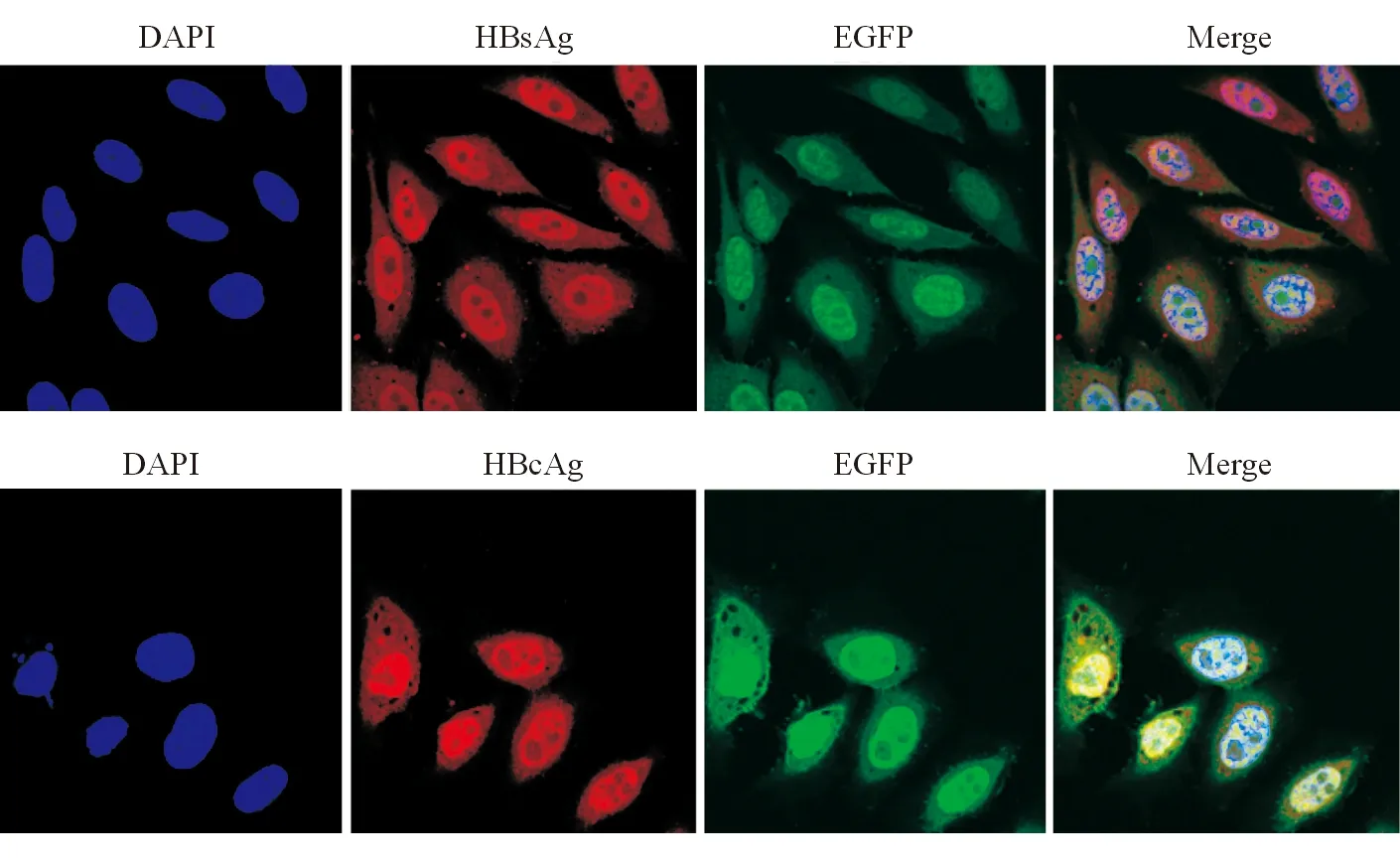
图3 HepG2X15细胞内HBsAg和HBcAg的表达
四、HepG2X15细胞上清中HBsAg和HBeAg的表达
在HepG2X15细胞上清中,ELISA检测到高水平HBsAg和HBeAg,其中HBsAg高于HepG2.2.15细胞上清,HBeAg略低于HepG2.2.15细胞上清(表1)。
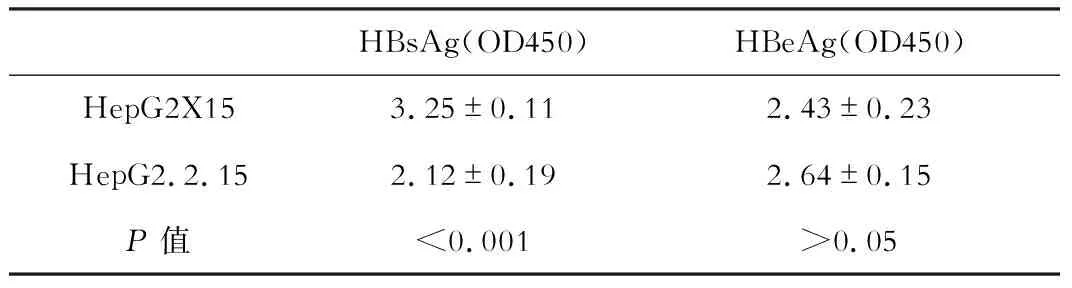
表1 HepG2X15细胞上清中HBsAg和HBeAg的表达
五、HepG2X15细胞产生高水平子代病毒分泌到细胞外
Real-time PCR结果显示,HepG2X15细胞上清HBV DNA达到108拷贝/mL,略高于HepG2.2.15上清中的HBV DNA水平:(8.18±0.21)×108拷贝/mL vs(6.91±0. 71 )×108拷贝/mL,P>0.05。
六、HepG2X15细胞内检测到病毒复制中间体
Southern blot检测核心颗粒相关HBV DNA,结果可见到1~4 kb大小的HBV杂交信号,呈现类似HepG2.2.15细胞核心相关HBVDNA的Southern 杂交信号,即HBV复制中间体,包含松弛环状DNA(RC)、双链线状DNA(DL)和单链DNA(SS)。HepG2X15细胞内HBV复制中间体水平略低于HepG2.2.15(图4)。
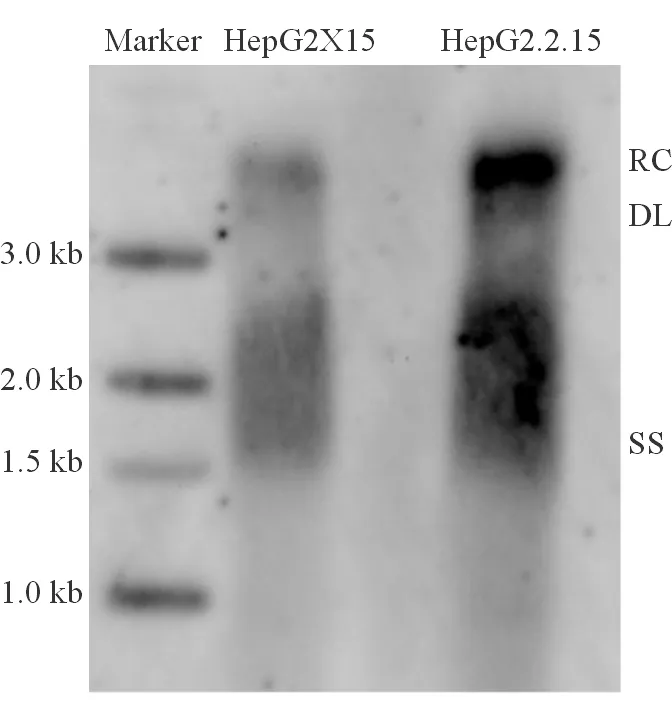
图4 HepG2X15细胞内HBV的复制中间体
讨 论
当前应用最广泛的HBV复制细胞系HepG2.2.15[9]和HepAD38[10]细胞系都是基于血清型ayw, 基因型D(GeneBank序列号 U95551)的病毒株建立的。由于B和C基因型的HBV是中国人群感染的主要基因型,不同亚型的病毒感染预后也有很大不同[10-14],因此有必要建立符合中国人群HBV感染现状的细胞模型。
在前期研究中,笔者从乙型肝炎患者血清中克隆了5株HBV临床分离株,其中基因B型3株,基因C型2株,成功将这些病毒株克隆入pHY106复制型质粒,在转染HepG2及Huh7细胞的上清中检测到HBsAg、HBeAg及HBV DNA,细胞内检测到HBV复制中间体[6]。本研究中笔者从其中一株临床分离株克隆C基因病毒HBV-X15全长基因组为模板,成功构建1.2×HBV复制型质粒p1.2×HBV-EGFP,转染HepG2细胞筛选得到稳定复制HBV的细胞系HepG2X15。HepG2X15细胞内可检测到高水平HBsAg、HBcAg和HBV复制中间体,上清中高水平的HBsAg、HBeAg和子代HBV DNA。与HepG2.2.15细胞系相比,上清中HBsAg和HBV DNA水平更高。而且HepG2X15细胞同时稳定表达EGFP,有利于阳性筛选,并可能用于动物模型体内的示踪显示。
本研究中构建的HepG2X15细胞系可以支持HBV细胞内的生活周期,达到与HepG2.2.15相当水平的HBV复制和抗原表达。使用HBV自身的启动子,更接近体外感染过程后的HBV的自然生命周期,适合用于HBV相关功能基因(组)的研究。C亚型的HBV是中国人群感染的主要基因型之一,这为进一步研究C亚型HBV的结构与功能、基因表达与调控,以及体外筛选抗HBV药物等提供了一个很好的细胞模型。
