超声内镜下内镜黏膜剥离术在乙型肝炎肝硬化患者食管良性肿瘤中的可行性研究
2021-10-19陈衍磊蔡永国
陈衍磊 蔡永国
食管良性肿瘤近年来有发病逐年增加的趋势,发病机制尚不可知,它常表现为吞咽困难、胸骨后疼痛等,因临床表现并无特异性,实践中常易被误诊、漏诊[1-3]。食管良性肿瘤位于黏膜下方,常规胃镜检查难以将它与其他食管病变加以鉴别,超声内镜可清楚显示病灶层次结构,有助于食管良性肿瘤的诊断。超声内镜下内镜黏膜剥离术(ESD)被广泛运用于胃肠道肿瘤的临床治疗中,总体而言ESD操作成功率高,被认可为是治疗胃肠道良性肿瘤的有效手段[4-7]。通过检索现有的文献可知,ESD在治疗食管良性肿瘤的过程中操作较为复杂,有关ESD并发症的报道也不少,包括出血、穿孔及潜在感染等[8-9]。乙肝肝硬化报告发病率持续上升,患者还常存在凝血功能障碍、血小板计数减少或食管静脉曲张。当乙肝肝硬化患者因食管良性肿瘤需行ESD治疗时,操作相关的并发症随之增加[10-12]。基于此,此项研究旨在分析ESD治疗乙肝肝硬化患者食管良性肿瘤的可行性。
资料和方法
一、研究对象
回顾2010年1月至2020年6月病历系统,纳入经ESD治疗的食管良性肿瘤患者174例,男性92例,女性82例,年龄(53.2±10.5)岁;其中伴有乙肝肝硬化患者34例(肝硬化组),不伴有乙肝肝硬化患者140例(非肝硬化组)。排除标准:严重心肺器质性病变,不能耐受超声检查;巨大食管憩室;胸腹主动脉瘤、脑卒中急性期及患有血液系统疾病。研究性质为回顾性的,未有相关纸质知情同意书签署。
二、研究方法
患者空腹口服利多卡因胶浆,ESD操作取左侧卧位。超声内镜设备由Olympus公司(日本)生产。超声内镜(EUS 2000型)进至食管腔确定病灶后,用Hook刀(KD-620LR型)做标记,随后于病灶黏膜周围注入肾上腺素靛胭脂甘油果糖混合液,Hook刀做预切开后用IT刀(KD-610L型)切开、剥离。完整剥离病变后进行病理检查。ESD操作中出现出血予IT刀或止血钳(FD-410LR型)电凝止血,出现止血不彻底情况时予止血夹(HX-610-135型)夹闭止血。详细统计记录患者临床资料。
三、统计学分析
应用SPSS 19.0进行数据分析,计量资料采用t检验或Kruskal-WallisH检验,计数资料采用卡方检验。α=0.05。
结 果
一、两组一般资料比较
两组Child-Pugh评分、PLT及INR等差异具有统计学意义(P<0.05),其他一般资料未发现差异具有统计学意义(P>0.05),见表1。
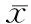
表1 肝硬化组、非肝硬化组一般资料[±s,M(P25,P75),%]比较
二、两组手术资料比较
两组食管良性肿瘤直径、食管平滑肌瘤、肿瘤位置、ESD手术时间及肿瘤完整切除例数等比较差异无统计学意义(P>0.05),而肝硬化组、非肝硬化组ESD术后出血分别为6例(17.6%)、5例(3.6%),比较差异具有统计学意义(P<0.05),见表2。
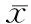
表2 肝硬化组、非肝硬化组手术资料[±s,M(P25,P75),%]比较
讨 论
从临床实践角度来看,伴有肝硬化的患者似乎不太适合接受诸如ESD等侵入性手术。Kato、Kwon及Choi报道称肝硬化患者胃部肿瘤ESD治疗的可行性,称术中出血率为4.3%~16.7%,穿孔率为0~1.5%[13-15]。通过检索文献可知,ESD在肝硬化患者食管良性肿瘤治疗的临床研究证据较少,此次研究旨在探讨该内容。
比较资料后发现,Child-Pugh评分、PLT及INR存在差异。通常对于肝硬化患者,选择侵入性操作的绝对禁忌证仅为PLT低于50×109/L,因而研究对于不处于绝对禁忌证的肝硬化患者正常实施了食管良性肿瘤的ESD术。总体而言,全部患者ESD术均顺利操作,无论良性肿瘤位于食管的上段、中段还是下段。术后病理以食管平滑肌瘤常见,其他食管良性肿瘤类型包括间质瘤、囊肿等。由于食管病变操作范围局限,管壁相对于其他部位胃肠道薄,周边毗邻重要动脉,因此ESD实际操作过程需仔细留心。整体观察发现,术中ESD出血例数并不少见,但经过术中采取相应电凝止血等措施后,并无难以控制的出血或因止血过度引起食管黏膜受损而狭窄甚至穿孔病例的出现。而患者术后迟发性出血比例为11/174(6.3%),同时了解到肝硬化组发生比例显著高于非肝硬化组,不过需要指出的是肝硬化组术后出血病例中有5例患者伴有食管静脉曲张,排除这些病例后并未发现两组的差异性。以上给临床实践带来的意义在于,针对伴有严重肝硬化并发症的患者ESD适用性还需要商榷,但总体而言,ESD对乙肝肝硬化食管良性肿瘤患者的治疗还是安全有效的。穿孔是ESD的另一项严重并发症,但并不常见,在本项研究中也并未发现有穿孔病例发生。
综上,ESD治疗乙肝肝硬化食管良性肿瘤,特别是无严重肝硬化并发症患者是安全有效的。
