中西药肝损伤临床及病理特征分析
2021-10-19何婷婷王丽苹任璐彤崔延飞柏兆方郭玉明宫嫚王睿林
何婷婷 王丽苹 任璐彤 崔延飞 柏兆方 郭玉明 宫嫚 王睿林
由药物和(或)其代谢产物引起的肝损伤即药物性肝损伤(DILI)[1],是世界各国的常见非感染性肝病之一。导致肝损伤的药物可分为化学药物、生物制剂、中草药和保健品。广义的DILI包括所有药物导致的肝损伤,本研究中为狭义的DILI,特指化学药物肝损伤。为了进一步明确DILI与中药肝损伤(HILI)在临床和病理特征方面的差异,现回顾性分析解放军总医院第五医学中心近6年的住院药物性肝损伤患者情况,以期为药物性肝损伤的临床诊治提供帮助。
资料与方法
一、 一般资料
纳入2015年1月至2020年12月解放军总医院第五医学中心符合本研究条件的289例住院患者,其中,DILI患者102例,男27例、女75例,平均年龄(47±13)岁;HILI患者187例,男50例、女137例,平均年龄(49±11)岁。
二、诊断标准
(一)诊断标准 参照《中草药相关肝损伤临床诊疗指南》[2]诊断标准。
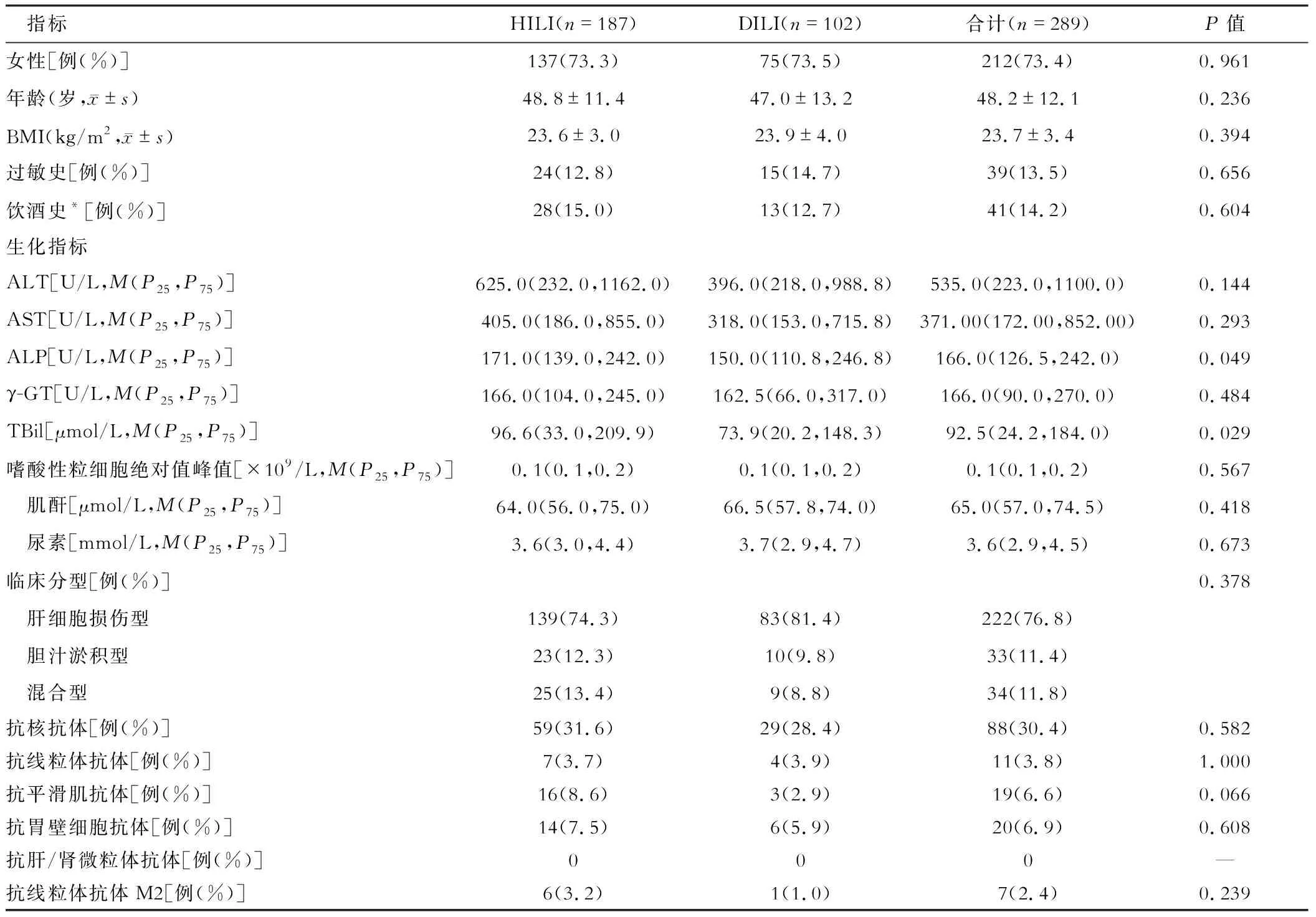
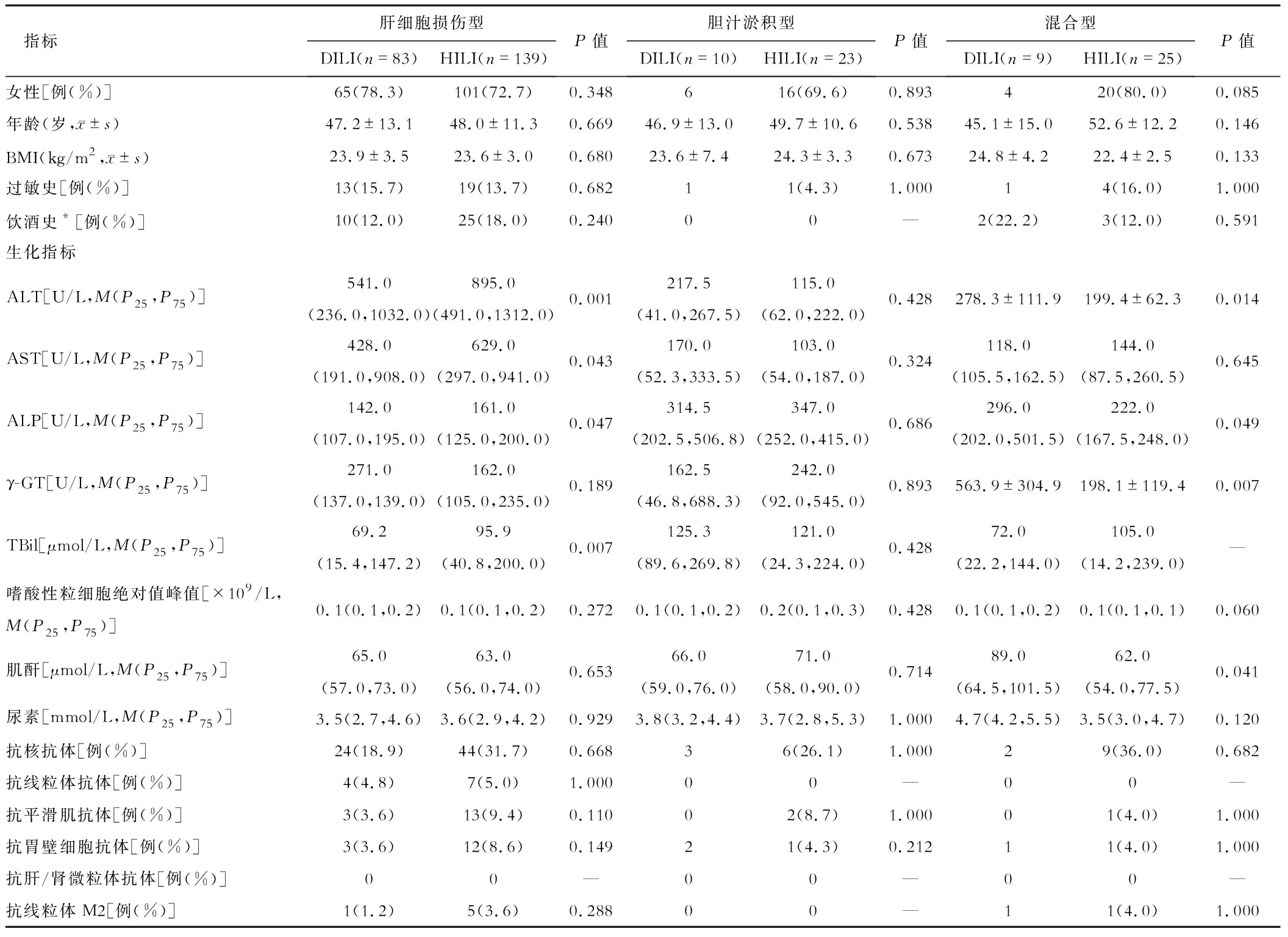
(二)临床分型标准 参照《药物性肝损伤诊治指南》临床分型标准[1],①肝细胞损伤型:丙氨酸氨基转移酶(alanine aminotransferase,ALT)≥3倍正常值上限(upper limit of normal value,ULN),且R≥5;②胆汁淤积型:碱性磷酸酶(ALP)≥2×ULN,且R≤2;③混合型:ALT≥3×ULN,ALP≥2×ULN,且2 (三) Hy’s法则[2]Hy’s法则是指肝细胞损伤出现转氨酶和胆红素升高(ALT>3×ULN同时伴有胆红素>2×ULN),通常提示预后不良,容易进展至急性肝衰竭,病死率约为10%或需要接受肝移植。 ①符合基于整合证据链的DILI和HILI诊断标准,中西药联合用药情况不属于本研究范畴;②年龄18~75岁,性别不限;③行肝脏穿刺肝组织病理活检;④实验室检查资料齐全。 ①合并自身免疫性肝病、病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病、原发性肝癌患者;②合并遗传、代谢及严重的免疫缺陷性疾病患者;③妊娠或哺乳期妇女;④合并严重精神疾病、消化道溃疡及吸毒患者;⑤合并无法控制的糖尿病、高血压等疾病患者。 (一)一般资料 收集各组患者性别、年龄、BMI、过敏史、饮酒史、潜伏期、临床分型、药物使用情况、肝穿刺活检病理信息。 (二)生化、免疫学指标 所有患者入院后次日早晨抽取空腹外周肘静脉血。使用日本Olympus AU5400全自动生物化学分析检测血清ALT、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、γ-谷氨酰转肽酶(glutamyl transferase,γ-GT)、总胆红素(total bilirubin,TBil)、肌酐、尿素水平;采用迈瑞BC-5000全自动血常规分析仪方法检测嗜酸性粒细胞峰值(eosnophils,EOS)。采用ELISA法检测自身抗体谱五项(试剂盒购自德国欧蒙医学实验诊断有限公司)。 (三)肝活组织检查 超声引导下肝穿刺术获取肝组织病理标本,进行病理学检测。病理表现包括:肝细胞变性(水样变性、气球样变性、脂肪样变性、玫瑰花结)、肝细胞坏死(点灶状坏死、融合灶状坏死、桥接坏死、肝细胞大片坏死、凋亡小体)、汇管区浆细胞浸润、汇管区嗜酸性粒细胞浸润、吞噬色素颗粒的库普弗细胞、界面炎、肝细胞和(或)胆管内胆汁淤积[3]。 HILI组患者ALP、TBil高于DILI组(P<0.05),差异有统计学意义。其余各指标比较,差异无统计学意义(P>0.05)。见表1。 表1 DILI、HILI组患者一般资料、临床分型、生化、免疫学指标比较 在临床分型方面,DILI和HILI均以肝细胞损伤型最多见,分别为83例(81.4%)和139例(74.3%)。肝细胞损伤型中HILI组ALT、ALP高于DILI组,差异均有统计学意义(均P<0.05);混合型中DILI组ALT、ALP、γ-GT、肌酐高于HILI组,差异均有统计学意义(均P<0.05)。其余各指标比较,差异均无统计学意义(均P>0.05)。见表2。 表2 DILI、HILI组间患者不同临床分型一般资料、生化、免疫学指标比较 DILI组、HILI组符合Hy’s法则的病例进行比较,临床指标差异无统计学意义(P>0.05)。见表3。 表3 HILI与DILI符合Hy’s法则患者临床特征比较 与HILI组比较,肝细胞损伤型的DILI在病理上更易出现肝细胞大片坏死、吞噬色素颗粒的库普弗细胞、肝细胞和(或)胆管内胆汁淤积,差异均有统计学意义(均P<0.05)。其余各指标比较,差异均无统计学意义(均P>0.05)。见表4。 表4 DILI、HILI组间患者肝穿刺活检及病理特征比较(例) DILI组中可疑损肝药物以解热镇痛药12例(11.8%)占据第1位,其次为治疗甲状腺疾病药物7例(6.9%),激素6例(5.9%),降压药6例(5.9%)等。导致HILI中药主要应用于保健37例(19.8%)、皮肤疾病29例(15.5%)、消化系统疾病23例(12.3%)、骨关节疾病22例(11.8%)等。 由于缺少特异性诊断标志物,药物性肝损伤仍为排他性诊断。目前国内外常用于药物性肝损伤诊断的三种方法为:RUCAM量表因果关系评估法、结构化专家意见SEOP法和整合证据链法iEC。与前两种方法相比,iEC是在RUCAM基础上,通过多方面构建证据链,提高药物性肝损伤诊断和因果关系评价的可信度。该方法也是中华中医药学会发布的《中草药相关肝损伤临床诊疗指南》推荐的因果关系评价法。本研究所有入组病例全部经iEC诊断,DILI和HILI两组在性别、BMI、过敏史、饮酒史等方面差异无统计学意义[4],这与罗琼等[5]研究结果一致。 既往文献报道,无论是中药还是西药导致的DILI均以肝细胞型最多见[6-7]。本研究结果显示DILI组、HILI组均以肝细胞型多见,DILI组肝细胞型高于HILI组,但两组临床分型比较差异无统计学意义。多数患者无明显症状,部分患者可有乏力、食欲缺乏、恶心、呕吐、黄疸、腹胀等症状[8],少数患者可能会出现过敏表现,肝外器管损伤的表现; 血生化指标改变以转氨酶及胆红素升高为主。本研究发现,HILI组患者ALP、TBil高于DILI组,差异有统计学意义。目前,DILI的发生机制是多种因素相互作用的结果,郭荣荣[9]曾对DILI的直接肝损伤机制、特异质性肝损伤机制、线粒体功能损伤、遗传等方面进行综述。HILI的机制与脂质过氧化损伤、CYP450酶系代谢异常、线粒体功能失调、钙离子浓度平衡失调、肝循环障碍、胆汁淤积有关[10]。本研究临床分型肝细胞损伤型中HILI组ALT、ALP高于DILI组,差异有统计学意义;混合型中DILI组ALT、ALP、GGT、肌酐高于HILI组,差异有统计学意义,可能与中药所致肝损伤造成循环障碍、胆汁淤积有关。 已知全球有1 100多种上市药物具有潜在肝毒性,常见的包括非甾体类消炎药、抗感染药物(含抗结核药物)、抗肿瘤药物、中枢神经系统用药、心血管系统用药、代谢性疾病用药、激素类药物、某些生物制剂和TCM-NM-HP-DS等[1]。本研究DILI组中可疑损肝药物以解热镇痛药占据第1位,其次为治疗甲状腺疾病药物。由于人口学、用药种类及诊断标准等不同,所报道的导致DILI的可疑损肝药物也有较大差异。本研究发现,导致HILI的中药主要应用于保健、皮肤疾病、消化系统疾病、骨关节疾病等,与朱云等[11]回顾性分析2009年1月至2014年1月解放军第302医院595例中药导致肝损伤的用药特点相符。皮肤病、消化系统疾病、骨关节病等慢性病及疑难病无特效西药导致患者往往求助于中医治疗,同时部分患者对中药存在认知误区,长期乱用、误用所谓的民间偏方、祖传秘方等。本研究中因保健为目的所致HILI占首位,警示临床应避免中药滥用,同时在应用过程中需要密切监测,做到早发现、早停药、早治疗。 DILI主要病理学特征为肝细胞坏死,偶见融合坏死灶、桥接坏死或多小叶坏死形成,汇管区炎细胞浸润,界面炎,肝细胞胆色素沉积,小胆管毛细胆栓形成[12]。HILI肝组织病理学表现包括肝细胞损伤、炎性细胞浸润、纤维组织增生、胆管损伤和血管病变等非特异性病理改变。与化学药导致的肝损伤相比,HILI更易出现融合性坏死、纤维间隔形成和汇管区淋巴细胞-浆细胞浸润[1,13]。本研究发现肝细胞损伤型的DILI在病理上更易出现肝细胞大片坏死、吞噬色素颗粒的库普弗细胞、肝细胞和(或)胆管内胆汁淤积。郭立杰等[14]报道的药物性肝损伤不同时间临床分型与病理损伤分型关联性分析中提出DILI的R值临床分型与病理损伤分型一致性较差,由此可见DILI损伤模式复杂。本研究结果与指南有差异,可能与本研究所收集的病例均是在疾病恢复期,符合肝穿刺活检适应证后获得的肝组织标本有关,尚不能完全反映真实的肝损伤情况。 综上所述,iEC法不仅适用于HILI,也同样适用于DILI。但仍需开展前瞻性研究进一步验证iEC对中西药联合用药导致肝损伤的适用性和优势,为DILI的预警、诊断、治疗和防控打下坚实的基础。三、纳入标准
四、排除标准
五、观察指标
六、统计学方法
结 果
一、各组间患者一般资料、临床分型、生化指标、免疫学指标比较
二、不同临床分型患者的各项指标比较
三、符合Hy’s法则的两组患者临床特征比较

四、两组间患者不同临床分型中其肝穿刺组织病理比较

五、两组患者使用可疑损肝药物情况比较
讨 论
