基于高效回收废旧锂离子电池正极材料的低共熔溶剂的筛选
2021-10-15巩珊珊王官格苏岳锋
巩珊珊,吴 彤,王官格,黄 擎,苏岳锋,吴 锋
(1.北京理工大学材料学院,北京100081;2.北京理工大学重庆创新中心,重庆401120)
锂离子电池(LIBs)凭借其优异的电化学性能(如高能量密度、长循环寿命和宽工作温度)已被广泛应用于电动汽车和便携式电子储能设备中[1,2].据统计,到2025年,全球LIBs市场将达到999.8亿美元,到2030年,全球LIBs回收市场预计达到237.2亿美元,如何合理处置废旧LIBs已成为全球关注的热点[3].一方面,废旧LIBs含有大量潜在危险的重金属和有毒易燃的电解质,会对环境和人类健康构成严重威胁[4,5];另一方面,废旧LIBs中的几种原材料(如Co,Li,Ni和Mn)是具有高价值的资源,而这些矿产资源近年来呈现供应短缺的趋势,因此,这些有价金属的提取和回收具有重要意义[6~8].从环境污染防治和资源短缺的角度出发,迫切需要有效地回收和再利用废旧LIBs.
目前,废旧LIBs的研究主要集中在正极材料中有价金属的回收,其中湿法冶金工艺被广泛应用于实验室研究和工业化生产中[9~12].在金属浸出过程中常需要使用无机酸(如HCl,HNO3,H2SO4和H3PO4等)或有机酸(如草酸、柠檬酸、DL-马来酸、抗坏血酸等)作为浸出剂[12~15],无机酸对设备要求高,浸出过程会产生一些有害气体(如Cl2,SO3及NOx等),需要气体收集及净化装置,增加生产成本[16],而有机酸价格昂贵,不适合大规模的工业应用[15].为了高效回收废旧LIBs正极材料中的有价金属,同时降低生产成本和减少二次污染,近年来,一种新型“绿色溶剂”——低共熔溶剂(DES)被广泛应用于LIBs回收领域.DES最早由Abbott等[17]于2003年提出,其主要是由氢键受体(HBA)与2个或多个氢键供体(HBD)通过分子间氢键结合组成的二元或三元共晶混合物体系[18~20].DES具有原材料成本低、制备简单、相对无毒且可生物降解等优点,可以作为传统有机溶剂的替代品[21,22].Tran等[23]采用氯化胆碱/乙二醇DES在220℃下溶解LiCoO2正极材料24 h,发现Co的浸出效率高达94.1%;Roldan-Ruiz等[24]发现由对甲苯磺酸/氯化胆碱/水制备的DES可回收废旧LiCoO2中94%的Co;Wang等[25]发现氯化胆碱/尿素DES具有很强的还原性,废旧LiCoO2中Li和Co的浸出效率都高达95%.然而这些DES浸出工艺条件需要严格控制,如反应温度高达220℃,反应时间需要24 h或者更久,这将限制DES在LIBs回收领域的广阔应用.因此,本文提出了一种绿色高效回收废旧LiCoO2的新方法,合成了一系列氯化胆碱/酸类DES,采用红外光谱和核磁共振波谱等方法探究了DES的合成过程,同时考察了DES对废旧LiCoO2正极材料浸出的影响,筛选出最佳浸出剂,以期实现废旧LIBs在低温、短时间内的高效回收,扩大DES在LIBs回收领域的应用前景.
1 实验部分
1.1 试剂与仪器
废旧LiCoO2电池购于深圳市绍能电子科技有限公司;氯化胆碱(ChCl)、草酸(Oxa)、丙二酸(Mal)、戊二酸(Glu)、苯磺酸(Ben)和无水乙醇(Ethanol)均为分析纯,购于上海麦克林生化科技有限公司.
HH-1型数显电子恒温水浴锅(常州国华电器有限公司);IKA RW 20D S025数显型电动悬臂式搅拌器(苏州赛恩斯仪器有限公司);SX3-4-13A型马弗炉(天津中环实验电炉有限公司);FTS-135型傅里叶变换红外光谱仪(FTIR,美国梅特勒-托利多国际贸易有限公司);Avance NEO 400 M核磁共振波谱仪(NMR,德国Bruker公司);Avio 500型电感耦合等离子体发射光谱仪(ICP-OES,美国PerkinElmer公司).
1.2 氯化胆碱/酸类DES的制备
按照表1所示DES中不同组分的质量比,分别准确称取一定质量的试剂加入50 mL圆底烧瓶中,在50℃水浴锅中加热搅拌30 min,直至形成均一透明的液体.反应完毕,将其于60℃下真空干燥10 h,然后缓慢冷却至室温,即可制得氯化胆碱/酸类DES.
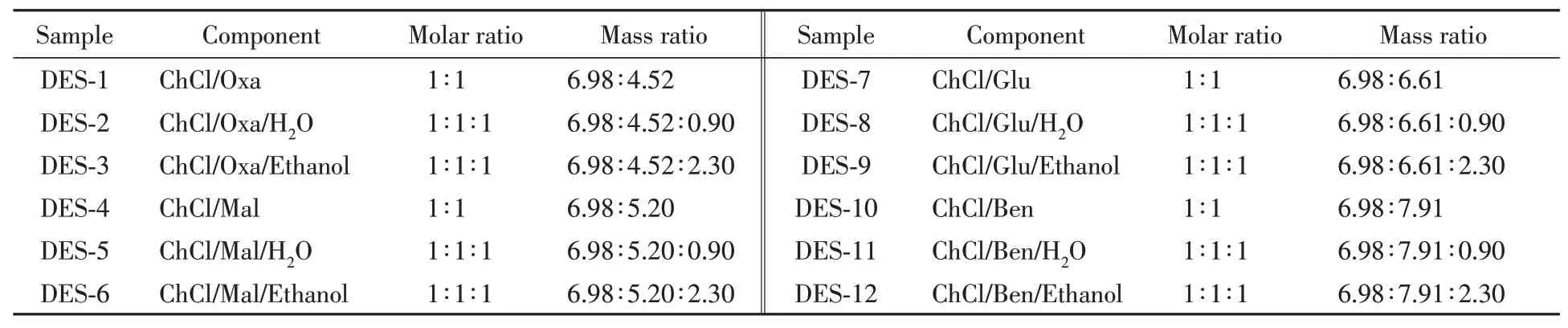
Table 1 Summary of the components for the preparation of DES
1.3 废旧LiCoO2正极材料的预处理
将废旧LiCoO2电池在0.8 mol/L NaCl溶液中自放电24 h,随后在80℃下烘干15 h,冷却至常温,然后手动拆解放电后的废旧LiCoO2电池,分离正极、负极与隔膜,铝箔表面附着的黑色涂层为LiCoO2正极材料,将其切割成1 cm×1 cm的碎片.破碎的正极材料与10%(质量分数)NaOH溶液反应5 h,待铝箔完全溶解后,抽滤干燥,即可获得LiCoO2正极材料粉末.最后将干燥的粉末在650°C马弗炉中煅烧4 h(升温速率5℃/min)以除去炭黑和黏结剂.用5 mL HNO3/HCl/HF/HCIO4(体积比2∶1∶1∶1)消解试剂完全溶解0.2 g LiCoO2正极材料粉末,采用ICP-OES分析其实际的金属含量.结果表明,正极活性材料中Li含量为6.72%(质量分数),Co含量为58.61%(质量分数),Al含量为0.59%(质量分数),Cu含量为0.04%(质量分数).
1.4 DES浸出废旧LiCoO2正极材料
将0.2 g废旧LiCoO2正极材料粉末和10 mL氯化胆碱/酸类DES加入到反应器中,于90°C下水浴中加热搅拌1 h.待反应结束后,用2%(体积分数)的硝酸稀释,采用ICP-OES确定浸出液中Li和Co的浓度.
氯化胆碱/酸DES回收废旧LiCoO2的流程图(以DES-12为例)如图1所示.
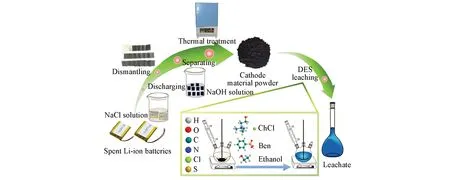
Fig.1 Flowsheet of the recovery process of cathode from the spent LIBs
1.5 分析与表征
废旧LiCoO2正极材料的浸出效率(ηi,%)计算公式如下:

式中:c(img/L)为浸出液中金属离子的浓度;V(L)为浸出液的体积;mi为正极活性材料中(Li或Co)的原始质量.
2 结果与讨论
2.1 氯化胆碱/酸类DES的表征
制备12种DES后,为了探究混合物内部氢键形成的影响作用,首先对DES-1,DES-4,DES-7和DES-10二元DES进行了FTIR及1H NMR表征,分别如图2和图3所示,详细数据列于表2.
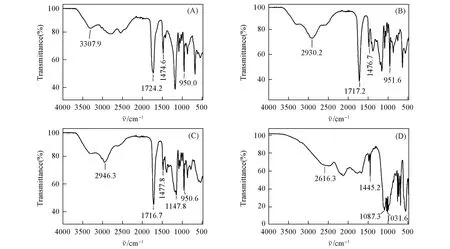
Fig.2 FTIR spectra of DES⁃1(A),DES⁃4(B),DES⁃7(C)and DES⁃10(D)
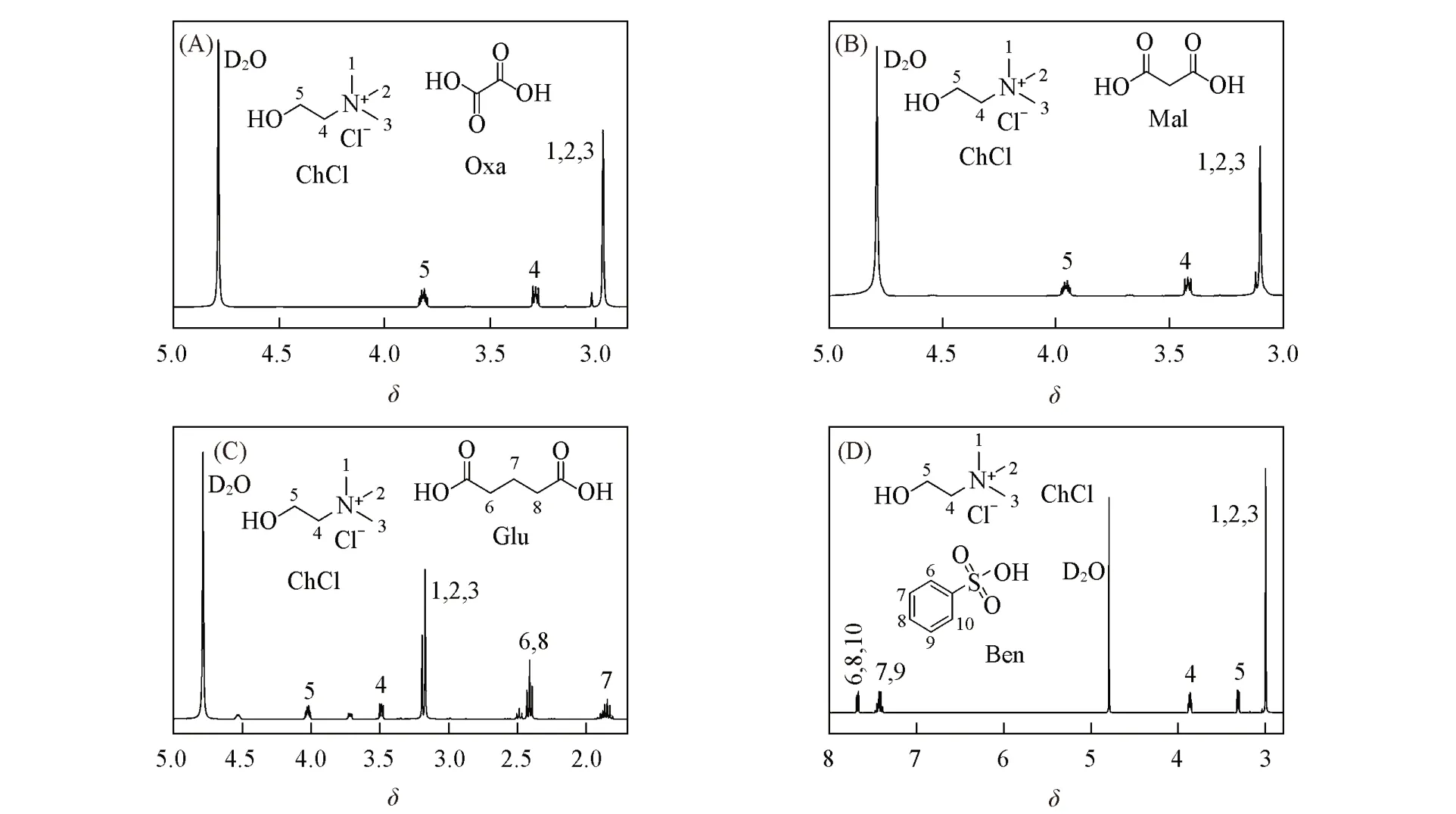
Fig.3 1H NMR spectra of DES⁃1(A),DES⁃4(B),DES⁃7(C)and DES⁃10(D)
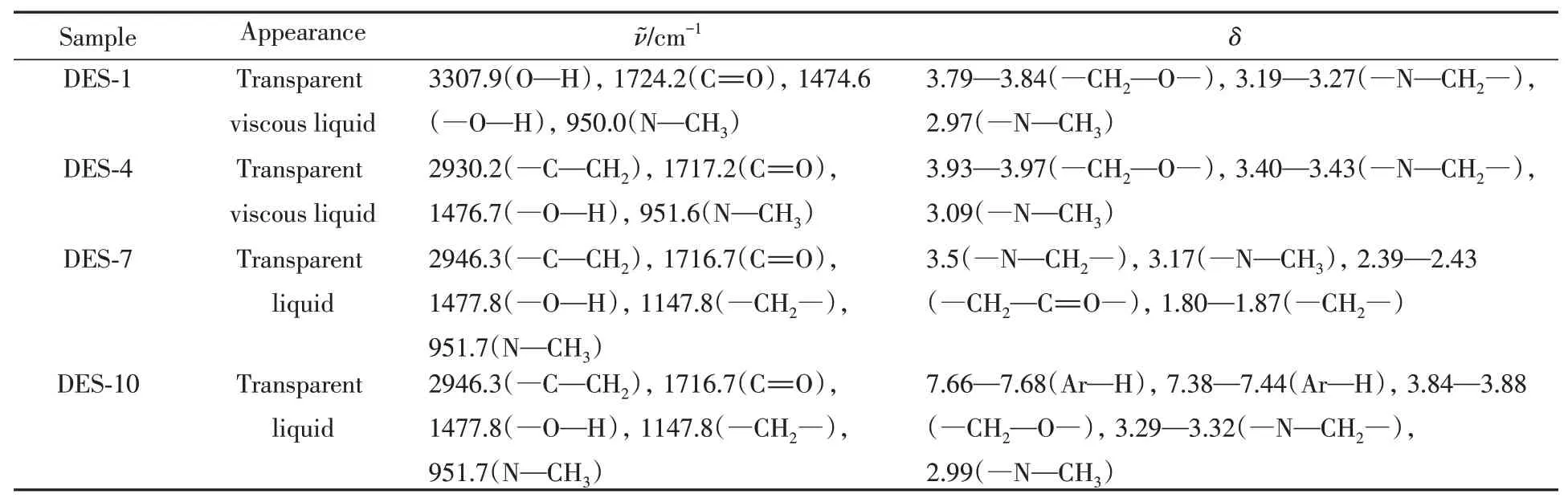
Table 2 Comparison of FTIR and1H NMR data of DES-1,DES-4,DES-7 and DES-10
从图2(A)可见,形成DES-1后,羟基的伸缩振动吸收峰位于3307.9 cm-1处,与文献[26]中草酸的羟基吸收峰3087 cm-1相比,发生了蓝移,表明草酸自身的氢键作用被削弱,DES的氢键作用弱于草酸纯组分的.羧基中—OH氢原子与氯化胆碱中氯原子形成的氢键作用会间接影响C=O的键力常数,形成DES后,C=O的伸缩振动吸收峰增大到1724.2 cm-1处,说明C=O的键力常数增大,进一步证实了DES的氢键作用弱于纯组分自身的.由图2(B)~(D)可见,DES-4,DES-7和DES-10的FTIR谱图的变化与DES-1类似,羟基吸收峰均发生蓝移,酸自身的氢键作用被削弱,DES间的氢键作用弱于酸纯物质的氢键作用.但在DES-10中蓝移程度最小,说明形成的DES削弱苯磺酸自身氢键作用的能力最弱.对比图3中DES和各组分的1H NMR谱图可见,形成DES后,纯组分氯化胆碱和酸自身的氢键作用被削弱,质子周围电子云密度增大,化学位移向高场方向移动.
在加入水或乙醇组分后,三元DES的黏度降低,Hammond等[27]证实大多数DES保留其典型的氢键网络结构直到水的含量约为42%(质量分数),因此,按摩尔比1∶1加入水或乙醇后可确保混合物具有DES的性质.以DES-12为例对其结构进行分析与表征.
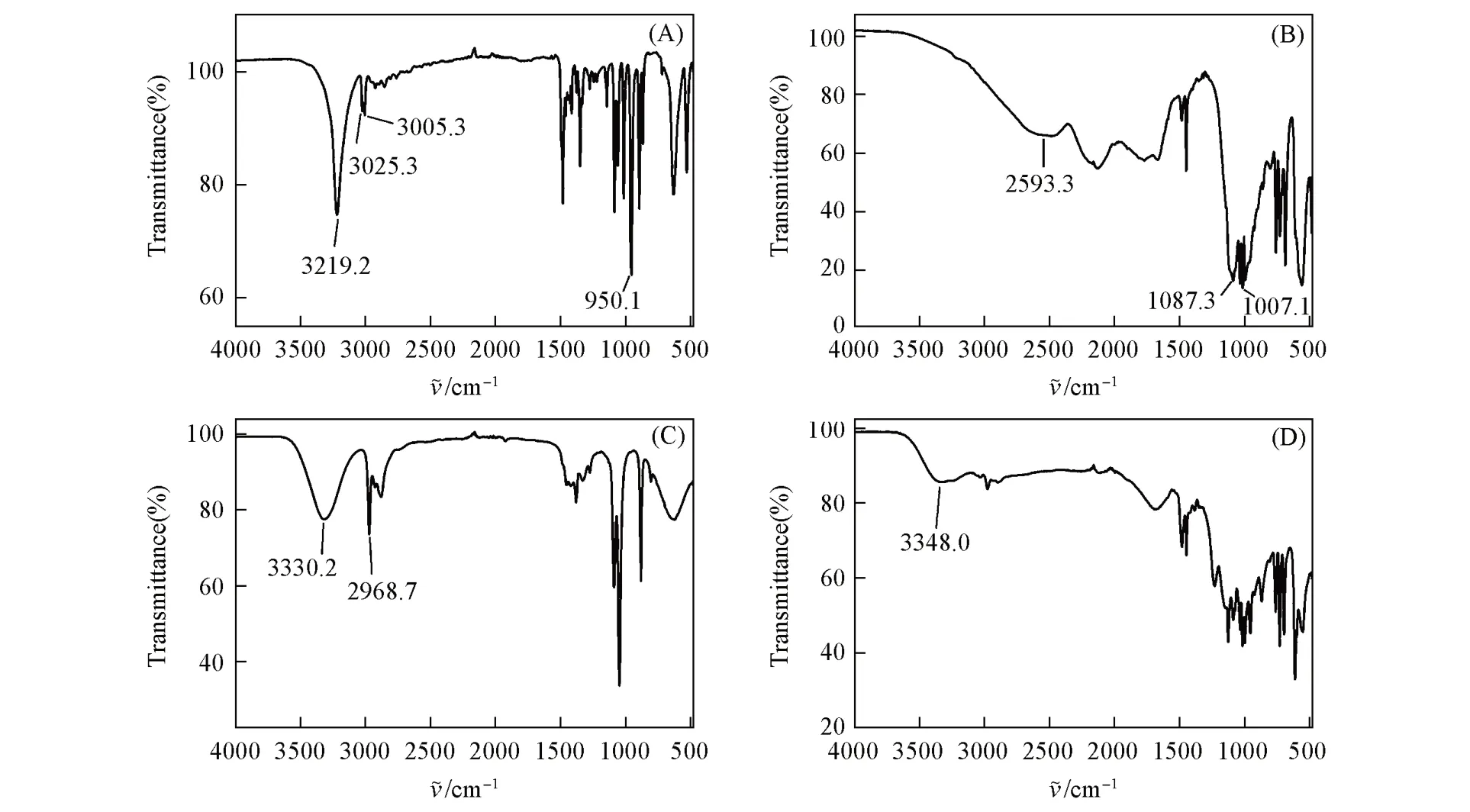
Fig.4 FTIR spectra of ChCl(A),Ben(B),ethanol(C)and DES⁃12(D)
图4 为DES-12及其组分的FTIR谱图,3219.2和3005.3 cm-1处的吸收峰归属于氯化胆碱中—OH和—C—CH2的伸缩振动,N—CH3的伸缩振动和弯曲振动吸收峰位于3025.3和950.1 cm-1处[28].苯磺酸的谱带在2593.3 cm-1处显著变宽,可能是因为—SO3和H3O+离子之间的强氢键作用,芳香族—SO3的反对称和对称的伸缩振动吸收峰位于1087.3和1007.1 cm-1处[29].乙醇中3330.2 cm-1处的强吸收峰归属于—OH的伸缩振动,—CH2的伸缩振动吸收峰位于2968.7 cm-1处.由图4可见,在合成DES-12后,—OH基团的吸收峰发生一定程度的蓝移,且强度减弱,峰形变宽,由3219.2和3330.2 cm-1蓝移到3348.0 cm-1,这可能是氯化胆碱中的吸电子阴离子Cl-与氯化胆碱、苯磺酸、乙醇中的—OH基团发生氢键作用,进而实现电子离域,—OH吸收峰减弱,形成O—H…O和O—H…Cl-等类型的氢键.
对比氯化胆碱、苯磺酸、乙醇的标准谱图和DES-12的1H NMR谱图(图5)可见,合成DES后的氢谱化学位移发生了较大变化.原料氯化胆碱中—N—(CH3)3上H的特征峰由δ3.30向低频移动到δ2.52,靠近羟基的—CH2—上的H由δ3.97移动到δ3.37,苯磺酸中磺酸基的邻对位上的H由δ7.89移动到δ7.25,乙醇中的—CH2—上的H由δ3.59移动到δ3.07,—CH3上的H由δ1.18移动到δ0.60.原料间的氢键作用使DES各组分质子周围的电子云密度增大,化学位移向高场移动.从FTIR谱图和1H NMR谱图表征可以判断原料化合物之间主要靠氢键作用结合,Scheme 1给出了DES-12分子间氢键的形成过程.
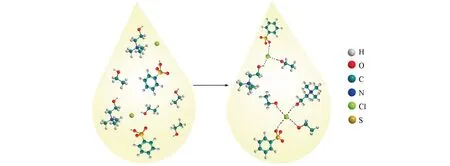
Scheme 1 Hydrogen bonding relationship between DES⁃12 molecules
此外,对比DES-10和DES-12的FTIR谱图[图2(D)和图4(D)]可见,DES-10和DES-12的羟基吸收峰分别位于2616.3和3348.0 cm-1处,与苯磺酸中的羟基吸收峰(2593.3 cm-1)相比,均发生了蓝移,且DES-12的蓝移波数较大,表明无水乙醇的加入在一定程度上削弱了苯磺酸自身的氢键作用.由DES-10和DES-12的1H NMR谱图[图3(D)和图5]也可见,形成DES后,氯化胆碱和苯磺酸中氢原子的化学位移均向低频移动,且DES-12中化学位移减小的程度更大,说明等摩尔量加入无水乙醇后,DES中的氢键作用削弱了各组分自身的氢键作用,导致DES各组分质子的电子云密度增大,化学位移向高场移动,与FTIR谱图结果一致.
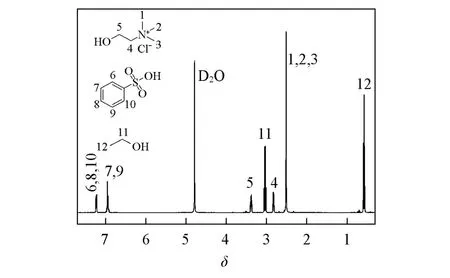
Fig.5 1H NMR spectrum of DES⁃12
2.2 氯化胆碱/酸类DES浸出废旧LiCoO2正极材料
DES的结构对溶解浸出废旧LiCoO2正极材料有重要影响,为了探究不同烷基链长的羧酸对浸出过程的影响,制备了由草酸、丙二酸和戊二酸分别与季铵盐氯化胆碱合成的DES.图6给出了废旧LiCoO2正极材料与不同DES在90°C下反应1 h后溶液中金属Li和Co的浸出效率.由图6可知,废旧LiCoO2正极材料中的Li和Co的浸出效率分别为54.5%和37.1%(DES-1),65.4%和29.9%(DES-4)以及7.2%和8.8%(DES-7).结果表明,由戊二酸和氯化胆碱合成的DES浸出能力远低于其它DES,这可能是由于其烷基链长较长(C5),而其它酸烷基链长较短(C2和C3),影响了与氯化胆碱分子互相接触形成氢键,溶解度较低.Florindo等[30]发现氯化胆碱中部分质子会和羧酸碳之间存在相互作用,从而形成酯,其中胆碱阳离子与戊二酸间形成酯的倾向较大.Delgado-Mellado等[31]证明草酸和丙二酸在合成DES的过程中均可发生脱羧反应,从而形成甲酸和乙酸,释放出CO2,固体中分子间相互作用被破坏以形成液相.但即使一小部分一元羧酸的存在,也可能会大大改变DES的理化特性.因此,基于以上理论和实验结果,3种DES对废旧LiCoO2正极材料的溶解浸出能力大小顺序为DES-1>DES-4>DES-7.
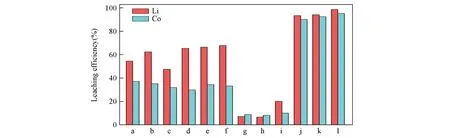
Fig.6 Leaching efficiency of spent LiCoO2 cathode materials in different DESs
据文献[32]报道,HBD酸的强度(即释放质子的趋势)是DES形成过程中的另一个关键因素.由于实验所用酸的强度顺序为草酸(pKa=1.27)>丙二酸(pKa1=2.82)>戊二酸(pKa=3.77)>苯磺酸(pKa=4.19),Peeters等[33]指出尽管草酸和丙二酸具有很强的酸性,但它们的共轭碱会与钴(Ⅱ)形成溶解性差的盐,使浸出效率变得很低.由图6还可见,DES-12在90℃下反应1 h可以浸出93.4%的Li和90.1%的Co,其浸出效率远远高于其它3种DES,但并不能得出HBD酸的酸性越高,锂钴氧化物溶解度越高的结论.相比之下,已有文献[29]指出,除HBD酸的类型和酸度外,HBD与HBA的摩尔比对金属氧化物的溶解度有更大的影响,这对以后的研究有重要的指导意义.
由于制备的二元DES黏度较大,流动性低,会影响其与废旧LiCoO2正极粉末的有效接触,且2.1节已经指出,水含量低于42%不会影响DES内部的氢键结构.因此等摩尔比加入去离子水后,有效改善了DES黏度较大的问题.由图6可知,加入去离子水后,三元DES对Li和Co的浸出效率并没有发生很大改变.这是由于在水合作用时,DES会受到轻微破坏,DES分子间配位数降低到纯DES的90%,水在DES中有效地充当了二级HBD分子,对浸出过程没有明显的促进作用[27].
除此之外,由于乙醇作为一种良好的有机溶剂,具有一定的还原性,将去离子水创新性地替换为无水乙醇,按照相同的摩尔比制备氯化胆碱/酸/乙醇三元DES.结果发现,加入乙醇组分的三元DES不仅流动性较高,且对废旧LiCoO2正极材料的浸出效率有很大的影响.其中Li和Co的浸出效率由DES-2中的62.4%和35.2%分别下降至47.5%和31.9%,在DES-6中的浸出效率提升很小,在DES-9中Li和Co的浸出效率由最初的7.2%和8.8%分别升高至20.2%和10.1%,在DES-12中Li和Co的浸出效率分别高达98.6%和95.2%.这是因为加入乙醇后,乙醇会与草酸发生副反应生成酯,使DES-3中Li和Co的浸出效率降低[34].在DES-6和DES-9中,随着两个羧基之间碳原子数的增多,氯化胆碱和二元羧酸之间的氢键作用减弱,乙醇加入后,Li和Co的浸出效率提升不显著.而在DES-12中,苯磺酸分子中两个S=O的吸电子能力很强,其—OH中的氢原子与氯化胆碱中的氯原子之间形成的氢键作用较强,加入具有还原性的乙醇后,LiCoO2中的Co3+被还原为Co2+,乙醇被氧化为乙酸,能够高效地从废旧LiCoO2正极材料中浸出有价金属,从而实现回收再利用的绿色循环目标.
浸出后的Li+和Co2+会与失去质子的有机酸分子发生络合反应,以有机金属络合物形式存在于滤液中[35].另外,大部分Co2+会与溶液中电负性强的Cl-结合,形成[CoCl4]2-的络合物,使滤液呈现特征蓝色[23],与实验中溶液颜色变化一致.浸出液中金属元素的后续回收过程通常包括过滤、沉淀或萃取等,即加入与金属离子结合能力更强的阴离子(如,OH-和等),实现金属元素的分离提纯和进一步的回收利用.
基于以上研究结果,表3列出了一些具有代表性的有机酸和DES对废旧LIBs中有价金属的提取效率数据[13,23~25,33,36~42].与已报道的有机溶剂和DES体系相比,氯化胆碱/苯磺酸/乙醇DES可以在短时间、温和的反应温度、少量溶剂且不添加额外还原剂的情况下,表现出优异的浸出性能,高效地浸出废旧LIBs中的Li和Co,且原料成本低,不产生二次污染.
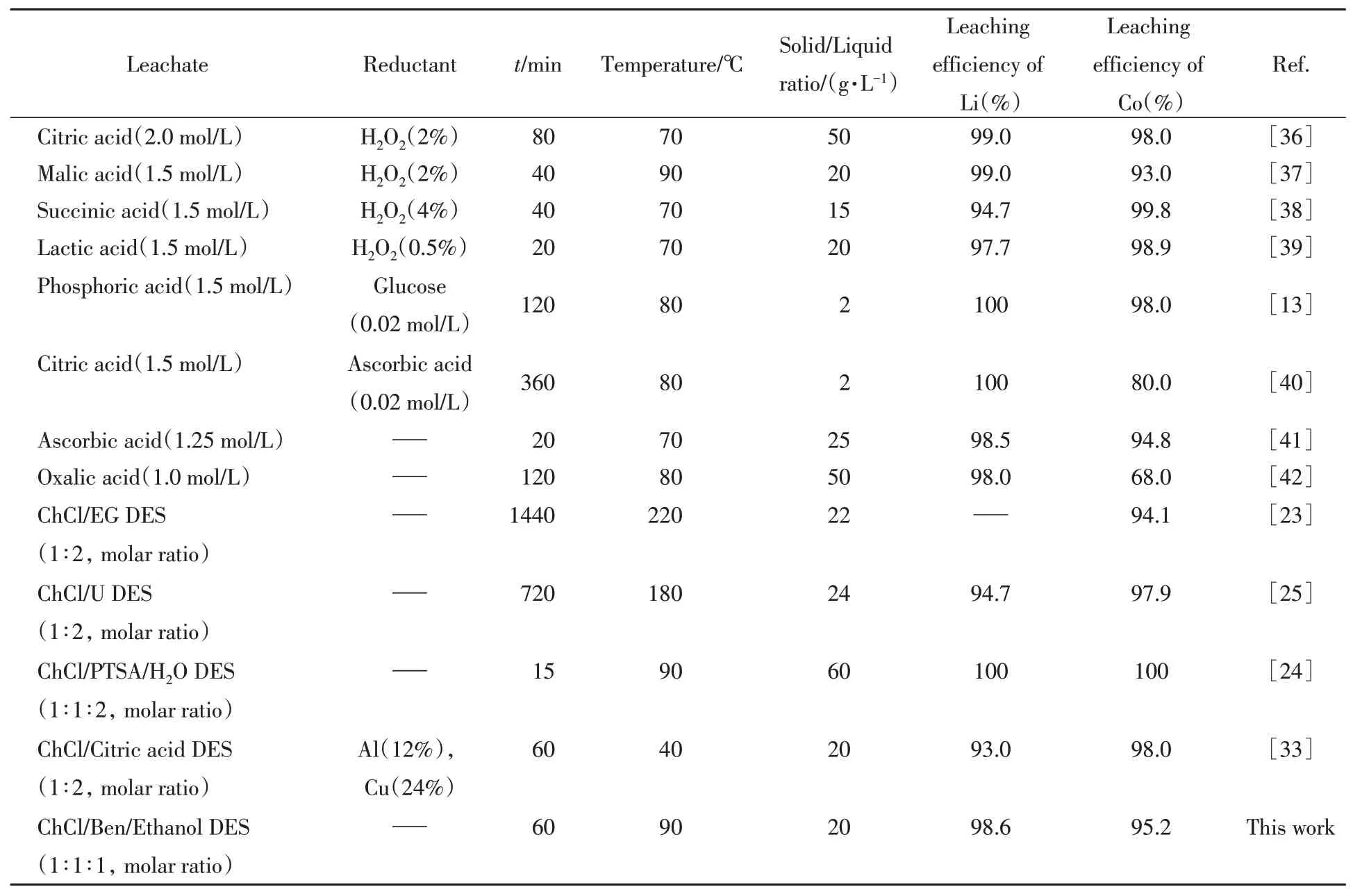
Table 3 Representative organic acids and DES for recycling spent LIBs*
3 结 论
基于绿色高效地从废旧LIBs中回收有价金属,合成了多种氯化胆碱/酸类DES,通过对DES的FT⁃IR和1H NMR谱图分析发现,氯化胆碱和不同的酸之间可以形成O—H…O和O—H…Cl-等类型的氢键.结果表明,4类DES对废旧LiCoO2正极材料的溶解浸出能力顺序为氯化胆碱/苯磺酸类DES>氯化胆碱/丙二酸类DES>氯化胆碱/草酸类DES>氯化胆碱/戊二酸类DES.其中氯化胆碱/苯磺酸/乙醇DES浸出性能最佳,Li和Co的浸出效率分别高达98.6%和95.2%.氯化胆碱/苯磺酸/乙醇DES可以作为一种绿色高效的废旧LIBs浸出剂,避免额外加入还原剂,在降低成本和减少二次污染方面极具优势,为高效回收废旧LIBs正极材料提供了一个新途径.