以人血清白蛋白为载体的Ru(Ⅲ)和全反式维甲酸共运输纳米药物的构建及抗肿瘤转移作用
2021-10-15师红东刘扬中
丁 鑫,师红东,刘扬中
(1.中国科学技术大学化学与材料科学学院化学系,合肥230026;2.深圳大学化学与环境工程学院,深圳518060)
癌症是严重威胁人类生命健康的主要疾病之一,跟据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球癌症报告预估,全球每年新增癌症患者1929万例,因癌症死亡996万例,而我国每年新增457万例,因癌症死亡300万例[1].在这些死亡病例中,超过90%患者是由于肿瘤转移导致死亡[2,3],而目前治疗肿瘤的化疗药物主要是针对原发性肿瘤,对转移病灶治疗效果较弱,这些药物虽然能够一定程度抑制肿瘤生长,但对于患者生存期没有显著提高,因此开发具有优异抗肿瘤转移效果的药物,才能够有效增长患者生存期,对癌症治疗具有重要意义[4~6].
目前,已有超过500多种相关抗肿瘤转移试剂被研究报道,研究最多的抗肿瘤转移药物主要包括血管增生抑制剂和基质金属蛋白酶抑制剂两类,美国食品和药物管理局(FDA)批准用于临床的抗肿瘤转移药物也属于这两类.然而,这些抗肿瘤转移药物由于无选择性的分子抑制和对患者生存期无显著提高,特别对于晚期患者几乎没有疗效,导致目前使用的抗肿瘤转移药物的抗肿瘤转移效果较弱[7,8],因此新型高效抗肿瘤转移试剂的研发迫在眉睫.[ImH][trans-RuCl4(DMSO)(Im)](NAMI-A)是咪唑和二甲基亚砜配位的Ru(Ⅲ)配合物,因其具有低的毒副作用和优异的抗肿瘤转移作用,被广泛用于科研临床抗肿瘤研究[9,10],然而由于没有显著改善患者生存期而在二期临床试验阶段被淘汰,但其优异的抗肿瘤转移作用仍被广泛研究.NAMI-A在生理环境下不稳定,易发生水解和被体内还原剂还原,其水解产物易与血清蛋白等体内分子反应,研究发现NAMI-A与血清蛋白的反应产物仍具有良好的抗肿瘤转移作用[11,12].
全反式维甲酸(ATRA)是维生素A酸在体内的代谢产物,能够促进细胞分化,具有低毒性,并可调节癌细胞的可塑性和运动性,具有抑制肿瘤转移的作用,被广泛用于鳞状细胞癌及黑色素瘤等癌症治疗[13];然而ATRA具有水溶性低(生理条件下只有0.21 μmol/L)、稳定性较差和半衰期短等缺陷,极大限制其了应用[14,15].目前,常采用纳米载体运输增加其水溶性和稳定性,显著增加了其体内循环时间,而且因实体瘤的高通透性和滞留效应(EPR效应),纳米药物可被动靶向富集到肿瘤组织[16,17],迄今已有使用脂质体、聚合物和人血清蛋白纳米颗粒负载ATRA用于癌症治疗的相关报道[18~21].
人血清蛋白(HSA)是血浆中含量最多的蛋白(35~50 g/L),因其具有疏水性结构域,在体内常用于疏水性分子运输,HSA表现出高度的水溶性、稳定性、生物安全性和可降解性,被广泛用作药物运输载体[22,23].
本文使用HSA纳米颗粒共运输Ru(Ⅲ)和ATRA,构建了可用于抗肿瘤转移的纳米药物.在生理条件下,NAMI-A中的氯、DMSO和咪唑配体逐渐解离,然后与HSA氨基酸侧链反应,而RuCl4(DMSO)2更易水解,其水解产物和NAMI-A水解产物类似,也能与HSA反应[11,12,24].因此,通过去溶剂法制备HSA纳米颗粒时,加入RuCl4(DMSO)2和ATRA,RuCl4(DMSO)2水解后与HSA反应,一方面使Ru(Ⅲ)负载到HSA上,另一方面Ru(Ⅲ)共价键结合HSA,可以充当交联剂以稳定HSA纳米颗粒;同时ATRA通过纳米颗粒的包覆作用及负载到HSA疏水结构域中,稳定地负载到HSA纳米颗粒中,从而制备出Ru(Ⅲ)和ATRA共运输的HSA纳米颗粒.通过Ru(Ⅲ)和ATRA的双重抗肿瘤转移作用,得到了具有高效抗肿瘤转移作用的纳米药物.
1 实验部分
1.1 试剂及仪器
三氯化钌水合物(RuCl3·3H2O)、全反式维甲酸(ATRA)、人血清白蛋白(HSA)、戊二醛、二氯亚砜(DMSO)和氢氧化钠购自上海阿拉丁生化科技股份有限公司;异硫氰酸荧光素(FITC)和噻唑蓝(MTT)购自上海碧云天生物技术有限公司;DMEM高糖培养基、胎牛血清和双抗试剂购自Hyclone公司;所用试剂均为分析纯.
BIO-RAD imark型酶标仪(美国伯乐公司);NexIon300X型电感耦合等离子体质谱仪(ICP-MS,美国Perkin Elmer公司;IX73P2F型荧光显微镜(日本Olympus公司);FS5型荧光光谱仪(英国Edinburgh Instruments有限公司;UV-8000S型紫外分光光度计(中国上海元析仪器有限公司);CytoFLEX型流式细胞分析仪(美国贝克曼);JEM-F200型场发射透射电子显微镜(TEM,日本JEOL公司);JSM-7800F型场发射扫描电子显微镜(SEM,日本JEOL公司).
1.2 RuCl4(dmso)2的制备
参照文献[25]方法制备RuCl4(DMSO)2.将200 mg RuCl3·3H2O分散于6 mL乙醇中,于80°C回流搅拌3 h,冷却至室温,抽滤去除不溶物.将滤液旋转蒸发浓缩至原体积的1/10,然后加入200 μL HCl(质量分数为37%)和400 μL DMSO,于80°C回流搅拌15 min,冷却至室温,加入冷丙酮溶液,产生橙红色沉淀,抽滤得到沉淀.将沉淀依次用冷丙酮和乙醚洗涤,干燥得到RuCl4(dmso)2.
1.3 Ru-ATRA-HSANP的制备
参照文献[26]方法,采用去溶剂法合成Ru-ATRA-HSANP1-2[n(Ru)∶n(ATRA)=1∶2].在800 μL HSA溶液(20 mg/mL)中加入100 μL RuCl4(DMSO)2溶液(20 mmol/L),混合均匀,然后加入18 μL NaOH溶液(1 mol/L),搅拌均匀,加入400 μL ATRA乙醇溶液(10 mmol/L),然后加入1.74 mL乙醇,室温下搅拌反应4 h以上,以15000 r/min转速离心5 min,去除上层清液,得到纳米颗粒.将所得颗粒超声分散于1 mL水中,再次离心洗涤,最终将颗粒分散于1 mL水中,得到Ru-ATRA-HSANP1-2.
采用相同方法,改变Ru和ATRA的用量合成Ru-ATRA-HSANP1-1和Ru-ATRA-HSANP1-4颗粒.
在800 μL HSA溶液(20 mg/mL)中加入100 μL RuCl4(DMSO)2溶液(20 mmol/L),混合均匀,然后加入18 μL NaOH溶液(1 mol/L),搅拌均匀后加入4 mL乙醇,室温下搅拌4 h以上,以15000 r/min转速离心5 min,去除上层清液,得到纳米颗粒.将所得颗粒超声分散于1 mL水中,再次离心洗涤,最终将颗粒分散于1 mL水中,得到Ru-HSANP颗粒,作为对照.
在800 μL HSA溶液(20 mg/mL)中加入9 μL NaOH溶液(1 mol/L),搅拌均匀,加入400 μL ATRA的乙醇溶液(10 mmol/L),再加入2 mL乙醇,搅拌15 min后加入10 μL戊二醛溶液(质量分数为8%),室温下搅拌4 h以上,以15000 r/min转速离心5 min,去除上层清液,得到纳米颗粒.将所得颗粒超声分散于1 mL水中,再次离心洗涤,最终将颗粒分散于1 mL水中,得到ATRA-HSANP颗粒,作为对照.
1.4 颗粒药物浓度的测定
通过紫外分光光型计检测了ATRA-HSANP和Ru-ATRA-HSANP中ATRA的浓度.首先测定ATRA在350 nm处的标准曲线,然后计算出制备颗粒时2次离心产生的上层清液中残留的ATRA摩尔量(n残留,μmol),通过制备颗粒时加入的ATRA总摩尔量(n总量,μmol)减去n残留,得到颗粒中的ATRA含量(n,μmol),即n=n总量−n残留,测量颗粒溶液的总体积V(L),即可计算出颗粒中的ATRA浓度cATRA=n/V.
利用ICP-MS测定了Ru-HSANP和Ru-ATRA-HSANP中Ru的浓度.取50 μL颗粒,用王水加热处理,蒸干溶液,残留物加入超纯水溶解,定容到5 mL,用ICP-MS测定其中的Ru浓度,经计算得到颗粒中Ru的浓度.
1.5 Ru-ATRA-HSANP稳定性研究
将100 μL Ru-ATRA-HSANP颗粒加入到含有体积分数为10%FBS的DMEM中,采用动态光散射法监测颗粒粒径随时间的变化.
1.6 Ru-ATRA-HSANP细胞摄取研究
首先使用FITC标记Ru-ATRA-HSANP1-2颗粒,即在制备Ru-ATRA-HSANP时,将HSA先与FITC搅拌反应30 min,再加入其它试剂制备颗粒,将颗粒离心水洗后得到FITC-Ru-ATRA-HSANP1-2颗粒.将HeLa细胞以800 cell/孔接种到48孔板中,培养24 h,分别加入不同浓度的FITC-Ru-ATRA-HSANP1-2(Ru:10,20,30和40 μmol/L)孵育8 h,或在相同颗粒浓度下(Ru:30 μmol/L)孵育不同时间(2,4,6和8 h),通过流式细胞仪检测颗粒在细胞中的摄取情况,同时用荧光显微镜拍摄不同孵育时间(1,2,4和8 h)下FITC-Ru-ATRA-HSANP1-2(Ru:30 μmol/L)的细胞荧光成像,观察颗粒的细胞摄取情况.
1.7 Ru-ATRA-HSANP细胞毒性实验
将A549细胞以3000 cell/孔接种到96孔板中,培养过夜,细胞用不同浓度的药物(Ru,ATRA,Ru-HSANP,ATRA-HSANP和Ru-ATRA-HSANP1-2)孵育,继续培养48 h后,每孔加入25 μL 5 mg/mL的MTT试剂,继续孵育4 h,去除培养基,每孔加入150 μL DMSO,置于摇床上振荡15 min,用酶标仪检测490 nm处的吸收值,处理数据后得到细胞存活率曲线.
1.8 划痕实验
将4T1细胞以2×105cell/孔接种到6孔板中培养24 h,用10 μL枪头划痕,轻微吹打去除悬浮细胞,换上新鲜培养基,分别加入ATRA(10 μmol/L),Ru-HSANP(10 μmol/L),ATRA-HSANP(10μmol/L),Ru-ATRA-HSANP1-2(Ru:10 μmol/L,ATRA:15 μmol/L)和Ru-ATRA-HSANP1-4(Ru:10 μmol/L,ATRA:30 μmol/L),继续培养48 h,通过荧光显微镜拍摄划痕愈合情况.
2 结果与讨论
2.1 合成与表征
采用去溶剂法制备HSA纳米颗粒,该方法是在HSA溶液中加入乙醇,由于HSA在乙醇中不溶,加入乙醇能使HSA蛋白聚集成颗粒,可以通过控制溶液pH值和盐浓度等调控蛋白质颗粒的大小,此时形成的蛋白质颗粒是由于乙醇所致,蛋白质分子间不形成共价键,在水中会再次解离成蛋白质分子,因此加入乙醇形成蛋白质颗粒后需要加入交联剂以交联蛋白质分子,形成共价键稳定的HSA纳米颗粒,实验中通过Ru(Ⅲ)和HSA表面基团反应来交联蛋白质颗粒,形成稳定的Ru-HSANP和Ru-ATRAHSANP颗粒.图1(A)和(B)给出Ru-ATRA-HSANP1-2的TEM和SEM图片,可见Ru-ATRA-HSANP1-2呈粒径为(80±20)nm的球状结构,动态光散射检测其平均水合粒径为100 nm[图1(C)],ζ电势为−24 mV.实 验 中 制 备 了Ru-HSANP,ATRA-HSANP,Ru-ATRA-HSANP1-1,Ru-ATRA-HSANP1-2和Ru-ATRAHSANP1-4颗粒,图1(D)给出其水溶液照片,可见含有Ru的颗粒溶液显示棕色,含有ATRA的颗粒溶液显示黄色,这些颗粒在水中均匀分散,长时间稳定.图1(E)给出Ru-HSANP,ATRA-HSANP,Ru-ATRA-HSANP1-1,Ru-ATRA-HSANP1-2和Ru-ATRA-HSANP1-4颗粒的水合粒径,可见5种颗粒的水合粒径为别为75,85,97,100和130 nm,随着ATRA加入量增加,颗粒粒径增大.图1(F)给出DMEM/FBS中Ru-ATRA-HSANP1-2颗粒粒径随时间的变化情况,可见72 h内颗粒粒径变化很小,说明颗粒在生理条件下具有优异的稳定性,DMEM/FBS常用于细胞培养基溶液和模拟血浆环境,颗粒在DMEM/FBS中稳定说明颗粒可用于生物体内药物运输.
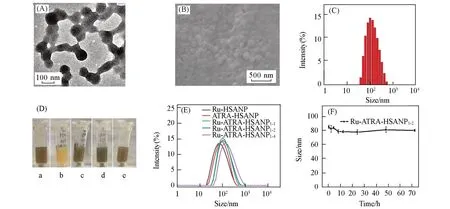
Fig.1 Characterization of Ru⁃ATRA⁃HSANP
2.2 Ru-ATRA-HSANP1-2细胞摄取研究
用FITC标记Ru-ATRA-HSANP1-2颗粒,通过荧光光谱仪检测FITC是否成功标记到颗粒上,结果如图2(A)所示,通过495 nm光激发,可以检测到FITC-Ru-ATRA-HSANP1-2颗粒在525 nm处有荧光发射,而Ru-ATRA-HSANP1-2颗粒则无荧光,说明FITC已标记到颗粒上.
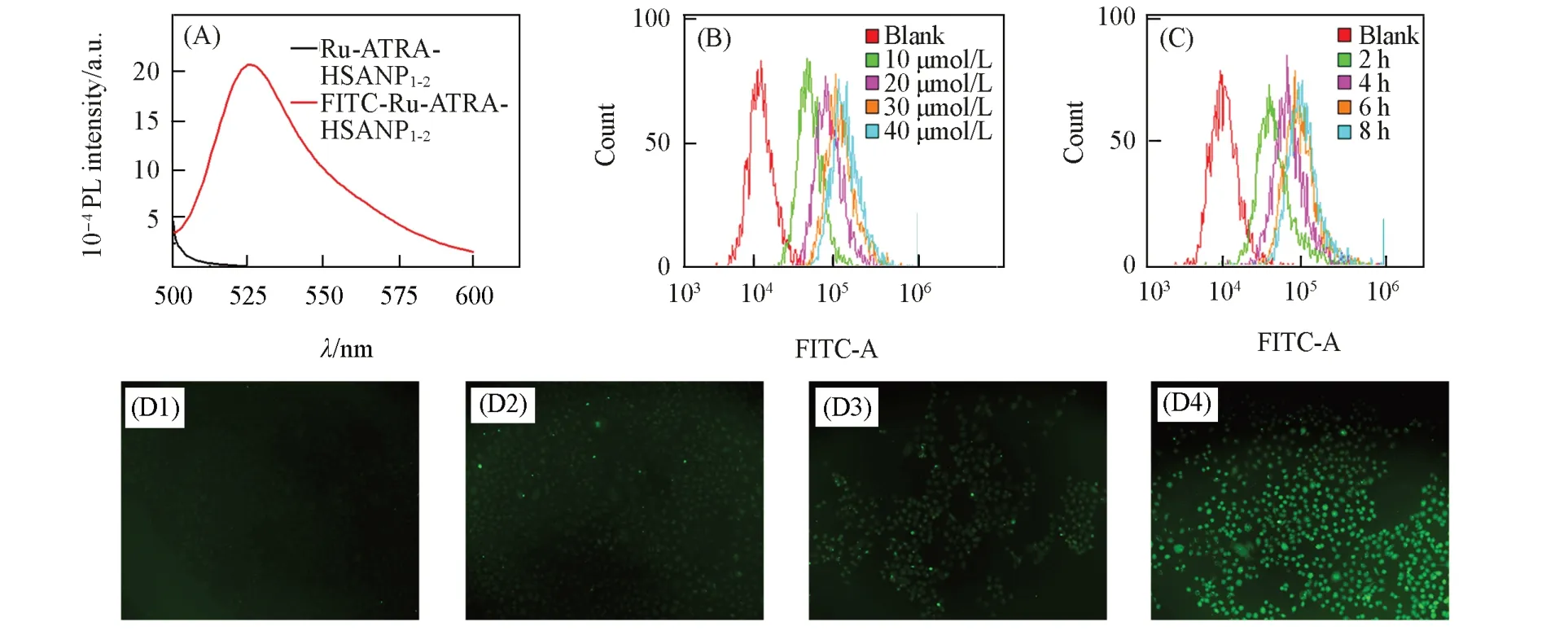
Fig.2 Cellular uptake of Ru⁃ATRA⁃HSANP1-2
通过流式细胞仪检测了不同浓度和不同孵育时间下FITC-Ru-ATRA-HSANP1-2颗粒在HeLa细胞中的摄取[图2(B)和(C)],可见随着颗粒浓度增加和孵育时间的增长,颗粒在细胞中的摄取逐渐增加,说明FITC-Ru-ATRA-HSANP1-2可以有效被细胞摄取.通过荧光显微镜检测了FITC-Ru-ATRA-HSANP1-2颗粒在细胞中的摄取[图2(D)],可见随着孵育时间的增长,细胞内绿色荧光逐渐增强,说明该颗粒可以有效被细胞摄取,且摄取量随着时间增加而增大.摄取实验结果说明Ru-ATRA-HSANP1-2可有效用于细胞内药物运输.
2.3 Ru-ATRA-HSANP1-2细胞毒性研究
利用MTT试剂检测了RuCl4(DMSO)2,ATRA,Ru-HSANP,ATRA-HSANP和Ru-ATRA-HSANP1-2对A549细胞的毒性(图3).由图3可见,RuCl4(DMSO)2直接加入DMEM/FBS培养基中会发生水解与FBS反应,几乎没有细胞毒性;载体HSANP几乎无细胞毒性[图3(C)],说明HSANP载体具有优异的生物相容性;而Ru-HSANP具有微弱的细胞毒性,同时负载了Ru和ATRA的Ru-ATRA-HSANP1-2具有一定的细胞毒性(IC50>100 μmol/L),其毒性与ATRA-HSANP相当,说明Ru-ATRA-HSANP1-2的细胞毒性主要受ATRA影响.由图3(B)可见,ATRA-HSANP和Ru-ATRA-HSANP1-2的细胞毒性比ATRA弱,说明该纳米药物可进一步减弱ATRA的毒性,且可以通过HSANP负载有效提高ATRA的水溶性和稳定性,更有利于生物体系应用.实验检测了Ru-ATRA-HSANP1-2对肝正常细胞LO2的细胞毒性[图3(D)和(E)],可见Ru-ATRA-HSANP1-2对LO2具有更低的细胞毒性,说明该纳米药物对正常细胞的毒性更低,是理想的纳米药物.
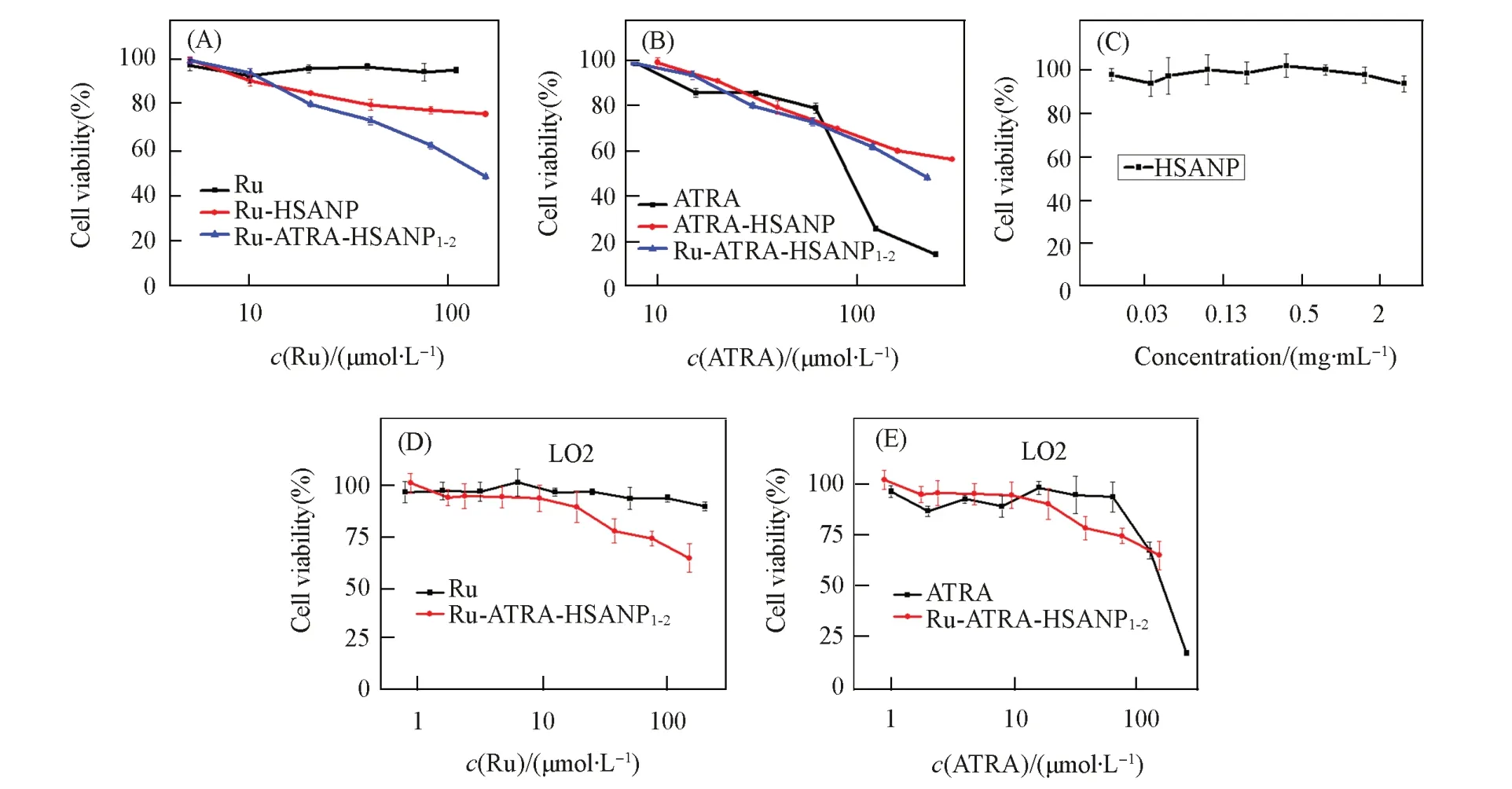
Fig.3 Inhibition effect of Ru⁃ATRA⁃HSANP1-2 on A549(A—C)and L02 cells(D—E)
2.4 Ru⁃ATRA⁃HSANP1-2抗肿瘤转移作用研究
使用具有高转移的乳腺癌4T1细胞,通过划痕实验研究了ATRA,Ru-HSANP,ATRA-HSANP,Ru-ATRA-HSANP1-2和Ru-ATRA-HSANP1-4的抗肿瘤转移作用.由图4可见,无药物处理时划痕在48 h后会铺满细胞:经Ru-HSANP处理的细胞其划痕间隔会缩小,但仍没有愈合,说明Ru-HSANP具有一定的抗肿瘤转移作用,但效果较弱;ATRA表现出优异的抗肿瘤转移作用,细胞没有向划痕方向生长;负载了ATRA的ATRA-HSANP,Ru-ATRA-HSANP1-2和Ru-ATRA-HSANP1-4颗粒都具有优异的抗肿瘤转移作用,细胞划痕不愈合.以上结果说明通过Ru交联且ATRA负载的HSA纳米颗粒(Ru-ATRA-HSANP)具有优异的抗肿瘤转移作用,可作为抗肿瘤转移试剂.
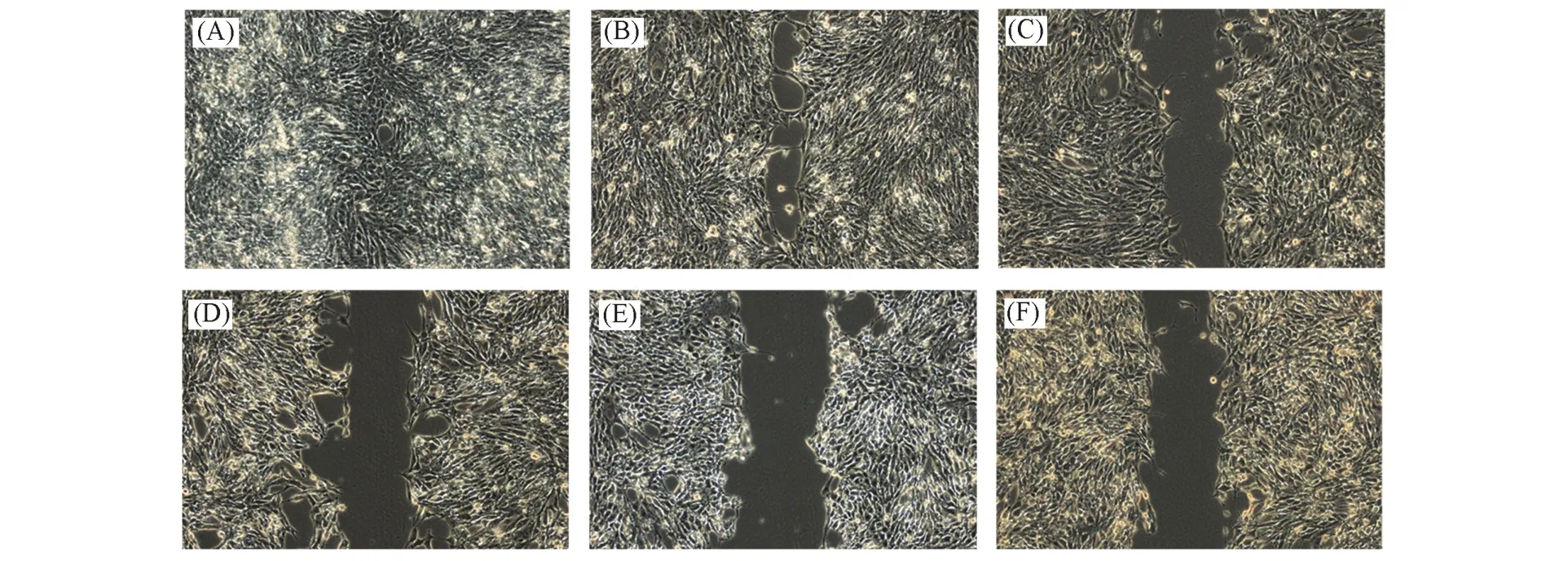
Fig.4 The results of wound⁃healing assay of 4T1 cells treated without(A)and with Ru⁃HSANP(B),ATRA(C),ATRA⁃HSANP(D),Ru⁃ATRA⁃HSANP1-2(E)and Ru⁃ATRA⁃HSANP1-4(F)
3 结 论
设计合成了一种以HSANP为载体的Ru(Ⅲ)和ATRA共运输体系,得到低毒性具有抗肿瘤转移的纳米药物(Ru-ATRA-HSANP).通过去溶剂法,一步合成了Ru(Ⅲ)交联HSA及ATRA负载的稳定纳米药物,该纳米颗粒尺寸合适(约80 nm)且在水中和生理条件下具有优异的稳定性,适用于生物体系应用;Ru-ATRA-HSANP可以有效被细胞摄取,且摄取量随颗粒浓度增加和孵育时间增长而增加,Ru-ATRA-HSANP表现出较弱的细胞毒性(IC50>100 μmol/L),但其具有优异的抗肿瘤转移作用.因此,本文构建了一种稳定低毒的抗肿瘤转移纳米药物,有望用于肿瘤抗转移治疗.